“运动因子”的研究进展
唐 晖, 周 亮, 蔡建光, 谢敏豪
(1. 湖南科技大学 体育学院, 湖南 湘潭 411201; 2. 北京体育大学 运动人体科学学院, 北京 100084)
1 问题的提出
多年以来, 运动人体科学工作者一直在寻找肌肉收缩刺激引起和调节中枢兴奋性和敏感性的物质,即“运动因子”(Exercise factor)或“工作因子”(Work factor). 丹麦学者Pedersen认为运动生理学的重要使命之一就是研究机械收缩引起的肌肉信号是如何传递给中枢和其他外周器官[1,2]. 因为运动时能满足机体需要的物质代谢和能量代谢等均出现了比较明显的变化, 而这种机体的需要似乎并不是此时中枢神经兴奋性的改变及某些我们已知的应对运动应激而改变的激素分泌就可以完全满足. 按照简单的逻辑推理, 机械收缩器官(骨骼肌)应该在运动开始后就能释放某种激素样物质而作用于各种调节机体物质和能量代谢的靶器官(如肝脏、脂肪组织等)及骨骼肌本身, 也就是说, 在运动器官(骨骼肌)与其它外周调节器官(相对于运动器官而言)之间应该存在某种联系的桥梁(图1).
通过上面的分析, 那么生理学上的所谓“运动因子”应该具有如下几个基本特征:
1)该基因在安静骨骼肌中不表达或很少表达, 由该基因指导合成的蛋白在安静时也不释放或很少释放进入循环血. 2)在机体运动时, 机体骨骼肌内该基因被迅速激活, 导致在运动过程中由该基因合成的蛋白从骨骼肌大量释放, 进入血液循环(另外如果该运动因子的主要作用是对机体运动后恢复期起调节作用, 那么只要是由运动触发的, 则在运动后该基因才大量表达及蛋白才大量释放应该也满足运动因子的基本要求). 3)由该基因指导合成的蛋白对机体物质代谢和能量代谢及机体功能具有调控作用. 4)肌肉收缩引起骨骼肌基因转录的信号通路到目前为止还不太清楚. 根据目前的认识, 机械收缩引起人体功能改变的细胞内信号转导途径可能与Ca2+信号途径、NO、能量敏感器AMP激活的蛋白激酶(AMP-activated kinase, AMPK)的激活及交感—肾上腺髓质系统的儿茶酚胺作用于骨骼肌的信号通路有关.因此在运动时, 骨骼肌内该基因的激活应该与这几种信号转导通路有关.
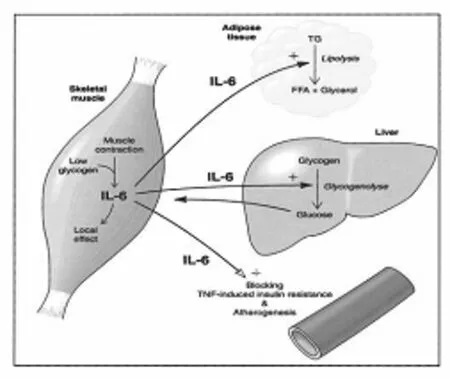
图1 以IL-6为例, 对运动时骨骼肌与外周器官联系的简图(引自Febbraio[10], 2002)
在人体内, 化学物质具有远距离代谢调控作用的一般来说只有激素, 难道骨骼肌也可能是一种内分泌器官, 它在运动时迅速分泌一种激素来调节人体在运动时的机体功能, 而这种内分泌作用在以前却并没有被人类所认识?
在过去十多年内, 已有较多研究表明运动对免疫系统产生复杂的生理效应. 随着运动促进机体大量细胞因子产生事实的发现, 在肌肉收缩活动与免疫功能改变之间就似乎存在一个紧密联系的桥梁. 经过学者的研究, 发现在肌肉收缩与激素改变之间以“运动因子”的形式紧密相连. 这些“运动因子”能够调节运动引起的其它器官, 如肝脏和脂肪组织功能的改变[3]. 近来的研究表明, 在不同人种与家族中, 骨骼肌产生与表达的“运动因子”是不同的. 这些“运动因子”可能包括Il-6、Il-8和IL-15及其它细胞因子[4,5]. 肌肉收缩对骨骼肌中这些“运动因子”的表达具有重要的调节作用.
2 IL-6:第一种被人们确定的“运动因子”
在这种背景下, 在近十年左右, 以丹麦哥本哈根肌肉研究中心实验室为主, 研究人员对运动应激反应变化最为明显和剧烈的细胞因子白细胞介素 6(interleukin-6, IL-6)进行了大量富有成效的开创性研究. 研究结果表明, 骨骼肌分泌的IL-6很可能就是人们要寻找的运动因子之一. 之所以这么说, 是因为肌源性符合“运动因子”的基本特征.
一是IL-6基因在安静的骨骼肌中并不表达, 但是当肌肉收缩时它就会迅速激活. 它在骨骼肌中的基因转录率比以前所报道的基因都要快, 并且转录的量也比其它基因都要多. 1998年, 丹麦学者Ostrowski研究运动员在一次马拉松运动前后, 某些炎症因子在血液中的水平及组织中的基因表达情况时, 发现血液中IL-6浓度在运动后即刻增加100倍以上, 运动后2小时显著恢复, 但仍远远高于运动前水平. 同时骨骼肌组织中检测到IL-6mRNA的表达, 然而, 在血液单核细胞中并没有检测到IL-6mRNA的表达[6]. 其它的研究也证实了这一点[7,8]. 但是尽管早期的研究表明IL-6mRNA在骨骼肌活检样本中表达增加, 但是它们不能证明骨骼肌收缩是引起IL-6增加的来源. 近来, 有实验表明, 收缩肌肉中IL-6的纯释放是运动引起动脉血IL-6增加的原因. 利用动静脉插管技术, 实验人员研究了运动侧和安静侧肢体中股动脉与股静脉血IL-6浓度的差别, 结果发现运动侧肢体释放IL-6, 而安静侧肢体没有显著性意义的IL-6释放[9].
二是较多的研究均报道, IL-6在运动时的大量释放的主要作用是调节机体的物质代谢与能量代谢[10].Gleeson认为[11], 收缩肌肉释放的IL-6很可能作为一种激素随血液循环运送到肝脏, 从而调节在运动过程中对维持血糖平衡具有重要作用的肝脏葡萄糖输出. Stouthard的工作[12]显示了IL-6和葡萄糖转运具有重要关系, 他的实验表明, 与对照组相比, 给人体受试者补充人重组IL-6(recombine human interleukin-6,rhIL-6)能增加全身的葡萄糖利用和氧化; 甚至尽管补充rhIL-6的内源性葡萄糖产生增加, 实验组的代谢清除率也更高, 说明相对的高血糖不是造成葡萄糖利用增多的原因. 另外, 还有研究表明IL-6在运动时大量释放后对机体的脂代谢具有重要调节作用. 有实验结果显示[13], 注射rhIL-6会导致循环血游离脂肪酸浓度增加, 同时伴随着脂肪细胞葡萄糖转运能力的增强. Wallenius发现[14], IL-6基因型缺失转基因大鼠成年后出现继发性肥胖, 并且成熟期该大鼠和野生型对照组相比, 当服用IL-6十八天后, 该大鼠体重明显降低,而对照组没有出现. 另外在骨骼肌中可获得的碳水化合物对IL-6的基因转录具有调节作用[9], 显示IL-6可能是一种能量敏感器(Energy sensor). 还有研究发现[15], 肌源性IL-6可以在一定程度上抑制肿瘤坏死因子(Tumour necrosis facyor-α, TNF-α)的产生, 因此就在一定程度上抑制了TNF-α诱导的胰岛素抵抗, 这也表明IL-6对运动促进身体健康方面具有一定的调节作用.
三是运动诱导骨骼肌IL-6基因转录与蛋白释放的信号通路虽然还没有完全研究清楚, 但已有研究表明它与Ca2+信号途径、能量敏感器AMPK的激活及交感—肾上腺髓质系统的儿茶酚胺作用于骨骼肌的信号通路的激活具有紧密关联[10].
随着人们对肌源性IL-6生物学作用的深入了解, Pedersen正式提出, IL-6可能是一种“运动因子”, 它在运动时主要产生于骨骼肌, 释放入血后随血液循环运送到各靶器官(如肝脏、脂肪等)而发挥生物学效应[1].Bruumsgaard则提出骨骼肌也是一种内分泌器官, 它能分泌IL-6等激素[16]. Pedersen还提议[1], 将IL-6和其它一些由骨骼肌产生和释放, 并对机体其它组织器官(如肝脏,脂肪等)产生效应的细胞因子称为“肌因子”(myokines).
3 其它可能的“运动因子”
(1)IL-8
白细胞介素8(Interleukin-8, IL-8)是在1987年作为中性粒细胞激活因子由三个独立的实验小组同时发现的. IL-8属于CXC趋化因子家族, CXC家族的命名与它的序列在相聚氨末端一个氨基酸的位置存在两个保守的半胱氨酸残基有关. IL-8属于CXC趋化因子家族亚型, 因为这些蛋白质的基本结构均在第一个保守半胱氨酸残基前面含有一个ELR氨基酸序列(Glu-Leu-Arg)[17]. IL-8是一种趋化因子, 能够吸引中性粒细胞.除了趋化因子属性外, 它还是一种血管生成因子.
剧烈运动至力竭, 如跑步, 或者人体进行离心运动为主的运动时, 血浆IL-8浓度增加[18]. 然而, 进行中等强度的向心运动时, 如自行车功率计时, 血浆IL-8浓度却没有变化[19]. 不过, 也有文献报道[20], 在自行车功率计上进行剧烈时, 血浆IL-8浓度会出现轻微的上升.
人们开始关注正在收缩的骨骼肌是否表达IL-8. 最初的研究由Nieman等人完成, 他们发现[21], 受试者在跑步机上完成3h的间歇运动后进行肌肉活检, 血浆IL-8浓度上升, 同时其骨骼肌内IL-8mRNA也增加数倍. 另外一项相似的实验是受试者在功率自行车上进行1h的运动, 骨骼肌内IL-8mRNA增加与其类似,但是受试者体内血浆IL-8浓度却没有改变[19]. Pedersen的一个实验结果发现[22], 在一次向心运动后, 在骨骼肌内清楚地看到了IL-8蛋白的表达, 在这次运动和随后的运动及恢复期中, 都看到了骨骼肌内IL-8mRNA转录增加及IL-8蛋白的表达, 结果显示运动本身会刺激骨骼肌细胞产生IL-8. Louis的研究也发现, 在一次急性抗阻运动或跑步以后的24h内, 在骨骼肌内IL-8mRNA在运动后即刻增加2.7倍, 随之下降, 但是从运动结束后2h又开始升高, 抗阻运动在运动后4h达到峰值, 升高了759倍, 跑步则是在运动后 8h达到峰值, 增加的幅度与抗阻运动相差不大. 表明运动诱导骨骼肌IL-8基因转录具有双峰特征[23].
骨骼肌内IL-8的生理学功能还不太清楚. 离心运动中循环血IL-8浓度的增加很有可能是炎症反应的结果. 与此结果一致的是, 在向心运动中及运动后, 并没有发现循环血IL-8浓度的上升. 然而, 测定运动一侧肢体动静脉IL-8浓度差时, 有学者发现了少量并且短暂的IL-8纯释放, 虽然这并没有导致循环血IL-8浓度的增加[24]. 因此, 较高的工作肌内局部IL-8表达和少量而短暂的IL-8蛋白释放可能显示肌源性IL-8以自分泌或旁分泌的形式起一个局部调节的作用. 肌源性IL-8的另一个作用可能是趋化吸引中性粒细胞和巨噬细胞, 因为在离心运动时, 很少或几乎没有中性粒细胞和巨噬细胞在骨骼肌内堆积.
已经有研究显示骨骼肌内IL-8的释放与胰岛素抵抗具有重要的关联[25]. 有学者发现[26], 运动引起机体内NO产生会调控骨骼肌内各种基因的转录, 其中就包括IL-8, 表明运动诱导的骨骼肌IL-8基因转录与蛋白局部释放可能与NO信号通路有关. 糖原合成酶激酶3β(glycogen synthase kinase-3β, GSK3β)是调节细胞内各种生理功能的重要的信号通路, 还有学者发现[27], GSK3β可以调节机体细胞IL-8基因的转录与蛋白释放.
肌源性IL-8的以上作用显示了与机体代谢的关系, 但是这些作用还没有得到确认. 肌源性IL-8的一个比较重要的功能是刺激血管生成. IL-8的此作用和CXC受体1(CXC-chemokine receptor 1, CXCR1)及受体2(CXC-chemokine receptor 2, CXCR2)有关. 它通过CXCR1而发挥趋化作用, 然而, 在人毛细血管内皮细胞表达的CXCR2对于IL-8调控血管生成具有重要作用[28]. 实验表明, 离心运动后对骨骼肌进行肌肉活检,发现了IL-8 CXCR2的表达[29], 并且与运动前相比, 自行车运动后恢复期骨骼肌内IL-8 CXCR2 mRNA水平显著增加. 通过免疫组化技术, 可以看到增加的IL-8 CXCR2蛋白存在于血管内皮和肌纤维内. 因此该研究表明, 离心运动引起的IL-8 CXCR2 mRNA和IL-8 CXCR2蛋白存在于肌纤维内的血管内皮中[29].
因此, 综上所述, 较高的工作肌内局部IL-8表达和少量而短暂的IL-8蛋白释放显示肌源性IL-8的局部调节作用. 运动一侧肢体产生的IL-8可能通过毛细血管内皮细胞内的CXC受体2而发挥效应. 运动, 特别是离心运动引起的IL-8 CXCR2 mRNA和IL-8 CXCR2蛋白增加提示肌源性IL-8可能通过CXCR2信号途径而刺激血管生成. 因此, 基本可以确定, 肌源性IL-8很有可能是一种“运动因子”或“肌因子”[30].
(2)IL-15
IL-15(14-15kDa)是一种含有四个α螺旋的细胞因子, 结构与IL-2相似[31]. 由于糖基化位点不同, IL-15存在两种亚型: 从细胞分泌的长信号肽形式(48个氨基酸)和保存在细胞内的短信号肽形式( 21个氨基酸). 在调节出胞功能, 而不是分泌时, 细胞膜表达就显得非常关键. 因此, 这也部分说明了在生物体内测定可溶性IL-15为什么这么困难. IL-15通过广泛分布的异三聚体受体(IL-15R)而起作用, 该受体由三条链: α链、β链和γ组成8种亚型. 与IL-2类似, IL-15Rαβγ复合体信号通过JNk1和JNK2信号转导途径[32].
IL-15对肌肉收缩的调节作用到目前为止还不太清楚. Nieman等[21]发现 3h运动后即刻, 骨骼肌内IL-15mRNA水平没有显著性改变. Ostrowski等[7]的实验结果也表明, 2.5h的跑台运动后即刻到恢复期6h内,血浆IL-15浓度也没有发生显著性改变. 然而, 却有实验结果表明[33], 在一次急性抗阻训练后, 血浆IL-15浓度立即显著增加.
IL-15在骨骼肌中高度表达, 被定义为一种同化因子[34]. 并且, 人们认为IL-15在肌肉与脂肪组织的相互作用中具有重要意义. 在人类骨骼肌的肌细胞培养中, 当细胞开始分化后, IL-15导致肌细胞肌球蛋白重链堆积增加, 表明在肌细胞生长中, IL-15是一种同化因子[35]. 并且, IL-15以不依赖于胰岛素样生长因子的途径而刺激肌细胞分化[36]. 与IGF-1相反的是, IL-15对完全分化的成肌细胞都还有效[37]. 在一个在体实验中, IL-15的潜在治疗作用已经得到了证实, 实验表明在一个恶性肿瘤模型中, IL-15可以拮抗癌症引起的骨骼肌蛋白质降解的增多. 有意思的是, 已有实验可靠地表明IL-15不管是在在体还是在离体骨骼肌中都具有同化作用时, 它似乎对减少脂肪组织具有重要作用. 成年大鼠注射IL-15经过 7天后, 白色脂肪组织体积减少了33%[38]. 这种脂肪组织对IL-15的反应与IL-15/ IL-15受体复合物表达的量有密切关系, 表明了IL-15对脂肪组织具有直接的作用[39]. 有实验研究了IL-15mRNA在3T3-L1成脂肪细胞和C2C12小鼠成肌细胞表达的情况, 实时定量PCR检测结果表明, IL-15mRNA只有在C2C12小鼠成肌细胞中表达, 并且与没有分化的成肌细胞相比, 在已经分化成肌管的细胞中表达的增加9倍, 而在脂肪细胞中几乎没有发现IL-15mRNA的表达[40]. 这些实验发现充分表明IL-15作用于肌肉—脂肪内分泌轴, 并且调节身体成分和胰岛素抵抗.
总之, IL-15是一种最近发现的, 在骨骼肌中高度表达的同化因子, 并且力量训练可以影响它在骨骼肌中的表达. 一方面IL-15 具有很强的同化作用; 另一方面, 它对于减少脂肪组织体积又具有重要作用.所有这些均表明IL-15在肌肉与脂肪的相互作用中具有重要意义. 因此它也可能是一种我们的认识还远远不够的运动因子或肌因子[30].
综上所述, “运动因子”或“肌因子”概念的提出对于我们更好地理解人体在急性运动中的反应及训练中的适应规律具有重要的意义. 就像上文所说的, 在人体对运动的调节过程中, 运动器官本身(骨骼肌)也应该具有一定的作用, 而以前我们总以为主要是神经系统和内分泌系统在起作用. 并且, 国内外学者对“运动因子”的研究还处于一个起步阶段, 还有太多的未知没有阐明, 需要运动人体科学工作者进一步的努力.
[1]Pedersen BK, Steensberg A, Fischer C, et al. The metabolic role of IL-6 produced during exercise: is IL-6 an exercise factor [J]? Proc Nutr Soc, 2004,63(2): 263~267
[2]Pedersen BK, Steensberg A, Fischer C, et al. Searching for the exercise factor: is IL-6 a candidate[J]? J Muscle Res Cell Motil, 2003, 24(2-3): 113~119
[3]Pedersen BK, Febbraio M. Muscle-derived interleukin-6—a possible link between skeletal muscle, adipose tissue, liver and brain[J]. Brain Behav Immun,2005, 19(5): 371~376
[4]Pedersen BK, Fischer CP. Beneficial health effects of exercise—the role of IL-6 as a myokine[J]. Trends Pharmacol Sci, 2007, 28(4): 152~156
[5]Pedersen BK, Akerstrom TC, Nielsen AR, et al. Role of myokines in exercise and metabolism[J]. J Appl Physiol, 2007, 103(3): 1093~1098
[6]Ostrowski K, Rohde T, Zacho M, et al. Evidence that IL-6 is produced in skeletal muscle during prolonged running[J]. J Physiol, 1998, 508(3): 949~953
[7]Ostrowski K, Hermann C, Bangash A, et al. A trauma-like elevation in plasma cytokines in humans in response to treadmill running[J]. J Physiol, 1998,513(3): 889~894
[8]Jonsdottir IH, Schjerling P, Ostrowski K, et al. Muscle contractions induce interleukin-6 mRNA production in rat skeletal muscle[J]. J Physiol, 2000,528(1): 157~163
[9]Steensberg A, van Hall G, Osada T, Set al. Production of IL-6 in contracting human skeletal muscles can account for the exercise-induced increase in plasma IL-6[J]. J Physiol, 2000, 529(1): 237~242
[10]Febbraio MA, Pedersen BK. Muscle-derived interleukin-6: mechanisms for activation and possible biological roles[J]. FASEB J, 2002, 16(11):1335~1347
[11]Gleeson M. Perspectives: Interleukins and exercise[J]. J Physiol, 2000, 529: 1
[12]Stouthard JM, Romijn JA, Van PT, et al. Endocrinologic and metabolic effects of interleukin-6 in humans[J]. Am J Physiol, 1995, 268: E813–E819
[13]Stouthard JM, Oude Elferink RP, Sauerwein HP. Interleukin-6 enhances glucose transport in 3T3-L1 adipocytes[J]. Biochem biophys Res Commun,1996, 220(2): 241~245
[14]Wallenius V, Wallenius K, Ahren B, et al. Interleukin-6-deficient mice develop mature-onset obesity[J]. Nat.Med, 2002, 8(1): 75~79
[15]Tanaka T, Kanda T, McManus BM, et al. Over-expression of interleukin-6 aggravates viral myocarditis: impaired increase in tumor necrosis factor-alpha[J]. J Mol Cell Cardiol, 2001, 33(9): 1627~1635
[16]Bruumsgaard H. Physical activity and modulation of systemic low-level inflammation[J]. J Leukocyte Biology, 2005, 78 (4): 1~17
[17]Baggiolini M. Chemokines in pathology and medicine[J]. J Intern Med, 2001, 250: 91~104
[18]Nieman DC, Henson DA, Smith LL, et al. Cytokine changes after a marathon race[J]. J Appl Physiol, 2001, 91: 109~114
[19]Chan MH, Carey AL, Watt MJ, et al. Cytokine gene expression in human skeletal muscle during concentric contraction: evidence that IL-8, like IL-6, is influenced by glycogen availability [J]. Am J Physiol Regul Integr Comp Physiol, 2004, 287: R322~R327
[20]Mucci P, Durand F, Lebel B, et al. Interleukins 1-beta, -8, and histamine increases in highly trained, exercising athletes[J]. Med Sci Sports Exerc, 2000,32: 1094~1100
[21]Nieman DC, Davis JM, Henson DA, et al. Carbohydrate ingestion influences skeletal muscle cytokine mRNA and plasma cytokine levels after a 3-h run[J]. J Appl Physiol, 2003, 94: 1917~1925
[22]Akerstrom TC, Steensberg A, Keller P, et al. Exercise induces interleukin-8 expression in human skeletal muscle[J]. J Physiol, 2005, 563: 507–516
[23]Louis E, Raue U, Yang Y, et al. Time course of proteolytic, cytokine, and myostatin gene expression after acute exercise in human skeletal muscle[J]. J Appl Physiol, 2007, 103(5): 1744~1751
[24]Akerstrom TC, Steensberg A, Keller P, Keller C, Penkowa M, Pedersen BK. Exercise induces interleukin-8 expression in human skeletal muscle[J]. J Physiol, 2005, 563: 507~516
[25]Sell H, Eckardt K, Taube A, et al. Skeletal muscle insulin resistance induced by adipocyte-conditioned medium: underlying mechanisms and reversibility[J]. Am J Physiol Endocrinol Metab, 2008, 294(6): E1070~E1077
[26]Steensberg A, keller C, Hillig T, et al. Nitric oxide production is proximal signaling event controlling exercise-induced mRNA expression in human skeletal muscle[J]. FASEB J, 2007, 21(11): 2683~2694
[27]Choi JH, Hur J, Yoon CH, et al. Augmentation of therapeutic angiogenesis using genetically modified human endothelial progenitor cells with altered glycogen synthase kinase-3bata activity[J]. J Biol Chem, 2004, 279(47): 49430~49438
[28]Bek EL, McMillen MA, Scott P, et al. The effect of diabetes on endothelin, interleukin-8 and vascular endothelial growth factor-mediated angiogenesis in rats[J]. Clin Sci, 2002, 103 Suppl 48: 424S~429S
[29]Frydelund-Larsen L, Penkowa M, Akerstrom T, et al. Exercise induces interleukin-8 receptor (CXCR2)expression in human skeletal muscle[J]. Exp Physiol, 2007, 92: 233~240.
[30]Nielsen S, Pedersen BK. Skeletal muscle as an immunogenic organ[J]. Curr Opin Pharmacol, 2008, 8(3): 346~351
[31]Bamford RN, Grant AJ, Burton JD, et al. The interleukin (IL)2 receptor beta chain is shared by IL-2 and a cytokine, provisionally designated IL-T, that stimulates T-cell proliferation and the induction of lymphokine-activated killer cells[J]. Proc Natl Acad Sci, 1994, 91: 4940~4944
[32]Bassuk SS, Manson JE. Epidemiological evidence for the role of physical activity in reducing risk of type 2 diabetes and cardiovascular disease[J]. J Appl Physiol, 2005, 99: 1193~1204
[33]Riechman SE, Balasekaran G, Roth SM, et al. Association of interleukin-15 protein and interleukin-15 receptor genetic variation with resistance exercise training responses[J]. J Appl Physiol, 2004, 97: 2214~2219
[34]Grabstein KH, Eisenman J, Shanebeck K, et al. Cloning of a T cell growth factor that interacts with the beta chain of the interleukin-2 receptor[J].Science, 1994, 264: 965~968
[35]Furmanczyk PS, Quinn LS. Interleukin-15 increases myosin accretion in human skeletal myogenic cultures[J]. Cell Biol Int, 2003, 27: 845~851.
[36]Quinn LS, Haugk KL, Damon SE. Interleukin-15 stimulates C2 skeletal myoblast differentiation[J]. Biochem Biophys Res Commun, 1997, 239: 6~10
[37]Quinn LS, Anderson BG, Drivdahl RH, et al. Overexpression of interleukin-15 induces skeletal muscle hypertrophy in vitro: implications for treatment of muscle wasting disorders[J]. Exp Cell Res, 2002, 280: 55~63
[38]Carbo N, Lopez-Soriano J, Costelli P, et al. Interleukin-15 mediates reciprocal regulation of adipose and muscle mass: a potential role in body weight control[J]. Biochim Biophys Acta, 2001, 1526: 17~24
[39]Alvarez B, Carbo N, Lopez-Soriano J, et al. Effects of interleukin-15 (IL-15)on adipose tissue mass in rodent obesity models: evidence for direct IL-15 action on adipose tissue[J]. Biochim Biophys Acta, 2002, 1570: 33~37
[40]Quinn LS, Strait-Bodey L, Anderson BG, et al. Interleukin-15 stimulates adiponectin secretion by 3T3-L1 adipocytes: evidence for a skeletal muscle-to-fat signaling pathway[J]. Cell Biol Int, 2005, 29: 449~457

