高取代度CMC取代度的紫外光谱法快速测定*
叶君 张燕兴 熊犍
(1.华南理工大学制浆造纸工程国家重点实验室,广东广州510640;2.华南理工大学轻工与食品学院,广东广州510640;3.广东省造纸研究所,广东广州510300)
羧甲基纤维素(CMC)是一种天然纤维素经化学改性得到的阴离子型纤维素醚,是目前最重要的水溶性纤维素衍生物之一.CMC的取代度(DS)是指分子中每个葡萄糖苷单元上的羟基(—OH)通过醚键被羧甲基钠代替的平均数目.取代度是衡量CMC品质的最重要指标之一,不同取代度的CMC因具有不同的溶解性、吸附性、酸沉淀pH值、抗盐性、酶解性等而在应用方面有所差别[1-2].譬如,在造纸工业中,作为涂料保水剂和表面施胶剂的CMC,其取代度应在0.70~0.85之间为好;为改善纸页成型匀度而作分散剂用的CMC,其取代度应控制在0.70~0.90之间比较合适;湿部添加中作为增强剂的 CMC,其取代度最好低于0.70.因此,取代度的测定是CMC分析测定领域研究的重要内容.
测定CMC取代度的传统方法有灰碱法、酸洗法、电导滴定法、比色法等,现代分析方法有核磁共振法(1HNMR和13C NMR)、色谱法(HPLC、SEC和AEC)、电泳法(CZE)等.传统方法都是化学分析方法,存在耗时长、步骤复杂或准确度低等缺点;而现代分析方法大部分需要先将CMC进行酶水解,通过测定水解单体得到取代度大小及取代分布信息,实验结果准确度高,但是因其周期长,所以只局限于实验室的分析而不能满足工业上的日常快速检测的要求[3-5].
研究发现[6],CMC-Cu(Ⅱ)配合物在紫外光谱区有吸收,并且其吸光值的增加与CMC中的羧基含量存在一定的关系,因此文中提出利用紫外光谱法测定CMC的取代度,并对该方法是否可较准确、快速地测定高取代度CMC的取代度进行证实.
1 实验部分
1.1 试剂与仪器
羧甲基纤维素钠,型号FH6,重庆力宏精细化工有限公司;五水合硫酸铜、硫酸、氢氧化钠,均为分析纯,广东光华化学厂有限公司.
Agilent 8453型紫外-可见分光光度计,安捷伦科技有限公司.
1.2 实验方法
1.2.1 CMC-Cu(Ⅱ)配合物紫外吸光值的测定
称量约0.250g CMC溶于蒸馏水中,并转移到500 mL容量瓶中,稀释至刻度线;用移液管移取10mL所配制的CMC溶液,分别置于22个50mL容量瓶中,然后分别加入2mmol/L 硫酸铜溶液1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、18、20、22、24、26、30mL,并分别用蒸馏水稀释至刻度线.将溶液进行紫外光谱扫描,记录溶液在242.0nm处的吸光值D.
1.2.2 CMC取代度的测定
(1)灰碱法
灰碱法是测定CMC取代度的国家标准方法,实验步骤按照GB 1904—2005标准测试方法进行[7].
(2)CMC-Cu(Ⅱ)配合物紫外光谱法
称量约0.040 g CMC测试样品溶于蒸馏水中,并转移到100mL容量瓶中,稀释至刻度线.用移液管分别移取10 mL所配制的CMC溶液于7~9个50mL容量瓶中,然后按1.2.1节方法加入2mmol/L硫酸铜溶液并进行紫外光谱扫描,加入体积控制在9mL以内.采用2.2节所述的方法求出CMC中羧基与Cu(Ⅱ)离子完全作用所消耗的硫酸铜溶液体积V(CuSO4),并计算CMC的取代度.
2 结果与讨论
2.1 CMC-Cu(Ⅱ)溶液的紫外光谱吸收分析
CMC在紫外光谱区的193.0nm处有吸收.0.5g/L的CMC与2mmol/L的硫酸铜稀溶液混合后,在紫外光谱区的242.0nm处有较强吸收(如图1所示),这一吸收峰为CMC-Cu(Ⅱ)配合物的特征吸收峰.在CMC质量浓度一定时,其吸收强度随着硫酸铜溶液用量的增加而增大(如图2所示).
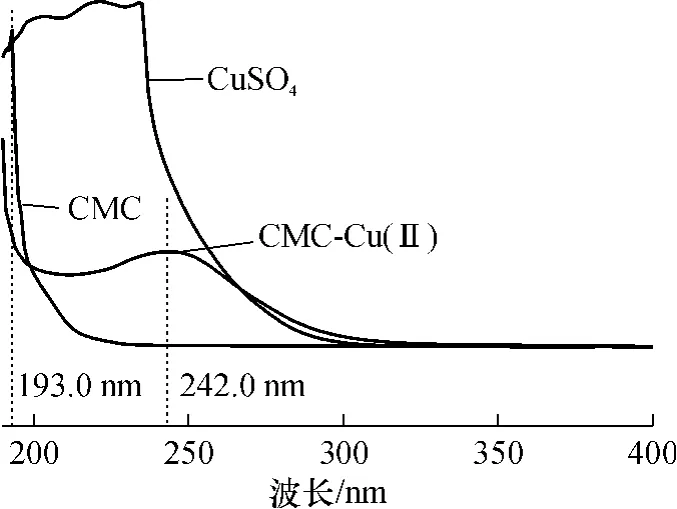
图1 CMC、CuSO4及CMC-Cu(Ⅱ)的紫外光谱Fig.1 UV spectra of CMC,CuSO4and CMC-Cu(Ⅱ)
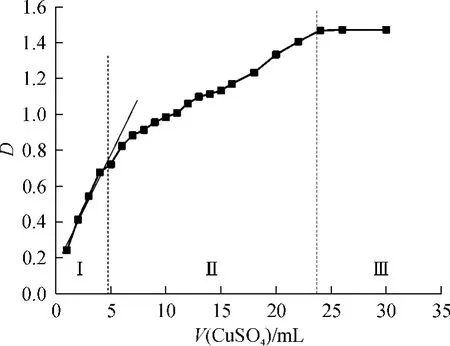
图2 242.0nm处CMC-Cu(Ⅱ)溶液的吸光值与硫酸铜体积的关系Fig.2 Relationship between UV absorbance of CMC-Cu(Ⅱ)and CuSO4volume at 242.0nm
图2为CMC-Cu(Ⅱ)配合物在242.0 nm处的吸光值随所滴加硫酸铜溶液体积的变化情况.可以将图中D-V曲线分为3个区域(Ⅰ、Ⅱ、Ⅲ):随着硫酸铜溶液的滴加,Ⅰ区中CMC-Cu(Ⅱ)配合物的吸光值增加趋势最快,进入Ⅱ区后吸光值增加趋势变缓,进入Ⅲ区后曲线趋于平稳.
金属离子和水溶性聚合物的相互作用主要有静电作用和配位作用,还有少数是聚合物疏松的表面对金属离子的吸附作用[8].聚阴离子CMC分子链上的羟基和羧基均可与 Cu(Ⅱ)离子发生作用.Cu(Ⅱ)离子首先与CMC中的羧基发生作用[9],因此在Ⅰ区中主要是CMC中羧基以配位键形式与Cu(Ⅱ)离子作用形成CMC-Cu(Ⅱ)配合物,且其按化学计量式进行[10],换言之,其生成的 CMC-Cu(Ⅱ)配合物的浓度与硫酸铜用量成正比,如下式所示,式中R为纤维二糖单元.
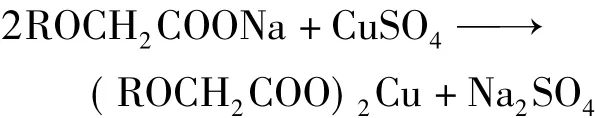
随着CMC-Cu(Ⅱ)配合物的生成,CMC链上的电荷密度减小,链趋向于卷曲,此时,CMC表面的羟基也随之与Cu(Ⅱ)离子发生吸附作用,并且反应到一定程度时形成浅蓝色絮状沉淀.因此随着硫酸铜溶液的继续滴加,溶液在242.0nm处的吸光值仍然继续增加,但增加的速度明显变缓(见图2中Ⅱ区),直至最终吸附达到饱和,而此时溶液吸光值趋向稳定,即图2中Ⅲ区所示.
2.2 CMC取代度的紫外光谱法测定
2.2.1 测定原理
由上述分析可知,图2中Ⅰ区代表CMC中羧基与Cu(Ⅱ)离子完全作用生成CMC-Cu(Ⅱ)配合物,此时产物生成量与其紫外吸光值符合Lambert-Beer定律,即式(1),且其与所消耗的硫酸铜的物质的量成正比,在硫酸铜浓度一定时,与其体积成正比.因此根据式(1),将Ⅰ区中CMC-Cu(Ⅱ)配合物的D与对应的V拟合成一条直线,D-V曲线与拟合直线的吸光值最大处交点即为CMC-Cu(Ⅱ)配合物在Ⅰ区的最大吸收强度点,该点对应的硫酸铜溶液体积应为CMC中羧基与Cu(Ⅱ)离子完全作用生成配合物所消耗的体积,由此可利用式(2)计算CMC的取代度.
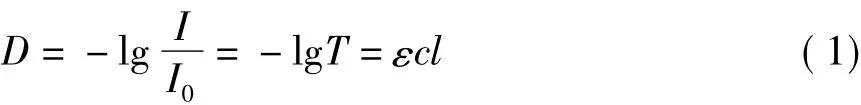
式中:I0、I分别为入射光和透射光的强度;T为透过率;ε为样品的摩尔消光系数,L/(mol·cm);c为样品溶液的浓度,mol/L;l为样品池光程长度,cm.
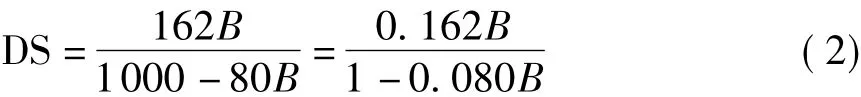
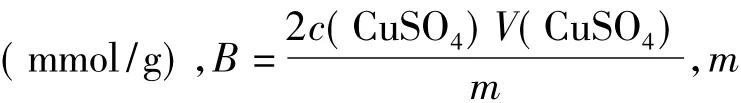
2.2.2 样品DS的测定结果
图3为CMC样品(样品1-6)与Cu(Ⅱ)离子作用形成的配合物的吸光值与硫酸铜体积的关系曲线.鉴于上述分析,每个样品只滴加硫酸铜溶液至CMC-Cu(Ⅱ)的D-V曲线进入Ⅱ区初期即可对数据进行拟合.
根据以上分析,使用origin8.0软件对图3中Ⅰ区的数据点进行自动线性拟合,拟合相关系数r2均在0.990以上,CMC-Cu(Ⅱ)配合物在242.0 nm处的紫外吸收规律很好地遵循了Lambert-Beer定律.将吸光值最大交点对应的硫酸铜体积代入式(2)计算得到的CMC取代度和灰碱法测得的取代度见表1.由表1可知,文中使用紫外光谱法测定的DS值均较灰碱法的大,相对偏差在1.7% ~3.5%之间,这正如前原理分析中所述的,是因为在Ⅰ区和Ⅱ区的交界处,CMC中的羧基和Cu(Ⅱ)离子反应的同时,少量羟基也和Cu(Ⅱ)离子作用,从而使得硫酸铜用量增大所致.
由实验结果可见,文中方法适用于工业生产中快速检测高取代度CMC(DS>0.80)的取代度.

图3 不同CMC-Cu(Ⅱ)样品吸光值与硫酸铜体积的关系Fig.3 Relationship between UV absorbance of CMC-Cu(Ⅱ)and CuSO4volume

表1 CMC取代度的测定值Table 1 Degrees of substitution of CMC
2.3 对紫外光谱法的进一步说明
聚阴离子CMC分子链上的羟基和羧基均可与Cu(Ⅱ)离子发生作用,Franco 和 Hosny 等[6,9]的研究表明:CMC上的羧基与Cu(Ⅱ)离子是按照2∶1的物质的量比形成平面四方形的二齿配位化合物;并且当取代度较高(0.67和1.31)时,以羧基与Cu(Ⅱ)离子的作用为主,当取代度较低(0.46)时,则羟基、羧基与 Cu(Ⅱ)离子的作用相当[6,9].本实验中发现,在滴加2 mmol/L的硫酸铜溶液的过程中,当加入体积为1~15mL时溶液均澄清无沉淀,当加入体积为16mL时溶液出现少量浅蓝色沉淀,随着硫酸铜溶液的继续滴加,沉淀量增多.这也证实了CMC与Cu(Ⅱ)离子的相互作用形式不是单一的,当CMC分子链上的羟基吸附Cu(Ⅱ)离子达到一定量时,便开始有沉淀产生.因此,在CMC-Cu(Ⅱ)的D-V曲线中Ⅰ区和Ⅱ区的界限有可能不明显,在实际拟合时,会出现如图3(b)和 3(c)的情况,即CMC-Cu(Ⅱ)的D-V曲线在与Ⅰ区和Ⅱ区的界限处并没有明显的变缓趋势,使其与拟合直线在此区域内很贴近,以致难以确定其“最大交点”,从而给测试结果带来误差.但这个误差可以通过实验操作来降低,即在加入2 mmol/L硫酸铜溶液时,在3.5~5.5mL区间内应尽量多取点,使得CMC-Cu(Ⅱ)的D-V曲线由Ⅰ区较明显地向Ⅱ区过渡,从而与拟合曲线有明显的交点.
该方法样品用量少,实验中CMC的用量仅在40mg左右,最终的质量浓度低于0.1 g/L,这符合Lambert-Beer定律适用于稀溶液的要求,引起的误差也较小,但同时也产生了另一个问题,即不能确定在实际生产中所取样品是否具有代表性.为此,在实际生产中按照标准分析“缩分法”取样,一次取50 g样,再按“两次八分法”取样进行测试.
3 结论
CMC与硫酸铜稀溶液中的Cu(Ⅱ)离子作用形CMC-Cu(Ⅱ)配合物,该配合物在紫外光谱区的242.0nm处的吸收规律符合Lambert-Beer定律,文中据此得出了D-V的变化关系,由A-V曲线与拟合直线的吸光值最大处交点获得CMC中羧基完全与Cu(Ⅱ)离子作用所对应消耗的硫酸铜体积,然后根据取代度的定义,计算得到CMC的取代度.使用文中方法测定的高取代CMC的取代度结果与使用国家标准方法测得的结果相近.该方法与现有方法相比具有用量少,测试样品不需经预处理,操作简便、快速的优点,适用于工业中高取代度CMC取代度的快速检测.
[1] 楼益明.羧甲基纤维素的生产与应用[M].上海:科学技术出版社,1991:1-29.
[2] Edgar K J,Buchanan C M,Debenham J S,et al.Advances in cellulose ester performance and application[J].Prog Polym Sci,2001,26(9):1605-1688.
[3] Capitani D,Porr O F,Segre A L.High field NMR analysis of the degree of substitution in carboxymethyl cellulose sodium salt[J].Carbohydrate Polymers,2000,42(3):283-286.
[4] Oudhoff K A,Buijtenhuijs F A(Ab),Wijnen P H,et al.Determination of the degree of substitution and its distribution of carboxymethylcellulose by capillary zone electrophoresis[J].Carbohydrate Research,2004,339(11):1917-1924.
[5] Richardson S,Gorton L.Characterization of the substituent distribution in starch and cellulose derivatives[J].Analytica Chimica Acta,2003,497(1/2):27-65.
[6] Franco A P,Ramaiho-Mercê A L.Complexes of carboxymethyl cellulose in water(1):Cu2+,VO2+and Mo6+[J].Reactive & Functional Polymers,2006,66(6):667-681.
[7] GB 1904—2005,食品添加剂 羧甲基纤维素钠[S].
[8] Rivas B L,Pereira E D,Moreno-Villoslada I.Water-soluble polymer-metal ion interaction[J].Progress in Polymer Science,2003,28(2):173-208.
[9] Hosny W M,Abdel-Hadi A K.Metal chelates with some cellulose derivative(PartⅢ):synthesis and structural chelating of nickel(Ⅱ)and copper(Ⅱ)complexes with carboxymehtyl cellulose[J].Polymer International,1995,37(2):93-96.
[10] Nadagouda M N,Varma R S.Synthesis of thermally stable carboxymethyl cellulose/metal biodegradable nanocomposites for potential biological[J].Biomacromolecules,2007,8(9):2762-2767.
——以硫酸铜饱和溶液析出晶体的计算为例

