四环素诱导的丙型肝炎病毒非结构蛋白5B稳定细胞株的构建和检测
王耀辉,丁焕平,王燏婵,袁正宏,,
1. 复旦大学上海医学院教育部/卫生部医学分子病毒学重点实验室,上海 200032; 2. 复旦大学生物医学研究院,上海 200032; 3.上海市(复旦大学附属)公共卫生临床中心,上海 201508
目前,全球约有1.7亿人感染丙型肝炎病毒(hepatitis C virus,HCV),约占总人口的3%[1],且发病率越来越高,尤其是在发展中国家[2]。HCV感染个体后在宿主体内长时间保持低水平复制,与慢性肝炎、肝硬化及肝细胞肝癌的发生密切相关。目前尚没有针对HCV的有效疫苗,治疗方案主要是Ⅰ型干扰素与利巴韦林联合应用,但只有一半左右患者对此有反应,且多伴有并发症[3-5]。因此,对HCV复制、致病机制及抗病毒治疗策略的研究尤为重要。
非结构蛋白5B(nonstructural protein 5B,NS5B)是RNA依赖的RNA聚合酶[6], 在HCV复制中发挥关键作用,长期以来一直被看作潜在的抗病毒靶点[7,8]。近年来,也有不少报道提示NS5B除作为聚合酶参与复制外,还通过与宿主蛋白直接相互作用参与调控病毒的生活周期和致病过程, 但详细机制尚有待进一步阐明[9-13]。为进一步了解NS5B的功能及其对细胞的影响,我们利用可诱导的人肝母细胞瘤(HepG2)稳定细胞株(Tet-On系统),构建了可由四环素诱导的NS5B稳定HepG2细胞株(HepG2 Tet-On NS5B)。
1 材料和方法
1.1 材料和试剂
实验用材料和试剂包括HepG2 Tet-on细胞(Clontech公司);MEM、胎牛血清(Gibco公司),不含四环素的胎牛血清(Clontech公司),青霉素(1×105u/L)、链霉素(0.1 g/L)、多西环素(强力霉素)和 G418 (Sigma公司),潮霉素B(Roche公司);细胞培养瓶和培养板(Corning公司);限制性内切酶(NEB公司、MBI公司);转染试剂FuGENE HD(Roche公司);抗Flag 抗体和抗actin抗体(鼠源,Sigma公司),抗NS5B 抗体(兔源,VIROGEN公司);硝酸纤维素膜(0.22 μm, Schleicher & Schuell BioScience公司);宿主菌TOP10F’(Invitrogen公司);质粒抽提试剂盒(Qiagen公司、Macherey Nagel公司)。pcDNA3.1/3×Flag NS5B由本室构建。
1.2 方法
1.2.1细胞培养和转染HepG2 Tet-On细胞培养于MEM培养基(含15%胎牛血清、1×105u/L青霉素、0.1 g/L链霉素、100 μg/ml G418、1×非必需氨基酸)中,置37 ℃、5% CO2培养箱内培养,2~3 d传代1次。
将细胞铺于35 mm培养板,约80%融合时更换新鲜培液,2 h后用脂质体(FuGENE HD)进行转染:将2 μl FuGENE HD加入100 μl不含血清和抗生素的纯MEM培养基中,混匀;然后加入1 μg质粒,混匀后室温孵育20 min,将孵育好的混合物均匀加入细胞培养板中继续培养。
1.2.2NS5B质粒的构建用带四环素反应元件的 pTRE2hyg 作为载体,载体图谱如图1A所示。首先以pcDNA 3.1/3×Flag NS5B质粒为模板,将带有3×Flag标签的全长NS5B经聚合酶链反应(polymerase chain reaction,PCR)扩增后插入pTRE2hyg 载体中(酶切位点:BamH I、NotI)。引物序列为:sense (5′-3′)- TTGGATCCATGG- CATCAATGCAGAAG;antisense (5′-3′)- AAGC- GGCCGCTCATCGGTTGGGGAGCAG。
1.2.3稳定细胞株的筛选将转染了质粒24 h后的细胞用胰酶消化,并重新铺于10 cm培养皿,待细胞贴壁后更换新鲜培养液,加入潮霉素B至终浓度为200 μg/ml,持续培养。若细胞出现死亡,即更换含潮霉素B的新鲜培养液。2周后克隆出现,挑取单克隆于48孔板培养,待细胞长满后依次向24孔板、12孔板、6孔板和25 cm2培养瓶转移。分出部分细胞进行诱导、鉴定。
1.2.4免疫荧光检测将预处理的玻片放入24孔板,加入混匀的细胞悬液(0.5 ml)。待细胞贴壁生长适当时加入四环素诱导,在特定时间收集细胞。收集细胞时,用磷酸缓冲液(phosphate buffered saline,PBS)洗1次;加入3.5%聚合甲醛置室温固定15 min,然后吸去固定液;加30 mmol/L甘氨酸终止反应5 min,PBS 洗3次,每次5min;加入0.1% Triton X-100置室温穿透5 min,PBS洗1次;加入3% 牛血清白蛋白(bovine serum albumin,BSA)封闭1 h以上,然后加BSA稀释的一抗(抗Flag抗体),4 ℃孵育过夜,PBS洗3次;加入BSA稀释的二抗(CY3耦联的抗鼠IgG),室温孵育1 h以上,PBS洗 3次;用 4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染核2 min,最后Mowiol封片,置激光共聚焦显微镜(TCS-NT,Leica)下观察。
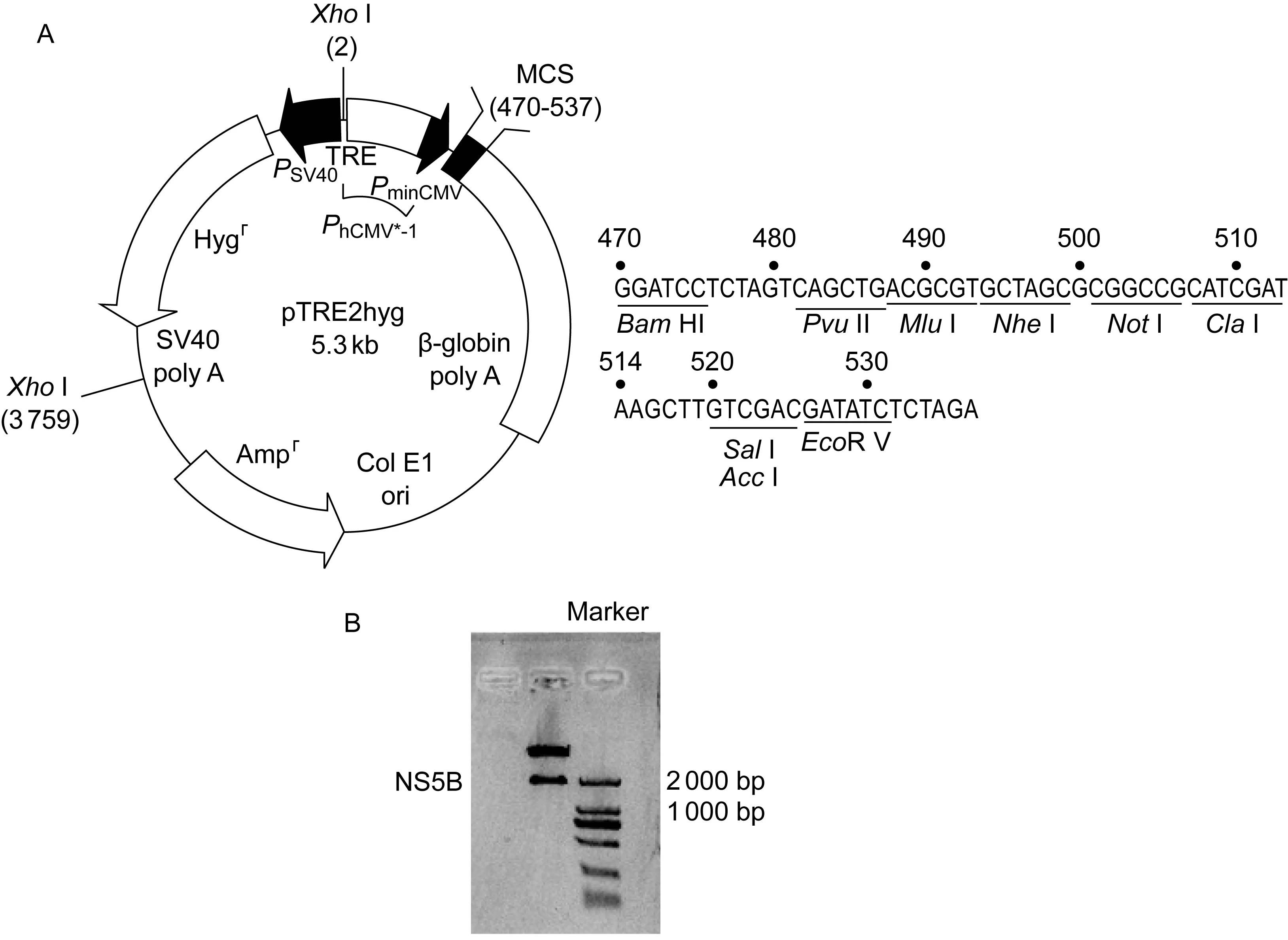
A: The vector used in this study and its MCS sequence. B: Identification of NS5B fragments after digestion.
图1构建克隆所用载体及构建后酶切鉴定
Fig.1ThevectorusedinthisstudyandtheidentificationofNS5Bfragmentsafterplasmidconstruction
1.2.5蛋白免疫印迹法标本经10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)后,电转印至硝酸纤维素膜,5%脱脂牛奶﹝用含0.05% Tween-20的PBS(PBST)配制﹞封闭1 h以上,分别加抗Flag、抗NS5B、抗actin抗体,置湿盒内4 ℃过夜;然后以PBST洗膜3次,每次10 min;加入相应辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗,室温孵育1 h以上,以PBST洗膜3次,每次10 min;行增强型化学发光(enhanced chemiluminescence,ECL)检测(PerkinElmer公司)。
2 结果
2.1 质粒的鉴定
本研究选用带四环素反应元件的 pTRE2hyg 作为载体,将构建好的pTRE2hyg 3×Flag NS5B经酶切(BamH I、NotI)后进行琼脂糖电泳鉴定,在1.8 kb附近可见清晰的条带(图1B)。质粒扩增后经测序显示正确(博尚公司)。
2.2 标签抗体检测稳定细胞中NS5B的表达
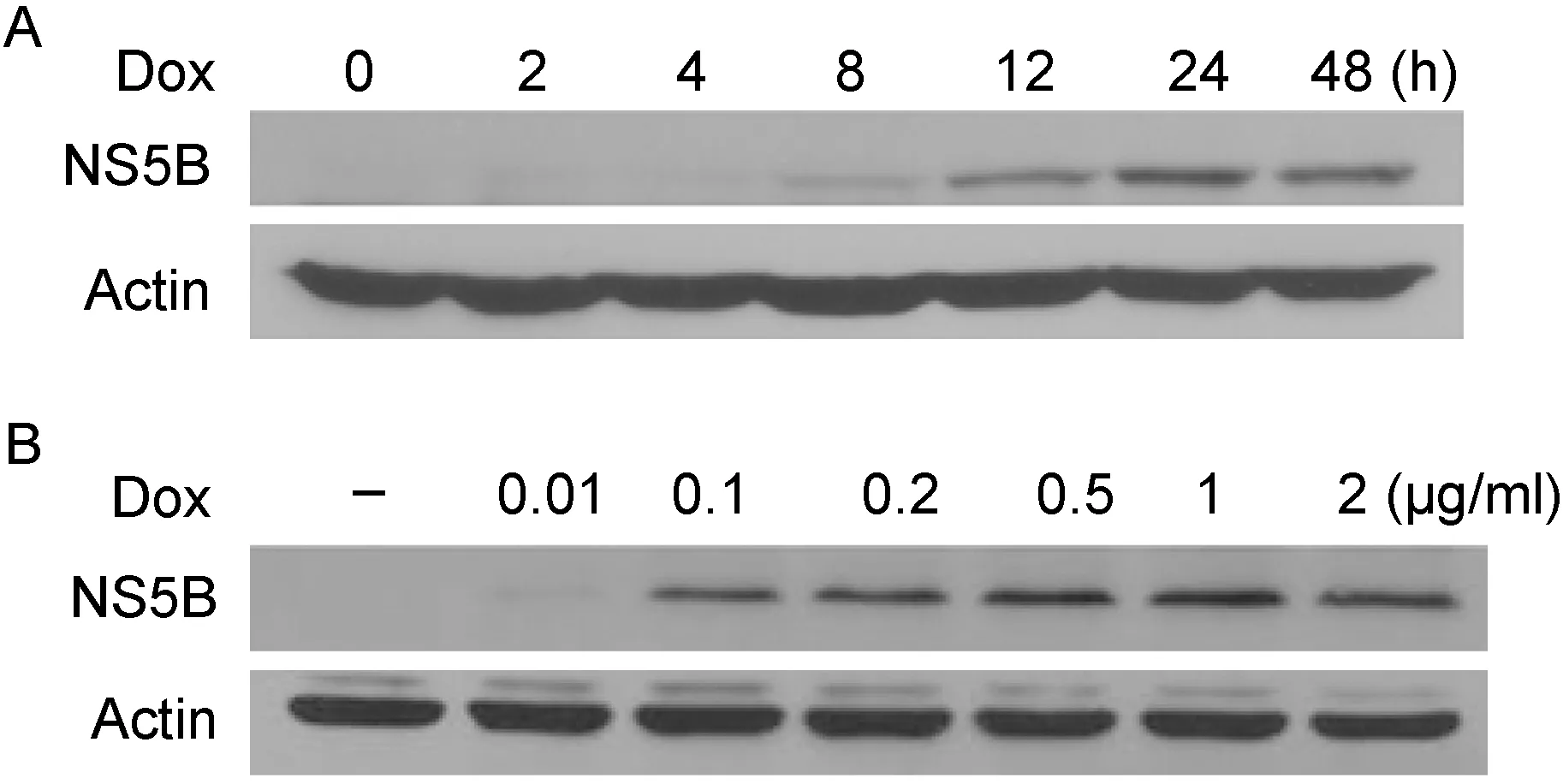
用FuGENE HD将构建好的pTRE2hyg 3×Flag NS5B质粒转入HepG2 Tet-On 细胞,经潮霉素B筛选后建立稳定细胞株,并通过蛋白免疫印迹法检测细胞株中NS5B的表达情况。细胞经不同浓度的多西环素诱导48 h 后,用标签抗体(抗Flag抗体)检测。结果发现多西环素浓度为0.01 μg/ml时,可检测出NS5B蛋白表达;当多西环素浓度达到1 μg/ml时,蛋白表达量最高。而未诱导组没有蛋白表达(图2A)。另外,经1 μg/ml多西环素诱导,在不同时间点收集细胞后用蛋白免疫印迹法检测,发现2 h即可检测出蛋白表达。随着时间推移,蛋白的表达量增高,24 h达峰值(图2B)。
2.3 抗NS5B抗体检测稳定细胞株中NS5B的表达
为进一步确认蛋白表达的特异性,用抗NS5B抗体做进一步检测,方法同上。蛋白免疫印迹结果见图3。与对照组相比,经不同浓度多西环素或不同时间诱导后,抗NS5B 抗体可清晰检测到内源性NS5B蛋白的表达。
2.4 免疫荧光法检测NS5B的表达及胞内定位
稳定细胞株经多西环素诱导48 h后,用免疫荧光法检测NS5B的表达及其在胞内的定位。结果显示,多西环素诱导后可观察到NS5B的表达(图4A,红色),主要分布于胞质且靠近核周,与以前报道一致[14];而未诱导组没有荧光信号(图4A)。同时用蛋白免疫印迹法验证NS5B 的表达(图4B)。

A: HepG2 Tet-On stable cells expressing NS5B induced by doxycycline (Dox) at different concentrations, and then detected by Western blot with anti-Flag antibody. B: HepG2 Tet-On stable cells expressing NS5B induced by 1 μg/ml Dox and harvested at indicated time points, and then detected by Western blot with anti-Flag antibody.
图2抗Flag抗体检测NS5B的表达
Fig.2TheexpressionofNS5Bdetectedbyanti-Flagantibody
A: HepG2 Tet-On stable cells expressing NS5B induced by 1 μg/ml Dox and harvested at indicated time points, and then detected by Western blot with endogenous anti-NS5B antibody. B: HepG2 Tet-On stable cells expressing NS5B induced by Dox at different concentrations, and then detected by Western blot with endogenous anti-NS5B antibody.
图3内源性抗体检测NS5B的表达
Fig.3TheexpressionofNS5Bdetectedbyendogenousanti-NS5Bantibody

A: The expression of NS5B and its subcellular localization detected by immunofluorescence assay (63×). B: The expression of NS5B in A detected by Western blot.
图4免疫荧光法检测NS5B的表达及其细胞内定位
Fig.4TheexpressionofNS5Banditssubcellularlocalizationdetectedbyimmunofluorescenceassay
3 讨论
自1989年HCV被鉴定以来[15],一直受到人们的极大关注。HCV基因组可编码结构蛋白(Core、E1、E2) 和非结构蛋白(P7、NS2、NS3、NS4A、NS4B、NS5A、NS5B)[16,17]。其中NS5B是RNA依赖的RNA聚合酶,参与病毒RNA的从头合成。NS5B还通过与诸多宿主蛋白的直接相互作用发挥其在复制和致病过程中的功能,如与人囊泡相关膜蛋白相关蛋白A(human vesicle-associated membrane protein-associated protein A, hVAP-A)的结合参与复制复合体的形成[10];与α辅肌动蛋白(α-actinin)相互作用可维持复制复合体的数目,并调节复制效率[11];而与核仁蛋白(nucleolin)的相互作用,可调控病毒从复制到翻译的转换[12]。 这些相互作用与聚合酶活性和病毒复制密切相关。另有报道称NS5B可与抑癌基因Rb相互作用,并使其经泛素蛋白酶体途径降解或通过诱生干扰素影响细胞周期[13,18];也可与毛细血管扩张性共济失调症突变蛋白(ataxia-telangiectasia mutated,ATM)相互作用,参与DNA损伤和基因组稳定性的调控[19],具体机制尚不完全清楚。因此,NS5B细胞株的建立,有助于深入了解NS5B与宿主蛋白的相互作用及参与病毒复制和致病的各个过程。
为探讨目的蛋白在细胞中的作用,人们采用各种方法将外源基因导入细胞内,观察其对细胞的影响。目前常用的有瞬时转染法,主要包括磷酸钙法、脂质体法及电转染法;但这些方法尚存在稳定性差、操作步骤较繁琐、阳性率低、细胞毒性高、费用较高等缺点。另外,稳定转染也正越来越多被采用。在普通稳定细胞株的构建中,对照细胞株常为不包括目的基因的空载体,即插入基因组的DNA长度不一致,可能会影响结果且需要另外筛选。本研究在HepG2细胞中建立了可由四环素调控(Tet-On)的NS5B稳定细胞株。Tet-On (rtTA依赖)系统是目前常用的可控性诱导表达系统[20],在四环素或四环素衍生物存在的情况下,转录因子rtTA与反应元件结合,从而使目的基因转录和翻译。该细胞株经1次转染,筛选成功后即可用低浓度的抗生素维持,可长期培养,费用低、稳定性好。需要目的蛋白表达时,只需在培养液中加入四环素进行诱导,理论上阳性率为100%。在不加四环素诱导时,可直接作为阴性对照。另外,该系统通过四环素的存在与否决定目的蛋白的表达,能尽量减少维持培养时外源蛋白对细胞本身的影响,且可通过加入四环素的浓度和时间对蛋白表达进行时间和量的控制。操作简单、灵活,能适应不同条件的研究需要。鉴于Tet-On系统的诸多优点,其已被广泛用于生命科学研究的各个领域,包括病毒学研究。Zhang等利用 Tet-On系统在HeLa细胞中研究柯萨奇病毒感染与蛋白未折叠反应和凋亡的关系[21];Tang等也在HepG2细胞中建立了Tet-On HBx 稳定细胞株来研究HBx的功能[22];另外,该系统也用于人类免疫缺陷病毒(human immunodeficiency virus,HIV)的很多研究中。
本研究构建的HepG2 Tet-On NS5B稳定细胞株在诱导后可被标签抗体和抗NS5B抗体检测到,免疫荧光法进一步证实了NS5B存在于细胞质内,加入诱导剂后可便捷地对目的蛋白的表达进行时间和量的控制。该稳定株在未诱导情况下经CCK-8试剂盒检测,细胞生长没有明显改变。另外,持续培养40代后的稳定株经多西环素诱导仍能用质谱鉴定出NS5B表达,说明其稳定性和特异性良好。应用该细胞株可检测在不同诱导浓度或不同时间点NS5B表达对细胞内特定蛋白或信号通路的影响及细胞表型的变化;可通过免疫沉淀法沉淀与NS5B相互作用的蛋白,进一步质谱鉴定,从而发现一些新的蛋白;亦可用来验证一些体外实验结果,以便从细胞水平深入了解NS5B的功能,进一步阐明感染宿主后HCV的复制和致病机制。
[1] Hoofnagle J H. Course and outcome of hepatitis C [J]. Hepatology, 2002, 36(5 Suppl 1): S21-S29.
[2] Yang JD, Roberts LR. Hepatocellular carcinoma: A global view [J]. Nat Rev Gastroenterol Hepatol, 2010, 7(8): 448-458.
[3] Shimakami T, Lanford RE, Lemon SM. Hepatitis C: recent successes and continuing challenges in the development of improved treatment modalities [J]. Curr Opin Pharmacol, 2009, 9(5): 537-544.
[4] Ascione A, de Luca M, Tartaglione MT, Lampasi F, di Costanzo GG, Lanza AG, Picciotto FP, Marino-Marsilia G, Fontanella L, Leandro G. Peginterferon alfa-2a plus ribavirin is more effective than peginterferon alfa-2b plus ribavirin for treating chronic hepatitis C virus infection [J]. Gastroenterology, 2010, 138(1): 116-122.
[5] Feld JJ, Hoofnagle JH. Mechanism of action of interferon and ribavirin in treatment of hepatitis C [J]. Nature, 2005, 436(7053): 967-972.
[6] Lohmann V, Korner F, Herian U, Bartenschlager R. Biochemical properties of hepatitis C virus NS5B RNA-dependent RNA polymerase and identification of amino acid sequence motifs essential for enzymatic activity [J]. J Virol, 1997, 71(11): 8416-8428.
[7] Jonckers TH, Lin TI, Buyck C, Lachau-Durand S, Vandyck K, van Hoof S, Vandekerckhove LA, Hu L, Berke JM, Vijgen L, Dillen LL, Cummings MD, de Kock H, Nilsson M, Sund C, Rydegard C, Samuelsson B, Rosenquist A, Fanning G, van Emelen K, Simmen K, Raboisson P. 2′-Deoxy-2′-spirocyclopropylcytidine revisited: a new and selective inhibitor of the hepatitis C virus NS5B polymerase [J]. J Med Chem, 2010, 53(22): 8150-8160.
[8] Vermehren J, Sarrazin C. New HCV therapies on the horizon [J]. Clin Microbiol Infect, 2011, 17(2):122-134. doi: 10.1111/j.1469-0691.2010.03430.x.
[9] Walters KA, Syder AJ, Lederer SL, Diamond DL, Paeper B, Rice CM, Katze MG. Genomic analysis reveals a potential role for cell cycle perturbation in HCV-mediated apoptosis of cultured hepatocytes [J]. PLoS Pathog, 2009, 5(1): e1000269.
[10] Gao L, Aizaki H, He JW, Lai MM. Interactions between viral nonstructural proteins and host protein hVAP-33 mediate the formation of hepatitis C virus RNA replication complex on lipid raft [J]. J Virol, 2004, 78(7): 3480-3488.
[11] Lan S, Wang H, Jiang H, Mao H, Liu X, Zhang X, Hu Y, Xiang L, Yuan Z. Direct interaction between alpha-actinin and hepatitis C virus NS5B [J]. FEBS Lett, 2003, 554(3): 289-294.
[12] Shimakami T, Honda M, Kusakawa T, Murata T, Shimotohno K, Kaneko S, Murakami S. Effect of hepatitis C virus (HCV) NS5B-nucleolin interaction on HCV replication with HCV subgenomic replicon [J]. J Virol, 2006, 80(7): 3332-3340.
[13] Munakata T, Nakamura M, Liang Y, Li K, Lemon SM. Down-regulation of the retinoblastoma tumor suppressor by the hepatitis C virus NS5B RNA-dependent RNA polymerase [J]. Proc Natl Acad Sci USA, 2005, 102(50): 18159-18164.
[14] Kim JE, Song WK, Chung KM, Back SH, Jang SK. Subcellular localization of hepatitis C viral proteins in mammalian cells [J]. Arch Virol, 1999, 144(2): 329-343.
[15] Alter HJ, Purcell RH, Shih JW, Melpolder JC, Houghton M, Choo QL, Kuo G. Detection of antibody to hepatitis C virus in prospectively followed transfusion recipients with acute and chronic non-A, non-B hepatitis [J]. N Engl J Med, 1989, 321(22): 1494-1500.
[16] Choo QL, Richman KH, Han JH, Berger K, Lee C, Dong C, Gallegos C, Coit D, Medina-Selby R, Barr PJ, Weiner AJ, Bradley DW, Kuo G, Houghton M. Genetic organization and diversity of the hepatitis C virus [J]. Proc Natl Acad Sci USA, 1991, 88(6): 2451-2455.
[17] Reed KE, Rice CM. Overview of hepatitis C virus genome structure, polyprotein processing, and protein properties [J]. Curr Top Microbiol Immunol, 2000, 242: 55-84.
[18] Munakata T, Liang Y, Kim S, McGivern DR, Huibregtse J, Nomoto A, Lemon SM. Hepatitis C virus induces E6AP-dependent degradation of the retinoblastoma protein [J]. PLoS Pathog, 2007, 3(9): 1335-1347.
[19] Ariumi Y, Kuroki M, Dansako H, Abe K, Ikeda M, Wakita T, Kato N. The DNA damage sensors ataxia-telangiectasia mutated kinase and checkpoint kinase 2 are required for hepatitis C virus RNA replication [J]. J Virol, 2008, 82(19): 9639-9646.
[20] Gossen M, Freundlieb S, Bender G, Muller G, Hillen W, Bujard H. Transcriptional activation by tetracyclines in mammalian cells [J]. Science, 1995, 268(5218): 1766-1769.
[21] Zhang HM, Ye X, Su Y, Yuan J, Liu Z, Stein DA, Yang D. Coxsackievirus B3 infection activates the unfolded protein response and induces apoptosis through downregulation of p58IPK and activation of CHOP and SREBP1 [J]. J Virol, 2010, 84(17): 8446-8459.
[22] Tang H, Liu L, Liu FJ, Chen EQ, Murakami S, Lin Y, He F, Zhou TY, Huang FJ. Establishment of cell lines using a doxycycline-inducible gene expression system to regulate expression of hepatitis B virus X protein [J]. Arch Virol, 2009, 154(7): 1021-1026.

