人类免疫缺陷病毒1型同性恋感染者与健康人群Th17/Treg平衡状况的比较研究
李丹,贾曼雪,梁华,彭虹,刘东华,赵阳,邵一鸣
中国疾病预防控制中心性病艾滋病预防控制中心,传染病预防控制国家重点实验室,北京 102206
人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染的免疫机制复杂,CD4+T细胞逐渐减少、过度免疫活化及病毒持续存在是其三大重要特征。CD4+T细胞作为HIV感染的主要靶细胞,在HIV感染的发病机制、疾病进展及治疗中起关键作用。
根据细胞分化和功能特征不同,CD4+T细胞最初分为2个功能亚群:辅助性T细胞1(T helper cell type 1,Th1)和辅助性T细胞2(T helper cell type 2,Th2),分别执行不同的生物学功能。Th1/Th2失衡在HIV感染及发病机制中发挥重要作用,但最近研究发现,Th1/Th2失衡理论并不能完全解释HIV感染的发病机制[1]。辅助性T细胞17(T helper cell type 17,Th17)和CD4+CD25hiFoxp3+调节性T细胞(regulatory T cell,Treg)作为最近发现的2种新的CD4+T细胞亚群,亦是HIV感染的潜在靶标。Th17以分泌白细胞介素17(interleukin 17,IL-17)而命名,与炎症反应和自身免疫性疾病密切相关[2]。CD4+CD25hiFoxp3+Treg是调节性T细胞家族中最重要的一群,在调节机体免疫反应、维持免疫平衡方面起重要作用[3,4]。两者均来自共同的细胞分化前体,分化、发育调节机制不同于Th1、Th2,且与自身免疫性疾病和感染性疾病的发生、发展关系密切,故其在HIV感染发生、发展中的作用备受瞩目。随着对这2群细胞关系的深入研究,Th17/Treg平衡受到越来越多的认可和关注[5,6]。本研究通过对HIV-1同性恋感染者外周血Th17与Treg比例的检测,探讨Th17/Treg平衡是否发生变化及其与疾病进展的关系。
1 材料和方法
1.1 研究对象
根据知情、同意原则,在北京市招募未经抗病毒治疗的HIV感染者54例,平均年龄30.6岁(20~57岁)。均为男男性行为者,经性传播途径感染。采集研究对象静脉血45 ml,EDTA抗凝。所有样本均用Vironostika HIV Uni-Form II plus O诊断试剂盒(Biomerix公司)进行HIV抗体初筛,并用HIV Blot2.2确证试剂盒(GeneLab公司)进行HIV感染的确认。健康对照HIV-1抗体检测均为阴性。HIV感染者及健康对照者的一般情况如表1所示。
表1HIV感染者及健康对照者一般情况
Tab.1CharacteristicsofHIV-infectedpatientsandhealthycontrolsofthestudy

CharacteristicsHIV-infected patientsHealthy controlsCase5432Gender (male/female)54/020/12Age (years)31±732±8Years of infection1.7±1.1-Route of transmissionSexual-CD4+T cell counts (cells/μl)376.2±156.3722.8±190.6CD8+T cell counts (cells/μl)1006.8±368.9539.7±184.8CD4+∶CD8+T cell ratio0.4±0.31.4±0.4Viral load (log10HIV RNA, copies/ml)3.8±0.8-
Values are expressed as mean±SD or number.
1.2 主要试剂
APC-anti-CD3、ECD-anti-CD3、PE-anti-CD4、PerCP-anti-CD8、APC Cy7-anti-CD8、APC-anti-CD25、CD3/CD4/CD45/CD8四色单克隆抗体、红细胞裂解液购自BD公司。FITC-anti-Foxp3单克隆抗体及同型对照、FITC-anti-IL-17A单克隆抗体及同型对照、固定破膜工作液(Foxp3 Staining Buffer Set)均购自eBioscience公司。PB-anti-live/dead购自Invitrogen公司。固定破膜工作液(Fix/Perm A/B液)购自Caltag公司。佛波酯(phorbol-12-myristate-13-acetate,PMA)、离子霉素(ionomycin)、蓝菌素A(brefeldin A)购自Sigma公司。磷酸缓冲液(phosphate buffered saline,PBS)、RPMI 1640培养基及胎牛血清购自Hyclone公司。淋巴细胞分离液购自Pharmacia公司。病毒载量检测试剂盒由Roche公司提供。
1.3 外周血单核细胞的分离
应用Ficoll密度梯度离心法分离获得外周血单核细胞(peripheral blood mononuclear cell,PBMC),加入完全RPMI 1640培养液(含有10 g/L谷氨酰胺及100 ml/L胎牛血清)悬浮后,显微镜计数、备用。
1.4 Th17染色
取1×106个PBMC培养于1 ml完全RPMI 1640培养液中,加入PMA(50 ng/ml)/离子霉素(200 ng/ml)/蓝菌素A (5 μg/ml),阴性管加入等量蓝菌素A,6 h后收集细胞,洗2遍;加入表面抗体后,4 ℃避光孵育30 min,洗2遍;离心弃上清液,加入100 μl固定液(A液),室温放置15 min,洗1遍;加入100 μl破膜液(B液)及FITC-anti-IL-17A单克隆抗体,4 ℃避光孵育30 min,洗1遍;300 μl 2%甲醛重悬后用FACSAria进行检测。数据用FlowJo软件分析。
1.5 Treg染色
取1×106个PBMC,洗2遍;加入表面抗体,4 ℃避光孵育30 min,洗2遍;离心弃上清液,用1 ml新鲜配制的固定破膜工作液(Foxp3 Fix/Perm)4 ℃避光孵育30 min;离心弃上清液,加入2 ml固定破膜洗液 (Foxp3 Perm buffer)洗1遍;加入FITC-anti-Foxp3单克隆抗体,4 ℃避光孵育30 min,固定破膜洗液洗2遍;300 μl 2%甲醛重悬。以相同方法进行检测和分析。
1.6 CD4+ T细胞计数的检测
取50 μl抗凝全血,加入20 μl anti-FITC-CD3、anti-PE-CD4、anti-PerCP-CD45、anti-APC-CD8四色抗体至TruCount管中,室温避光20 min。加入红细胞裂解液450 μl,立即震荡混匀,室温避光10 min,用流式细胞仪检测。采用MultiSet软件进行分析。
1.7 病毒载量的检测
用Roche公司的COBAS AMPLICOR HIV-1定量检测试剂盒(TaqMan法)在COBAS AMPLICOR全自动聚合酶链反应(polymerase chain reaction,PCR)检测仪上定量测定患者血浆中HIV-1 RNA含量,检测低限为40 copies /ml。
1.8 统计学分析
使用SigmaPlot 10.0和SigmaStat 3.5进行统计学分析,计量资料以mean±SD表示,用独立样本配对t检验或Mann-Whitney检验比较组间差异,相关性分析采用Spearman 秩相关检验,P<0.05为差异具有统计学意义。
2 结果
2.1 HIV感染者外周血中Th17、Treg和Th17/Treg水平
Th17及Treg的流式细胞检测如图1所示。HIV感染者Th17/CD4比例较正常对照显著下降,差异有统计学意义(0.68±0.35vs1.42±0.86,P<0.001)(图2A)。HIV感染者Treg/CD4比例较对照组显著升高,差异有统计学意义(6.15±2.12vs4.50±0.76,P<0.001)(图2B)。HIV感染者中Th17/Treg比例较正常对照显著降低(0.12±0.07vs0.31±0.17,P<0.001)(图2C)。
2.2 不同CD4+ T细胞数水平下HIV感染者外周血中Th17、Treg和Th17/Treg水平
将54例患者根据其CD4+T细胞计数分成3组,其中26例<350/μl,15例350~450/μl,13例>450/μl。<350/μl组的Th17/CD4和Th17/Treg比例最低,Treg/CD4比例最高,与350~450/μl组比较,有统计学差异(P<0.05)。此外,比较<350/μl组与>450/μl组中Treg/CD4和Th17/Treg比例,有统计学差异(P<0.05)(图3)。
2.3 HIV感染者Th17、 Treg和Th17/Treg水平与病毒载量和外周血CD4+ T细胞数的相关性
Th17/CD4比例与CD4+T细胞计数正相关(r=0.371,P<0.05),与病毒载量不相关(r=-0.183,P=0.184)。Treg/CD4比例与CD4+T细胞计数负相关,与病毒载量正相关(r=-0.402,P<0.05;r=0.447,P<0.001)。此外,Th17/Treg比例与CD4+T细胞计数正相关,与病毒载量负相关(r=0.525,P<0.001;r=-0.318,P<0.05)(图4)。

A: Th17. CD3+CD4+T cell population produces IL-17 after PMA/ionomycin stimulation. Left panel: Anti-IL-17 isotype control; middle and right panels: IL-17 expression in HIV-negative and -positive subjects, respectively. B: Treg. Foxp3-expressing cells were selected from CD4+CD25higate, isotypes for CD25 and Foxp3. The representative flow cytometry images in HIV-negative and -positive subjects were also shown.
图1Th17和Treg的流式细胞分析图
Fig.1GatingofTh17andTreginrepresentativesubjects

Comparison of Th17 levels (A), Treg levels (B), and Th17/Treg (C) between HIV-infected patients (n=54) and healthy controls (n=32).**P<0.001.
图2HIV感染者与正常对照外周血中Th17、Treg和Th17/Treg水平比较
Fig.2ComparisonofTh17,TregandTh17/TreglevelsinperipheralbloodbetweenHIV-infectedpatientsandhealthydonors
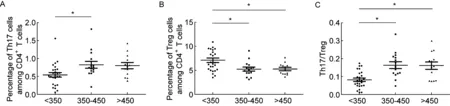
A: Th17 levels. B: Treg levels. C: Th17/Treg.*P<0.05.
图3不同CD4+figure_note17、Treg和Th17/Treg水平比较
Fig.3ComparisonofTh17,TregandTh17/TreglevelsinperipheralbloodamongpatientswithdifferentCD4+Tcellcounts

A-C: Correlation between CD4+T cell count and levels of Treg, Th17 and Th17/Treg. D-F: Correlation between viral load and levels of Treg, Th17 and Th17/Treg.
图4HIV感染者外周血中Th17、Treg和Th17/Treg水平与CD4+T细胞计数和血浆病毒载量的关系
Fig.4Relationshipamongplasmaviralload,CD4+Tcellcounts,andlevelsofTh17,TregandTh17/TreginperipheralbloodinpatientswithHIVinfection
3 讨论
研究表明,Th17和Treg来源于共同的初始T细胞,在不同的细胞因子环境下分化而成,具有不同的生物学功能。Th17作为促炎细胞可诱导自身免疫性和过敏性疾病的发生;Treg可介导免疫耐受,发挥免疫抑制作用。Th17与Treg的平衡在维持免疫内环境的稳定中起着非常重要的作用。
Th17是一个新近发现、不同于Th1和Th2的辅助性T细胞亚群,因高分泌IL-17而被命名。除分泌IL-17A外,还可分泌IL-17F、IL-21、IL-22、IL-6、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)等细胞因子,在部分自身免疫性疾病及感染性疾病的发病中起至关重要的作用[7,8]。Th17的反应很可能早于Th1或Th2型免疫反应,出现在感染的早期阶段,诱发组织炎症,并通过细胞因子的诱导,桥接先天免疫和适应性免疫,在炎症后期吸引其他T细胞亚群向感染部位募集。本研究发现,HIV感染者外周血Th17/CD4比例与正常人相比显著降低,并随着CD4+T细胞的降低Th17/CD4比例进一步下降,表明Th17在机体防御中起重要作用。随着HIV感染的进展,Th17/CD4比例下降会导致疾病恶化。HIV感染后Th17减少的原因尚不清楚。已有证据表明,SIVmac251病毒在体内、外实验条件下均可直接感染Th17,可能是Th17减少的原因之一[9]。
Treg与Th17相反,在体内主要发挥免疫抑制作用:上调穿孔素和颗粒酶的表达,选择性杀伤呈递抗原的B细胞,抑制B细胞增殖[10];诱导抗原呈递细胞(antigen-presenting cell,APC)产生吲哚胺2,3-双加氧酶(indoleamine-2,3-dioxygenase,IDO),分解色氨酸,降低效应性T 细胞活性;下调APC中CD80和CD86表达,干扰其抗原呈递功能[11]。本研究显示,Treg/CD4比例在HIV感染者中显著升高,并与CD4+T细胞负相关,与病毒载量正相关,对疾病进展产生不利影响。可能原因为高水平Treg可抑制HIV特异性免疫应答,使HIV感染者CD4+T细胞数量下降,进一步促进疾病进展[12-14]。部分研究表明,HIV感染中Treg绝对数的变化可能与免疫激活和疾病进展相关[15],但大多数学者认为Treg作为一群绝对数量较小的CD4+T细胞亚群,可对比例较大的非Treg亚群进行抑制[16]。因此,相比CD4+T细胞绝对数量的下降,Th17和Treg在CD4+T细胞中所占比例变化可更大程度反映它们功能的强弱及对HIV感染进程的影响[5]。
Th17与Treg之间存在复杂的相关性,两者在分化上密切关联,功能上相互拮抗。正常情况下Th17和Treg的功能处于一种精细而复杂的平衡状态,有利于维持机体的免疫稳定状态。因此,较单独研究Th17和Treg而言,Th17/Treg平衡可能在HIV感染中扮演更为重要的角色。我们的研究表明,Th17/CD4与Treg/CD4相反的变化规律导致Th17/Treg比例显著降低,平衡被打破,提示疾病的进展可能与Th17/Treg比例失衡导致的免疫紊乱有关。目前已有学者指出,在致病性猴免疫缺陷病毒(simian immunodeficiency virus,SIV)感染动物模型和HIV感染者中,无论在外周血还是在肠道黏膜均存在明显的Th17/Treg比例失衡现象,疾病进展与Th17的选择性减少和Treg的相对水平上升有关[17,18]。Th17/Treg比例失衡可能是导致肠道黏膜屏障破坏、微生物转移和系统免疫激活的重要诱发因素。Favre等更进一步指出,Th17/Treg比例失衡可能与IDO1介导的色氨酸代谢紊乱有关[18],可促进Foxp3的表达和Treg的产生,并进一步阻碍Th17的产生和分化[19,20]。
Th17和Treg在HIV感染中所起的作用仍存在许多未解之谜。虽然对Th17/Treg比例失衡与HIV感染的免疫病理关系仍需进一步研究证实,但我们相信研究Th17/Treg比例在HIV感染中的进展及其平衡机制将加深对HIV免疫机制的认识,为今后HIV治疗策略和HIV疫苗的研究提供科学依据。
[1] Homey B. After TH1/TH2 now comes Treg/TH17: significance of T helper cells in immune response organization [J]. Hautarzt, 2006, 57(8):730-732.
[2] Bettelli E, Oukka M, Kuchroo VK. Th-17 cells in the circle of immunity and autoimmunity [J]. Nat Immunol, 2007, 8(4):345-350.
[3] Mills KH. Regulatory T cells: friend or foe in immunity to infection [J]? Nat Rev Immunol, 2004, 4(11):841-855.
[4] Fazekas de St Groth B, Landay AL. Regulatory T cells in HIV infection: pathogenic or protective participants in the immune response [J]. AIDS, 2008, 22(6):671-683.
[5] Kanwar B, Favre D, McCune JM. Th17 and regulatory T cells: implications for AIDS pathogenesis [J]. Curr Opin HIV AIDS, 2010, 5(2):151-157.
[6] Zhang JB,HG, Zhang XG, Tong RY, Du XG, Li ZR. Regulatory T cells/T-helper 17 functional imbalance in uraemic patients on maintenance haemodialysis: A pivotal link between microinflammation and adverse cardiovascular events [J]. Nephrology, 2010, 15 (1):33-41.
[7] Happel KI, Dubin PJ, Zheng M, Ghilardi N, Lockhart C, Quinton LJ, Odden AR, Shellito JE, Bagby GJ, Nelson S, Kolls JK. Divergent roles of IL-23 and IL-12 in host defense against Klebsiella pneumoniae [J]. J Exp Med, 2005, 202(6):761-769.
[8] Higgins SC, Jarnicki AG, Lavelle EC, Mills KH. TLR4 mediates vaccine-induced protective cellular immunity to Bordetella pertussis: role of IL-17-producing T cells [J]. J Immunol, 2006, 177(11):7980-7989.
[9] Cecchinato V, Trindade CJ, Laurence A, Heraud JM, Brenchley JM, Ferrari MG, Zaffiri L, Tryniszewska E, Tsai WP, Vaccari M, Parks RW, Venzon D, Douek DC, O’Shea JJ, Franchini G. Altered balance between Th17 and Th1 cells at mucosal sites predicts AIDS progression in simian immunodeficiency virus-infected macaques [J]. Mucosal Immunol, 2008, 1(4):279-288.
[10] Zhao DM, Thornton AM, DiPaolo RJ, Shevach EM. Activated CD4+CD25+T cells selectively kill B lymphocytes [J]. Blood, 2006, 107(10):3925-3932.
[11] Munn DH, Sharma MD, Mellor AL. Ligation of B7-1/B7-2 by human CD4+T cells triggers indoleamine 2,3-dioxygenase activity in dendritic cells [J]. J Immunol, 2004, 172(7):4100-4110.
[12] Aandahl EM, Michaelsson J, Moretto WJ, Hecht FM, Nixon DF. Human CD4+CD25+regulatory T cells control T-cell responses to human immunodeficiency virus and cytomegalovirus antigens [J]. J Virol, 2004, 78(5):2454-2459.
[13] Tsunemi S, Iwasaki T, Imado T, Higasa S, Kakishita E, Shirasaka T, Sano H. Relationship of CD4+CD25+regulatory T cells to immune status in HIV-infected patients [J]. AIDS, 2005, 19(9):879-886.
[14] Weiss L, Donkova-Petrini V, Caccavelli L, Balbo M, Carbonneil C, Levy Y. Human immunodeficiency virus-driven expansion of CD4+CD25+regulatory T cells, which suppress HIV-specific CD4 T-cell responses in HIV-infected patients [J]. Blood, 2004, 104(10):3249-3256.
[15] Eggena MP, Barugahare B, Jones N, Okello M, Mutalya S, Kityo C, Mugyenyi P, Cao H. Depletion of regulatory T cells in HIV infection is associated with immune activation [J]. J Immunol, 2005,174(7):4407-4414.
[16] Rallon NI, Lopez M, Soriano V, Garcia-Samaniego J, Romero M, Labarga P, Gasco PG, Lahoz JG, Benito JM. Level, phenotype and activation status of CD4+FoxP3+regulatory T cells in patients chronically infected with human immunodeficiency virus and/or hepatitis C virus [J]. Clin Exp Immunol, 2009,155(1):35-43.
[17] Favre D, Lederer S, Kanwar B, Ma ZM, Proll S, Kasakow Z, Mold J, Swainson L, Barbour JD, Baskin CR, Palermo R, Pandrea I, Miller CJ, Katze MG, McCune JM. Critical loss of the balance between Th17 and T regulatory cell populations in pathogenic SIV infection [J]. PLoS Pathog, 2009, 5:e1000295.
[18] Favre D, Mold J, Hunt PW, Kanwar B, Loke P, Seu L, Barbour JD, Lowe MM, Jayawardene A, Aweeka F, Huang Y, Douek DC, Brenchley JM, Martin JN, Hecht FM, Deeks SG, McCune JM. Tryptophan catabolism by indoleamine 2,3-dioxygenase 1 alters the balance of TH17 to regulatory T cells in HIV disease [J]. Sci Transl Med, 2010, 2(32):32ra36.
[19] Sundrud MS, Koralov SB, Feuerer M, Calado DP, Kozhaya AE, Rhule-Smith A, Lefebvre RE, Unutmaz D, Mazitschek R, Waldner H, Whitman M, Keller T, Rao A. Halofuginone inhibits TH17 cell differentiation by activating the amino acid starvation response [J]. Science, 2009, 324(5932):1334-1338.
[20] Sharma MD, Hou DY, Liu Y, Koni PA, Metz R, Chandler P, Mellor AL, He Y, Munn DH. Indoleamine 2,3-dioxygenase controls conversion of Foxp3+Tregs to TH17-like cells in tumor-draining lymph nodes [J]. Blood, 2009, 113(24):6102-6111.

