还原糖电化学检测方法和装置研究*
(1.山东省科学院生物研究所,济南 250014; 2. 山东大学生命科学学院,济南 250010;3.山东省生物传感器重点实验室,济南 250014; 4.山东鲁洲生物科技有限公司,沂水 276400)
目前食品中还原糖的分析方法较多,现行国家专业标准[1]及国际官方分析化学家协会(AOAC)推荐方法[2]中,均采用容量分析法,即斐林试剂滴定法和高锰酸钾滴定法。这两种方法对滴定终点的判断带有经验性,干扰因素多[3],受操作者主观因素影响较大,对还原糖的评价不够准确。除经典的滴定分析方法外,仪器分析方法有液相色谱法[4]、电化学法[5-8]、间接原子吸收法[9]和分光光度法[10,11]等。斐林试剂光度法[12]由于斐林试液与还原糖作用后产生氧化亚铜沉淀,测定溶液吸光度时需进行离心分离,比较繁琐;铁氰化钾光度法[13]则要求在沸水浴条件下反应,且时间较长。许汉英等[14]建立了蜂蜜中还原糖的流动注射-分光光度分析方法。笔者利用还原糖与铁氰化钾[K3Fe(CN)6]反应后生成的亚铁氰化钾[K4Fe(CN)6]能够进行电化学测定的原理,将流动注射技术与电化学安培方法相结合,研究还原糖的流动电化学检测装置和方法,旨在为食品中还原糖测定及产品质量检验提供快速、简便、准确的检测方法。
1 实验部分
1.1 主要仪器与试剂
电化学分析仪:CHI614c型,上海辰华仪器公司;
恒温水浴锅:HH-S型,江苏国胜实验仪器厂;
电化学三电极检测系统:自制Ag/AgCl参比电极(1 mol/L KCl),直径2 mm金圆盘工作电极(天津艾达恒晟科技发展有限公司),自制不锈钢管辅助电极;
葡萄糖、铁氰化钾、氢氧化钠:均为分析纯;
蜂蜜:市售;
实验用水为二次蒸馏水。
1.2 溶液的配制
标准葡萄糖储备液:200.0 g/L,精确称取20.00 g烘干葡萄糖,加蒸馏水溶解,定容至100 mL,备用。
系列葡萄糖标准溶液:分别准确移取75.0、50.0、25.0、12.5 mL 200.0 g/L标准葡萄糖储备液,用蒸馏水定容至100 mL,配制成浓度分别为150.0、100.0、50.0、25.0 g/L的系列葡萄糖标准溶液。
0.5% K3Fe(CN)6-1.2%NaOH混合溶液:准确称取2.500 g K3Fe(CN)6和6.000 g NaOH,用蒸馏水溶解后,定容至500 mL,备用。此混合溶液可在室温下放置1个月。
蜂蜜待测液:称取混合均匀的蜂蜜样品约6 g(精确到0.001 g),用蒸馏水溶解,然后移入50 mL容量瓶中,用蒸馏水定容。
橙汁:某品牌橙汁饮料原液作为待测液。
发酵液:将2份发酵液离心后取上清液作为待测液。
糖化液:将5份糖化液离心后取上清液,分别稀释3、5、5、5、7倍,配制成待测液。
1.3 试验方法
(1)装置和原理
实验装置示意图见图1。在储液瓶中装有0.5% K3Fe(CN)6-1.2% NaOH的底液,通过蠕动泵进样到预混池,预混池上端有一直径2 mm的小孔。当测样时用微量注射器取10 μL葡萄糖标准溶液或含有还原糖的待测溶液,通过预混池上端小孔注入。电磁搅拌池中溶液使待测液与底液充分混合后,通过蠕动泵将混合液泵入水浴加热的盘管反应器中,还原糖在碱性溶液中能将K3Fe(CN)6还原为K4Fe(CN)6;反应溶液进一步流经在室温水浴中的盘管使溶液冷却。最后包含K4Fe(CN)6、NaOH、过量的K3Fe(CN)6等物质的溶液进入测定池。在反应中由于K3Fe(CN)6是过量的,还原糖含量与生成的K4Fe(CN)6的浓度呈一定摩尔关系,而K4Fe(CN)6是一种电化学氧化还原活性物质,在一定正电位下能够被氧化生成K3Fe(CN)6。测定池为自行设计的适合流动检测的电化学检测池,两边分别固定Ag/AgCl参比电极和金圆盘工作电极,其中一段用作溶液流通管道的不锈钢管作为辅助电极,通过CHI614c电化学工作站在工作电极上施加恒定电位,记录由K4Fe(CN)6氧化产生的氧化电流,由计算机输出图形。由于K4Fe(CN)6的氧化电流与还原糖浓度呈一定的相关性,因此可以根据测得的K4Fe(CN)6氧化电流信号计算还原糖的含量。

1—储液瓶; 2—蠕动泵; 3—预混池; 4—热水浴; 5—冷水浴; 6—参比电极; 7—工作电极; 8—辅助电极; 9—测定池; 10—废液; 11—数据输出图1 实验装置示意图
(2)参比电极的制作
将一根直径500 μm、长约5 cm的Ag丝用金相砂纸打磨掉表面的氧化层,直至明亮光滑,以保证镀在Ag丝上的AgCl层均匀牢固,从而达到其电位稳定。将打磨好的Ag丝在丙酮中超声清洗约30 min,除去Ag丝表面油污、杂质等,再在二次水中超声清洗3次,每次5 min。以清洗干净的Ag丝作为正极,另一根直径为500 μm Ag丝作为负极,两电极间加+1.5 V直流电压,在1.00×10-3mol/L KCl溶液中进行电镀。在作为正极的Ag丝表面会有AgCl生成,约12 h后,取出镀好的Ag/AgCl丝。在未镀有AgCl的Ag丝一端焊上一根粗铜丝,起导电作用,并且避免实验过程中Ag丝被折断。把Ag/AgCl丝插入一根加工好的前端封有素烧陶瓷的聚四氟乙烯管中,使铜丝与Ag丝接界处的焊锡刚好处于管口外,向管中注入1 mol/L KCl溶液,然后用环氧树脂胶封闭管口,室温固化24 h。最后将做好的Ag/AgCl参比电极插入一个盛满1 mol/L KCl溶液的塑料瓶中,保存备用。
2 结果与讨论
2.1 测定电位的选择
取50.0 g/L葡萄糖标准溶液10 μL注入预混池中,使用电化学分析仪的循环伏安技术记录工作电极在0~0.45 V间的循环伏安曲线,如图2所示。由于K3Fe(CN)6和K4Fe(CN)6是一对可逆的氧化还原物质,所以此图为溶液中过量的K3Fe(CN)6与反应生成的K4Fe(CN)6共同在金圆盘工作电极上反应产生的循环伏安图。从图2中可看出K4Fe(CN)6从0.1 V开始被氧化为K3Fe(CN)6,电位为0.26 V时氧化电流达到峰值。当用安培法测定K4Fe(CN)6的氧化电流时,工作电极的检测电位必须设定为比0.26 V更高的电位,本实验选择电位为0.40 V。
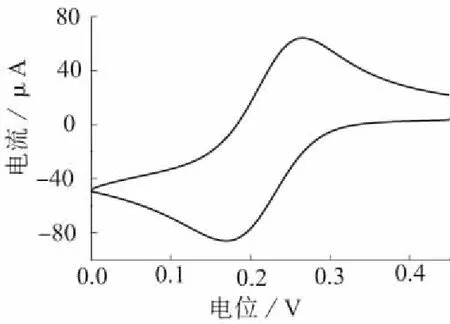
图2 工作电极在K4Fe(CN)6溶液中的循环伏安曲线
2.2 进液管道直径与测定池直径比例的选择
由于工作电极产生的检测电流在微安级,所以当进液管道的直径与测定池的直径之比为1∶4时,进液泵蠕动产生的脉动波将对检测电流产生脉动波形干扰,如图3中曲线1所示;而当二者之比为1∶4.5时进液泵产生的脉动波形干扰减轻,见图3中曲线2;当二者比值为1∶5时,脉动干扰进一步减轻,见图3中曲线3。在本实验装置实际使用过程中控制进液管道直径与测定池直径之比为1∶6可以完全消除蠕动泵产生的脉动波干扰,见图3中曲线4。

曲线1~4进液管道的直径与测定池的直径之比依次为1∶4、1∶4.5、1∶5、1∶6图3 脉动波对测定电流的影响
2.3 测定液流动状态的选择
在多数电化学测定过程中,需要保证溶液本体浓度不随反应的进行而改变。在本实验中,若使溶液在静止状态下进行电化学测定,由于研究电极面积与溶液体积之比较大,随着反应的进行,电极附近溶液中K4Fe(CN)6的本体浓度逐渐降低,从而使得反应电极上的测定电流在电极去极化稳定后很快就出现衰减现象,导致数据读取困难、采样终点波动、分析误差增大。为了保证电极表面K4Fe(CN)6的浓度保持稳定,将待测液在电磁搅拌下测定,结果发现搅拌引起的噪音很大,完全掩盖了测定电流信号。当溶液在流动状态下进行测定时,发现测定电流曲线在30~60 s内平直稳定无衰减,且3次测定的电流曲线基本重合。所以本实验中选择溶液在流动状态下进行电化学测定。
2.4 反应液中气泡对测定的影响及其消除
还原糖与铁氰化钾的反应需在60~100℃进行[12],实验发现当加热时反应液中会产生气泡,反应温度越高,测定液中气泡越多,夹杂着气泡的溶液流经测定池中的电极表面,对测定电流干扰也越大。当反应温度为100℃时,大量气泡的产生对测定电流产生很大干扰;当温度为95℃时,由气泡产生的噪音干扰仍较大。随着温度的降低,干扰越来越小。当温度为90℃时,由气泡产生的噪音干扰明显减少;当温度降为85℃时,管道中只有极少的气泡引起电流波动。经观察进液管道中的气泡进入测定池后都是贴着池壁上行,上行中的气泡一旦经过电极表面即对测定电流产生干扰,而要使气泡上行时不接触电极表面,必须使进液管道直径小于测定池直径的5倍以上。本实验选择反应温度为85℃,使用自行设计的合适尺寸的测定池,即可消除气泡对测定的干扰,得到平滑稳定的电流曲线。
2.5 标准工作曲线及检出限
在预混池中泵入包含0.5% K3Fe(CN)6和1.2% NaOH的混合液后,用微量注射器分别取0、25.0、50.0、100.0、150.0 g/L葡萄糖标准溶液10 μL注入预混池中进行测定。每更换一次葡萄糖溶液,第1次进入测定池的溶液用作清洗管道和测定池,不进行电化学检测,从第2次进入的溶液开始电化学安培法检测。测定池中的溶液在流动状态下恒定工作电极电位0.40 V(vs.Ag/AgCl),记录K4Fe(CN)6被氧化的电流-时间(i-t)曲线。取30 s时的稳定电流i,绘制电流-葡萄糖浓度(i-c)标准工作曲线,线性回归方程为i=1.821+0.058 1c。i为K4Fe(CN)6的稳定氧化电流(A),c为标准葡萄糖浓度(g/L),相关系数r=0.999 9。可见此体系还原糖浓度在0~150.0 g/L范围内,与K4Fe(CN)6的氧化电流之间有良好的线性关系。
移取50.0 g/L葡萄糖标准溶液10 μL注入预混池中,连续测定8次,由K4Fe(CN)6氧化电流(见表1)的标准偏差的3倍与工作曲线斜率之比,得检出限为1.19 g/L。
2.6 精密度试验
分别准确移取50.0 g/L葡萄糖标准溶液和橙汁待测液10 μL注入预混池,重复测定8次,由所测的K4Fe(CN)6氧化电流计算出对应的葡萄糖浓度和样品中的还原糖含量,结果见表1。

表1 精密度试验结果(n=8)
由表1可见,葡萄糖标准溶液和样品溶液测定结果的相对标准偏差分别为0.74%、1.72%,证明此方法的精密度良好。
2.7 样品的测定及加标回收试验
取10 μL样品待测液注入预混池中,以下同标准工作曲线的绘制。每份样品平行测定3次,将i-t曲线上30 s时的稳定电流i取平均值,数值代入标准工作曲线,从而计算出待测样液中还原糖的含量(以葡萄糖计)。
在被测样品中加入已知含量的葡萄糖溶液,进行不同样品的回收试验,结果见表2。

表2 回收试验结果(n=3)
表2结果表明,该检测方法测定不同类型样品的回收率为97.8%~101.2%,说明该方法抗干扰性能良好,测定结果准确可靠,能满足测定不同类型样品的需要。
2.8 对照试验
对配制的糖化液和发酵液待测液进行电化学测定,同时用常规斐林滴定法进行对比,结果见表3。
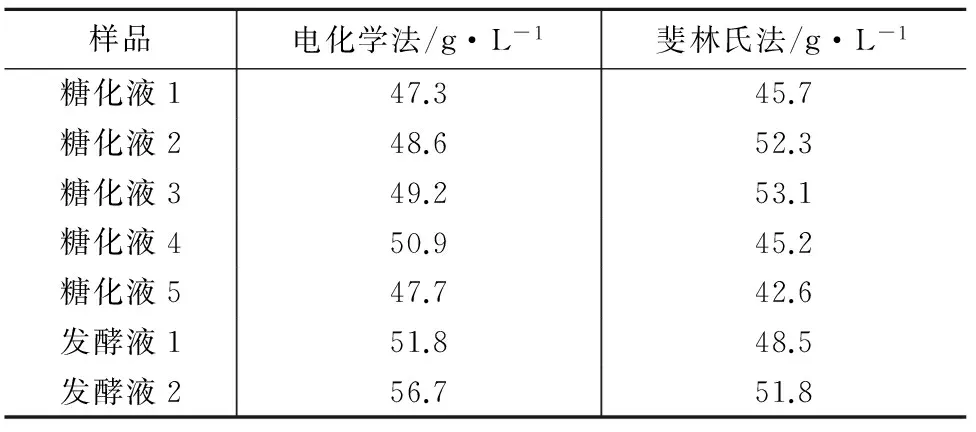
表3 对照试验(n=3)
对两组结果进行t检验,P>0.05,表明两种分析方法无显著差异。
3 结论
将流动注射技术与电化学检测相结合,设计了适合流动注射测定的电化学检测池,并使溶液混合、反应、检测集中于一条管道中,实现了橙汁、蜂蜜、糖化液、发酵液多种样品中还原糖的半自动电化学检测。该法具有准确度高、精密度好、操作简单等特点,可以满足多种样品中还原糖测定的需要。
方法的线性范围宽,还原糖浓度在0~150.0 g/L范围内有良好的线性关系;对于还原糖含量高的样品,可以减小待测样的稀释倍数,降低了因稀释倍数太大导致的误差。提高了还原糖的分析速度,电极实际响应时间约30 s,加上前处理样品的测定时间不超过4 min,尤其适用于大量样品的分析。与光度法相比,电化学技术不受溶液颜色、浊度的影响,抗干扰力较强。
[1] GB/T 5009.7-2003 食品中还原糖的测定[S].
[2] 中华人民共和国国家进出口商品检验局AOAC编译委员会.AOAC公定分析方法[M].北京:中国科学技术出版社,1990:1 134.
[3] 史建国,杨俊慧,马耀宏,等.费林氏法测定还原糖误差分析[J].发酵科技通讯, 2002(4):1-2.
[4] Yamauchi S, Nakai C, Nimura N, et al.Development of a highly sensitive fluorescence reaction detection system for liquid chromatographic analysis of reducing carbohydrates[J].Analyst, 1993,118(7):773-776.
[5] You T, Niwa O, Chen Z, et al. An amperometric detector formed of highly dispersed Ni nanoparticles embedded in a graphite-like carbon film electrode for sugar determination[J].Anal Chem,2003,75(19):5 191-5 196.
[6] Tommaso R I C, Massimiliano A, Giuliana B. Determination of mono-and disaccharides in milk and milk products by high-performance anion-exchange chromatography with pulsed amperometric detection[J].Anal Chim Acta,2003,485:43-49.
[7] 偰德翱.电位滴定法测定葡萄酒中还原糖含量的研究[J].食品工程, 2007(3): 61-63.
[8] Nanos C G, Karayannis I. Assay of reducing sugars in beverages, wines, honey and marmalades using potentiometric-stripping analysis (PSA)[J]. Fresenius’ J Anal Chem,1991,340(4):253-257.
[9] Yebra M C, Gallego M. Automatic determination of reducing sugars by atomic absorption spectrometry[J].Anal Chim Acta,1993,276(2):385-391.
[10] 赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536.
[11] 杨贵明,蒋爱华,薛秋生.用DNS光度法测定还原糖的条件研究[J].安徽农业科学,2006,34(14):3 258-3 264.
[12] 关庆荣,周绍英.费林试液比色法测定蜂蜜中的还原糖[J].药物分析杂志,1992,12(3):178-181.
[13] 赵志明,许汉英.分光光度法测定出口蜂蜜中的还原糖[J].现代商检科技,1997,7(2):37-38.
[14] 许汉英,王柯敏.流动注射-分光光度法测定蜂蜜中还原糖的研究[J].高等学校化学学报,1998,19(12):1 925-1 928.
[15] 李雪梅,孙士青,马耀宏,等.电化学安培技术检测还原糖方法的建立[J].食品与发酵工业,2008,34(6):120-123.

