离子色谱法同时测定茶叶中多种阴离子*
黄 芳 吴晓霞 刘燕晓 郑甜甜
(南京晓庄学院生物化工与环境工程学院,南京 211171)

1 实验部分
1.1 主要仪器与试剂
离子色谱仪:PIC-8型,青岛普仁仪器有限公司;
C18-SPE柱:北京博纳艾结尔科技有限公司;
超声波清洗器:KQ2200型,江苏昆山超声仪器厂;
数显恒温水浴锅:HH-2型,金坛市荣华仪器制造有限公司;
电子天平:AUY120型,日本岛津公司;
氟化钠、氯化钠、亚硝酸钠、硝酸钠、硫酸钠、碳酸钠、碳酸氢钠、磷酸二氢钾:分析纯,上海凌峰化学试剂有限公司;
茶叶样品购于当地超市;
所有溶液均用二次去离子水配制。
1.2 标准溶液的配制

1.3 色谱条件
NJ-SA-4A型阴离子色谱柱(250 mm×4.6 mm);淋洗液:1.92 mmol/L Na2CO3+1.80 mmol/L NaHCO3,流量为1.5 mL/min;柱温:20℃;进样量:200 μL。以保留时间定性,峰面积定量。
1.4 样品前处理
将茶叶置于烘箱中,于80℃干燥2 h后在研钵中粉碎,过250 μm(60目)筛备用。准确称取0.50 g茶叶样品置于小烧杯中,加入水50 mL,于95℃超声20 min,定容至100 mL容量瓶中。以1 mL/min的速度经过已用1 mL甲醇和3 mL水活化后的C18-SPE柱,弃去前2 mL的流出液,收集中间的流出液。将流出液经0.22 μm一次性微孔滤膜过滤,即得到样品溶液。
1.5 标准曲线的绘制和计算
2 结果与讨论
2.1 浸提方式的选择
将茶叶分别用沸水浸提、60℃超声浸提、95℃超声浸提3种方法进行提取,统一超声时间为20 min,提取液为50 mL。实验结果表明:95℃超声浸提的浸出率相对较高,60℃超声浸提率略低于95℃超声浸提率,沸水浸提的浸出率最低。故以下实验均采用95℃超声浸提的方式。
2.2 浸提时间对茶叶中各阴离子浸出的影响
为了讨论不同超声时间对各阴离子浸出率的影响,将95℃水浴超声浸提的时间分别设置为10、20、30、40 min,实验结果表明:超声20 min后,Cl-的提取率有较大波动,其余离子在超声20 min后,提取率达到较高水平并相对稳定。故实验中选择提取时间为20 min。
2.3 料液比对茶叶中各阴离子浸出的影响
实验考察了不同提取液体积对提取率的影响。精密称取0.5 g茶叶样品,分别加入30、50、70、90 mL的提取液,经超声20 min后分别进行测定。实验发现,不同提取液体积对Cl-的提取率有影响,当样品量一定时,加入的提取液的量不足时,各离子提取不完全;提取液的量过多,各离子浓度降低,色谱峰面积反而减小。当加入提取液体积为50 mL时各离子的相对提取率较高。故选择提取液体积为50 mL。
2.4 标准曲线和精密度
配制一系列不同浓度的标准溶液,在色谱条件下,按浓度由低到高分别进样,测定不同浓度下的色谱峰面积和保留时间,以峰面积(Y)对浓度(X)进行线性回归,得到阴离子混合标准溶液中6种阴离子的线性范围、线性方程和检出限,见表1。

表1 6种阴离子线性方程和检出限
为了考察方法的精密度,在选定的色谱条件下测定阴离子混合标准溶液,平行进样9次,经计算6种离子的保留时间的相对标准偏差均小于2.0%,峰面积的相对标准偏差均小于5.0%,表明方法的精密度较好。
2.5 回收试验
为了验证方法的准确性,测定茶叶原样及加标样的6种阴离子含量,原样及加标样按1.4处理后对6种阴离子含量进行测定,并计算测定结果的平均值和平均回收率,结果列于表2。由表2可见,样品6种离子的加标回收率为94.40 %~111.8 %,表明方法的准确度较高。
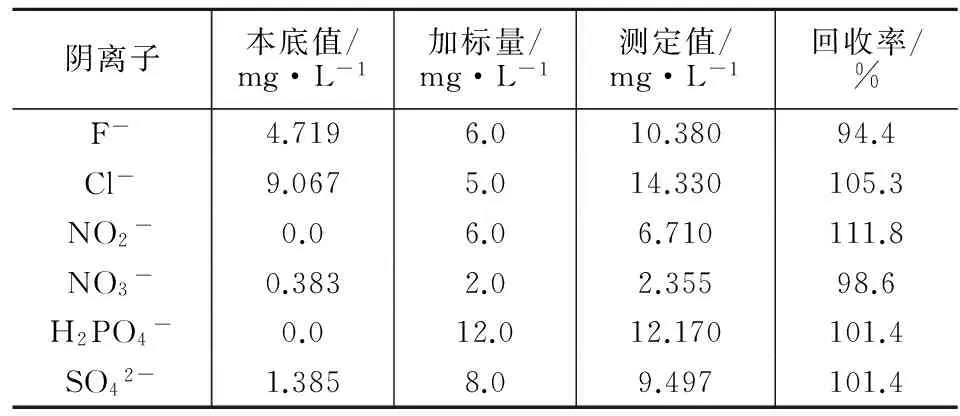
表2 茶叶中6种阴离子的加标回收试验结果(n=5)
2.6 样品分析
按选定的实验条件,对不同产地的4种茶叶样品进行了测定,结果列于表3。
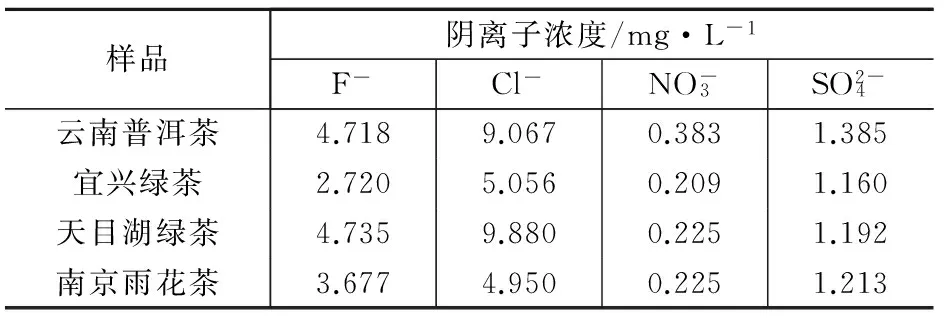
表3 茶叶样品中阴离子浓度的测定结果
注:只检测到上述4种离子,NO2-,H2PO4-在本方法下均未检测到。
通过实验发现,不同种类、不同产地的茶叶中各阴离子含量有一定差异。云南普洱茶样品的离子色谱图见图1。
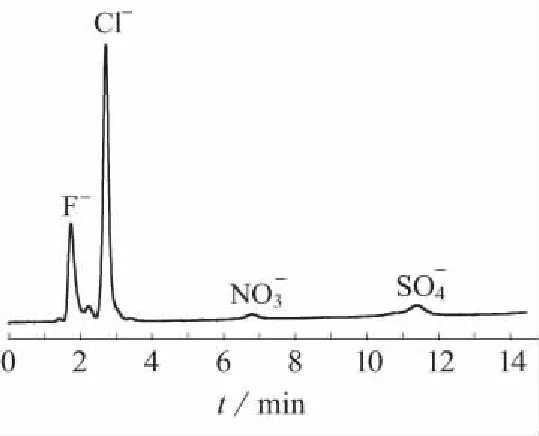
图1 云南普洱茶样品离子色谱图
3 结语
[1] 文君, 高舸.茶叶中微量元素分析进展[J]. 中国卫生检验杂志, 2002, 12(3): 381-384.
[2] 李川,王饮.常见茶叶氟含量的聚类分析级氟安全性探讨[J].环境科技, 2008, 21(6):24-26.
[3] 刘耀华, 倪刘建. 离子色谱法测定绿茶与乌龙茶中的F-, Cl-, NO3-, SO42-[J]. 环境科技, 2009, 22(1): 32-33.
[4] 庄会荣. 离子色谱法测定茶叶中的无机阴离子[J]. 理化检验:化学分册, 2009, 45(5): 543-545.
[5] 江锦花,蔡郁蓓. 离子色谱法测定茶叶中阴离子含量研究[J]. 光谱实验室, 2005, 22(2):404-405.

