南海红树林内源真菌Fusarium sp.#ZZF51生物吸附铀(Ⅵ)
阳海斌,谭 倪,*,张红萍,邓昌爱,孙 曼,林永成,佘志刚
1.南华大学 化学化工学院,湖南 衡阳 421401;2.邵阳学院 生物与化学工程系,湖南 邵阳 422000;3.中山大学 化学化工学院,广东 广州 510275
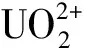
红树林内源真菌Fusariumsp.#ZZF51,采自湛江海域。前述工作初步表明,它对重金属具有较强的吸附能力,其吸附不是依靠简单渗透的被动吸收,而是依靠“泵”式的主动生物吸收[11]。为了系统全面研究该受试菌吸附铀(Ⅵ)的生物吸附特性,本工作拟从铀(Ⅵ)的初始浓度、pH 值、吸附时间等方面讨论受试菌对铀(Ⅵ)吸附效果的影响,并确定其吸附模型。
1 实验部分
1.1 实验材料和仪器
硝酸双氧铀,兰州四零四厂;偶氮胂Ⅲ,天津市光复精细化工研究所;2,4-二硝基苯酚,上海山浦化工有限公司;氯乙酸、葡萄糖CR,天津市福晨化学试剂厂;乙酸钠,淄博天智化工有限公司;氨水、HCl及NaOH均为分析纯;蛋白胨BR,北京奥博星生物技术有限责任公司;酵母膏BR,上海展云化工有限公司;粗海盐(微生物养殖用),湖南省轻工盐业集团有限责任公司。
受试菌Fusariumsp.#ZZF51,由中山大学林永成教授研究组提供。
721型分光光度计,天津市普瑞斯仪器有限公司;PHS-3C pH计,上海鹏顺科学仪器有限公司;电子天平,上海民桥精密科学仪器有限公司,感量为0.001 g;振荡器,长沙索拓科学仪器设备有限公司;Spectrum GX傅里叶-红外光谱仪,美国Perkin Elmer设备有限公司。
1.2 菌种培养
以PDA为培养基,4 ℃保存。发酵培养基为GYP:葡萄糖10 g/L,蛋白胨2 g/L,酵母膏1 g/L,粗海盐2 g/L,pH=7.0。500 mL三角瓶内装培养液300 mL,经121 ℃(0.1 MPa)高温灭菌15 min后,接菌100瓶,共计30 L,25 ℃静置培养22 d, 过滤、收集菌体,菌体经烘干、研磨后,过100目筛并置于干燥器中保存备用。
1.3 静态吸附实验方法
移取一定浓度的硝酸双氧铀溶液50 mL于锥形瓶中,用0.1 mol/L的HCl或NaOH 调节pH 值,投加0.1 g受试菌粉,室温下置于振荡器中反应一定时间,离心分离10 min,取上清液测定铀(Ⅵ)的浓度,计算铀(Ⅵ)的吸附率和吸附容量。实验研究吸附时间、pH、铀(Ⅵ)的初始浓度对受试菌吸附铀(Ⅵ)的影响。每个样品重复2次并做空白对照,取平均值。
1.4 分析方法
在上清液中加入2滴1 g/L的2,4-二硝基苯酚溶液,用1∶1的氨水调至浅黄色,再用3 mol/L HCl溶液调至无色,并过量3 滴,加入1.0 mL pH =2.5 的氯乙酸-乙酸钠缓冲溶液,再用1.0 mL 0.5 g/L的偶氮胂Ⅲ溶液进行显色。用可见分光光度计测定铀(Ⅵ)的浓度。
1.5 计算方法
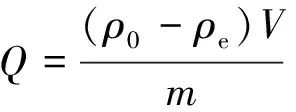
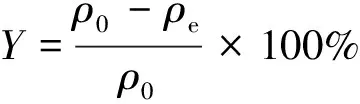
其中:ρ0和ρe分别为铀(Ⅵ)的初始和平衡质量浓度;V为溶液的体积;m为吸附剂的质量。
2 结果与讨论
2.1 吸附时间对吸附效果的影响
准确移取50 mg/L的硝酸双氧铀溶液于一系列锥形瓶中,调节其pH=4.0,改变吸附时间,测定溶液中铀(Ⅵ)的吸附率和受试菌吸附量的变化,实验结果示于图1。由图1可知,随着时间的增加(0~60 min),吸附量和吸附率迅速增大。60 min时吸附达到饱和,其吸附率和吸附量分别为61.89% 和 15.46 mg/g。此后随着时间的增加,溶液中铀(Ⅵ)的吸附率不再增加。原因可能是在吸附过程的最初阶段,受试菌表面具有大量的吸附活性点,吸附可能是单分子层的快速吸附,反应速度快,吸附效率很高[3,9]。随着时间的不断增加,受试菌表面的吸附活性点逐渐饱和,同时吸附的过程中也伴有解吸现象,从而导致溶液中铀(Ⅵ)的吸附率有所降低[2]。
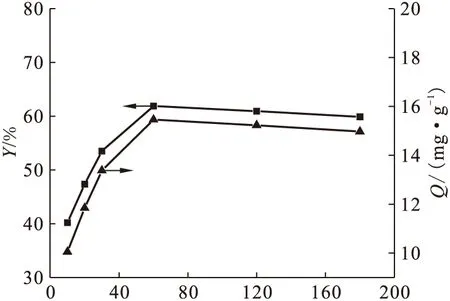
图1 吸附时间的影响
2.2 铀初始质量浓度对吸附效果的影响
取不同浓度的硝酸双氧铀溶液于一系列锥形瓶中,调节其pH=4.0,各投加0.1 g受试菌粉,室温下振荡吸附60 min,检测铀(Ⅵ)的浓度,计算吸附量和吸附率,结果示于图2。由图2可知,铀(Ⅵ)初始质量浓度在20~70 mg/L、吸附量从5.51 mg/g增至21.25 mg/g、而铀(Ⅵ)的初始质量浓度为50 mg/L时,吸附率达最大,为61.89%。其原因可能如下:(1) 细胞壁表面已达到饱和;(2) 随着铀(Ⅵ)浓度的增加,大量的铀会聚集在溶液中,从而抑制铀(Ⅵ)的吸附[2]。

图2 铀初始质量浓度的影响
2.3 pH值对吸附的影响
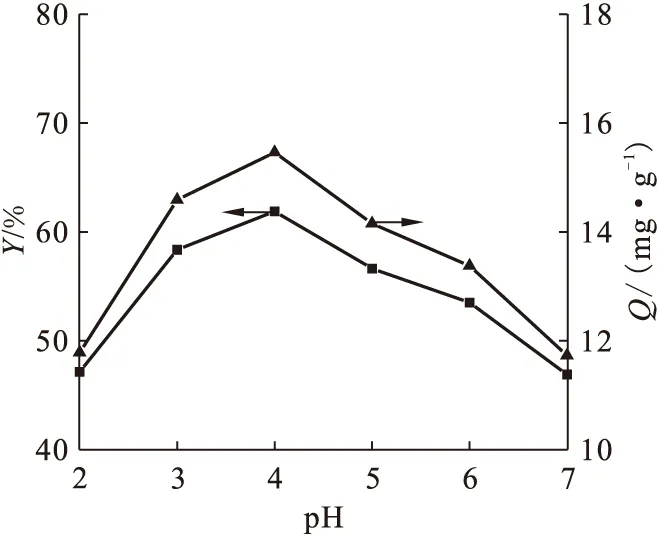
图3 溶液pH值影响
移取初始质量浓度为50 mg/L的硝酸双氧铀溶液于一系列锥形瓶中,在室温下开展铀(Ⅵ)的吸附实验,考察溶液pH值对铀(Ⅵ)吸附的影响,结果示于图3。由图3可知,pH=4.0时吸附量最大。在pH<4.0的酸性环境下,由于氢离子占据了大量的吸附活性位点,从而阻碍了铀(Ⅵ)与细胞壁上官能团的结合,导致吸附率很低。随着pH值的增大,官能团上的质子不断解离,吸附量逐渐增大。但当pH>4.0时,溶液中的金属离子主要以UO2(OH)+和 UO2(OH)2的形式存在,游离金属离子减少,所以吸附率反而下降[2,11]。
2.4 吸附模型
用Langmuir和Freundlich方程来拟合受试菌对铀(Ⅵ)的等温吸附过程,其模型参数列入表1、2。具体拟合方法如下:对 Langmuir 方程,以1/ρe为横坐标、1/Q为纵坐标得到一条直线,求出常数Ka和最大理论吸附量Qm;在 Freundlich方程中,Kb和n分别是方程的常数,他们分别表征吸附容量和吸附强度的大小,ρe是溶液的质量平衡浓度,将方程两边取对数后,以lnρe为横坐标、lnQ为纵坐标得到一条直线,求出常数Kb和n[12]。由表1、2可知,两种吸附等温线均可用来拟合该受试菌对铀的吸附,其吸附容量Qm与质量平衡浓度ρe的双对数、双倒数均有良好的线性关系,其吸附行为同时符合Langmuir 和Freundlich等温吸附方程。
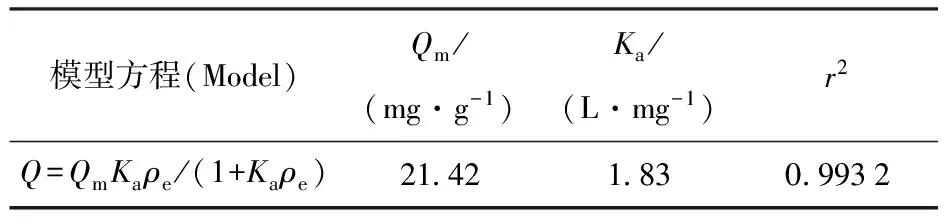
表1 最佳条件下Langmuir吸附方程参数
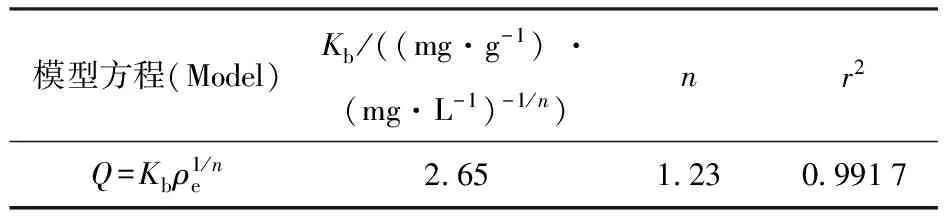
表2 最佳条件下Freundlich 吸附方程参数
2.5 红外光谱分析
真菌Fusariumsp.#ZZF51吸附铀(Ⅵ)前后的红外光谱图示于图4。据文献[2,13]报道,细胞壁是重金属离子的主要积累场所,金属离子可与细胞壁上的活性基团相结合。由图4(a)可知,在3 408 cm-1处观察到一个较宽的峰,可能是N—H或O—H键的伸缩振动峰;蛋白质是细胞壁的主要成分之一,1 649 cm-1处的吸附峰可能为酰胺Ⅰ带(由C=O的伸缩振动所产生),1 550 cm-1处的吸收峰可能为酰胺Ⅱ带(由N—H键的弯曲振动所产生),1 313 cm-1处的峰可能为酰胺Ⅲ带(由C—N键的伸缩振动所产生),1 313 cm-1处的吸收峰还可能由P=O与C=S的伸缩振动或C—O的伸缩振动所引起。2 920 cm-1和1 409 cm-1处的吸收峰分别为饱和烷烃C—H键的伸缩振动峰和弯曲振动峰。通过比较图4(a)和4(b)可以发现,氨基或羟基的伸缩振动峰从3 408 cm-1移至3 452 cm-1,可能是由于氨基或羟基参与了吸附,使得形成的氢键断开,引起氨基或羟基的伸缩振动最大峰发生了位移,同时羰基的对称伸缩振动峰由1 649 cm-1移至1 631 cm-1,上述现象说明受试菌生物吸附铀(Ⅵ)时,羟基和羰基都有十分重要的贡献[13-15]。
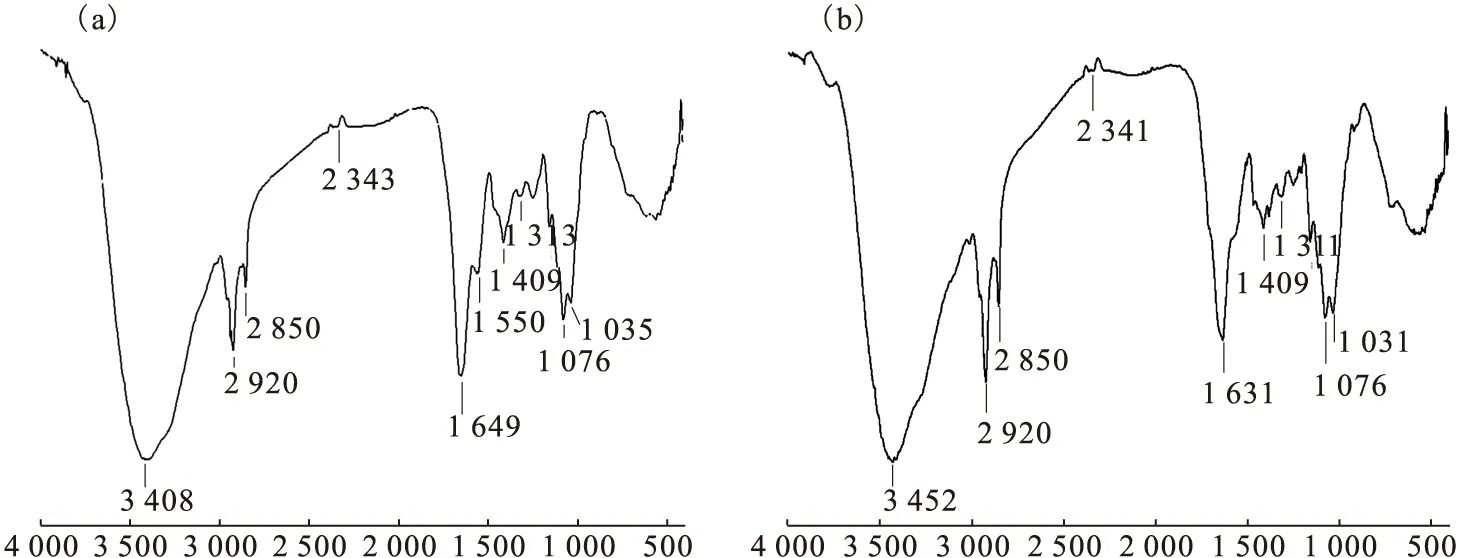
图4 真菌Fusarium sp.#ZZF51吸附铀(Ⅵ)前(a)与吸附铀(Ⅵ)后(b)的红外光谱图
3 结 论
真菌Fusariumsp.#ZZF51对铀(Ⅵ)有一定的吸附能力,其吸附铀(Ⅵ)的最佳实验条件为:吸附时间为60 min,铀(Ⅵ)初始质量浓度为50 mg/L,pH=4.0,此时受试菌对铀(Ⅵ)的吸附容量为15.46 mg/g。根据实验数据与Langmuir和Freundlich方程拟合可知,受试菌生物吸附铀(Ⅵ)的热力学模型与Langmuir和Freundlich方程均符合较好。比较受试菌吸附铀(Ⅵ)前后的红外光谱图可得,在吸附过程中,羟基和羰基都起着重要的作用。
[1] 刘 梅,朱桂茹,苏 燕,等.偕胺肟基纤维的合成及对铀的吸附性能研究[J].水处理技术,2009,35(7):13-16.
[2] Wang G H,Liu J S,Wang X G.Adsorption of Uranium(Ⅵ) From Aqueous Solution Onto Cross-Linked Chitosan[J]. J Hazardous Mater,2009,168: 1 053-1 058.
[3] Wang J S,Hu X J,Liu Y G,et al. Biosorption of Uranium(Ⅵ) by Immobilized Aspergillus Fumigatus Beads[J]. J Environmental Radio,2010,101: 504-508.
[4] Anirudhan T S,Bringle C D,Rijith S.Removal of Uranium(Ⅵ) From Aqueous Solutions and Nuclear Industry Effluents Using Humic Acid-Immobilized Zirconium-Pillared Clay[J]. J Environmental Radio,2010,101: 267-276.
[5] Donia A M,Atia A A,Moussa M M,et al. Removal of Uranium(Ⅵ) From Aqueous Solutions Using Glycidyl Methacrylate Chelating Resins[J]. Hydrometallurgy,2009,95: 183-189.
[6] 王水云,谢水波,李仕友,等.啤酒酵母菌吸附废水中铀的研究进展[J].铀矿治,2008,27(2):96-100.
[7] Wang J L,Chen C. Biosorbents for Heavy Metals Removal and Their Future[J]. Biotechnol Adv,2009,33(27): 195-226.
[8] 张小枝,罗上庚,杨 群,等.满江红鱼腥藻吸附低浓度铀的研究[J].核化学与放射化学,1998,20(2):114-118.
[9] Mohammad R S,Ali S,Javad Z,et al. Removal and Recovery of Heavy Metals From Aqueous Solution Using Ulmus Carpinifolia and Fraxinus Excelsior Tree Leaves[J]. J Hazardous Mate,2008,155: 513-522.
[10] Sag Y S,Kutsal T L. Recent Trends in the Biosorption of Heavy Metals: A Review[J]. Biotechnol Bioprocess Eng,2001,6: 376-385.
[11] 谭 倪,邵长伦,佘志刚,等.海洋微生物次级代谢产物中醌类化合物的研究进展[J].中国天然药物,2009,7(1):71-80.
[12] Bai J,Yao H J,Fan F L,et al. Biosorption of Uranium by Chemically Modified Rhodotorula Glutinis[J]. J Environ Radio,2010,101: 969-973.
[13] Tsekova K,Christova B,Ianis A. Heavy Metal Biosorption Sites in Penicillium Cyclopium[J]. J Appl Sci Environ Mgt,2006,10(3): 117-121.
[14] 白 静,秦 芝,王菊芳,等.粘红酵母对铀的吸附研究[J].光谱学与光谱分析,2009,29(5):1 218-1 221.
[15] Gupta V K,Rastogi A. Biosorption of Lead From Aqueous Solutions by Green Algae Spirogyra Species: Kinetics and Equilibrium Studies[J]. J Hazard Mater,2008,152(1): 407-414.

