磷酸三丁酯萃取体系从盐湖卤水提取锂
,,,,
(1.中国科学院青海盐湖研究所中国科学院盐湖资源与化学重点实验室,青海西宁 810008;2.中国科学院研究生院)
锂及其化合物有许多特有的优良性能,可广泛应用于玻璃、陶瓷、润滑、电子、冶金、医药、制冷、新能源航空航天等诸多领域。中国盐湖含锂卤水资源中锂含量以及镁锂比都很高,为锂资源的开发带来困难。锂盐生产过程中会排放大量的老卤,其中的镁、锂、硼等元素未被回收利用。这不仅造成资源极大的浪费和经济的巨大损失,也使环境及资源结构遭到严重破坏。中科院青海盐湖研究所在20世纪70年代提出的TBP-磺化煤油萃取体系对高镁卤水萃取锂具有良好的萃取效果[1-2],但终因工艺流程复杂、酸碱用量过大、强腐蚀性对设备要求过高等问题未能实现工业扩大化生产。笔者提出采用磷酸三丁酯(TBP)萃取体系从盐湖卤水中分离提取锂的工艺,旨在为卤水资源再利用和工业扩大化生产提供参考。
1 实验部分
1.1 实验原料及试剂
原料:采用东台吉乃尔盐湖提钾老卤为基本原料,实验室进行算法除硼后,其主要成分见表1。

表1 卤水主要成分 mol/L
试剂:磺化煤油,化学纯;TBP、FeCl3·6H2O、盐酸、NaOH,均为分析纯;铬黑T等。
1.2 实验设备及检测方法
1.2.1 仪器设备
ARCOS型全谱直读等离子体发射光谱仪(ICP);便携式pH计;康氏振荡器;分析天平;分液漏斗等。
1.2.2 检测方法
采用全谱直读等离子体发射光谱仪分析Li+、Na+、K+、Ca2+、Fe2+等的含量;用乙二胺四乙酸(EDTA)络合法测定Mg2+的含量;采用汞量法测定Cl-的浓度。
1.3 实验原理
在FeCl3存在下用TBP对卤水进行萃取,再用盐酸进行反萃取,反应式如下[2]:
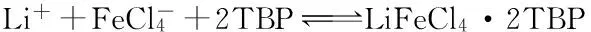
(1)

HFeCl4·2TBP (有机相)+LiCl(水相)
(2)
用稀NaOH中和空载有机相HFeCl4·2TBP中的H+后形成 NaFeCl4·2TBP 循环使用,在酸性环境下萃取锂时再次形成LiFeCl4·2TBP。
2 实验结果及讨论
2.1 萃取影响因素分析[1-3]
2.1.1 TBP含量对萃取率的影响
固定其他条件:相比为2.0、铁锂物质的量比为1.5、c(H+)=0.05 mol/L、振荡时间为5 min。TBP体积分数分别取60%、70%、75%、80%、85%、90%、95%、100%。分别进行单级萃取实验后,用等离子体发射光谱仪测水相中Li+的含量,用差减法计算有机相中Li+的含量。
图1为TBP的体积分数对锂萃取率的影响。由图1可知,锂萃取率随TBP体积分数的增加呈平抛线上升趋势,在φ(TBP)=80%时上升趋势明显放缓。这是因为随着TBP体积分数的增大,水相中绝大部分(90%左右)的Li+已被萃入有机相,余液中的Li+浓度降低使得其与TBP碰撞结合形成络合物的几率减小,水相Li+浓度越小,被萃入有机相的难度越大,导致锂萃取率上升速率减缓。考虑到TBP的价格较贵,且稀释剂磺化煤油含量太低会导致有机相黏度、密度过大而影响两相分离效果,因此实验采用TBP最佳体积分数为80%。

图1 TBP的体积分数对锂萃取率的影响
2.1.2 相比对萃取效果的影响
相比(O/A)是影响萃取过程的一个重要因素,相比过大不但会造成资源浪费,成本提高,还可能增加Mg2+、Na+、K+等杂质离子在负载有机相中的含量;相比过小则会使锂的萃取率偏低,甚至出现第三相而影响萃取效果。
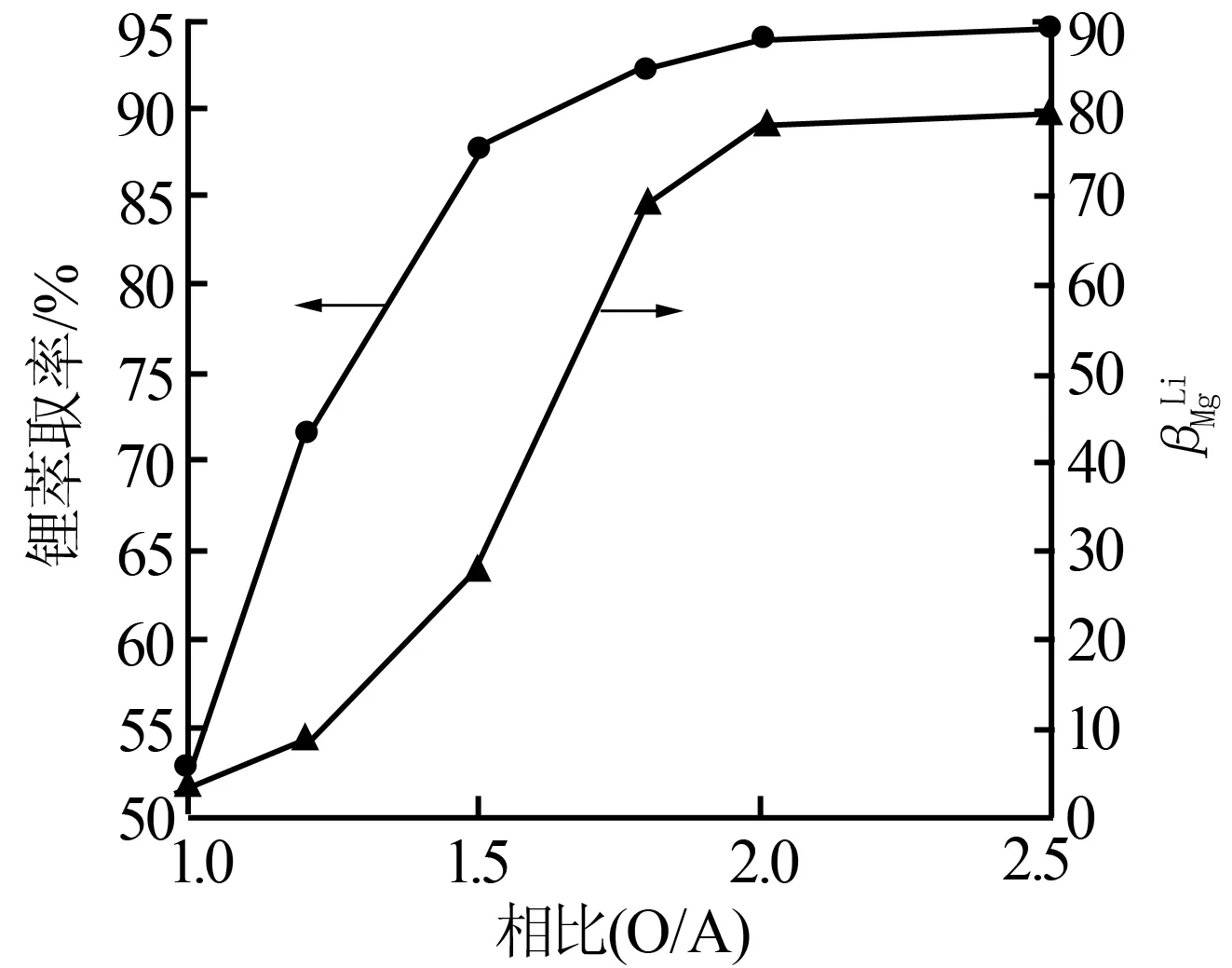
图2 相比对锂萃取率及镁锂分配系数的影响
综合考虑相比对萃取率和锂镁分离系数的影响,最佳相比应选择在1.8~2.0。实验最终采用相比为2.0。
2.1.3 铁锂物质的量比对萃取率的影响
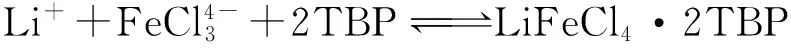

图3 铁锂物质的量比对锂萃取率的影响
2.1.4 H+浓度对萃取效果的影响
一方面,在萃取过程中Li+和H+与有机相的结合是竞争关系,H+的存在不利于对锂的萃取;另一方面,助萃取剂中的Fe3+会与H2O发生水解反应生成Fe(OH)3沉淀而失去助萃取效果,因此必须使水相保持一定的酸度以保证Fe3+不水解;此外,水相酸度还会影响分相时间。
固定其他条件:φ(TBP)=80%、相比为2.0、铁锂物质的量比为1.5、振荡时间为5 min。H+浓度分别取0.02、0.04、0.06、0.08 mol/L进行实验。图4为H+浓度对萃取率及分相时间的影响。由图4可知,随着H+浓度的增大,锂萃取率的曲线呈近似直线的下降趋势,但当H+浓度在0.04~0.06 mol/L时锂萃取率下降速率趋缓,变化率仅为0.2%,而这又是分相时间快速降低的阶段。因此,适宜的H+浓度应选择在0.04~0.06 mol/L。实验最终采用c(H+)=0.05 mol/L。
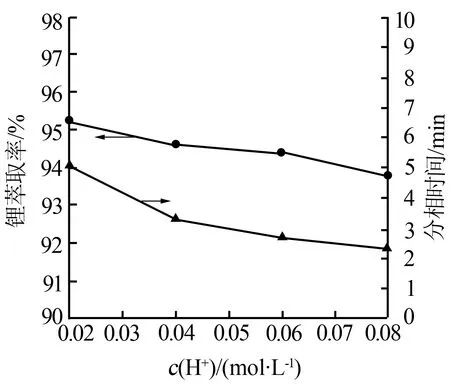
图4 H+浓度对锂萃取率及分相时间的影响
2.1.5振荡时间对萃取效果的影响
振荡时间即为两相接触时间,Li+传质进入有机相并与有机相反应生成萃合物即发生在此阶段。振荡时间的长短直接决定着Li+与有机相的络合反应是否充分,反应是否达到平衡,从而影响萃取率及分相时间。
固定其他条件:φ(TBP)=80%、相比为2.0、铁锂物质的量比为1.5、c(H+)=0.05 mol/L。振荡时间分别取1、2、5、8、12 min进行实验。图5为振荡时间对锂萃取率及分相时间的影响。由图5可知,随着振荡时间的延长,锂萃取率增大,当萃取时间为5 min后锂萃取率几乎无增长;分相时间随振荡时间的增加而增加,但增速缓慢。这是因为当振荡时间增加到一定程度(5 min)时,络合反应和相际传质均已趋于平衡,故萃取率和分相时间达到最大后不再变化。因此,实验选择适宜的振荡时间为5 min。
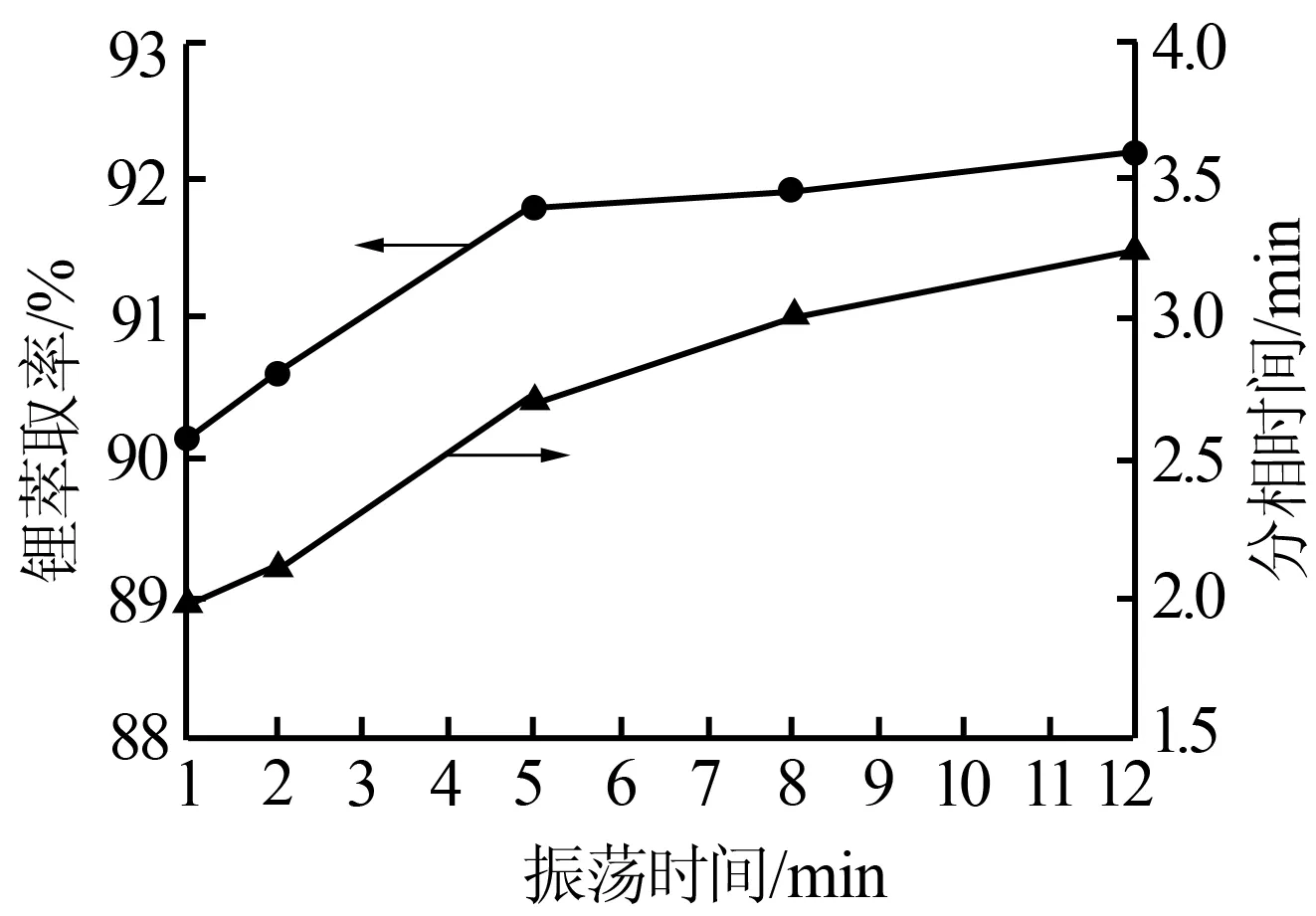
图5 振荡时间对锂萃取率及分相时间的影响
2.2 萃取正交实验分析
2.2.1 正交实验及直观分析
以TBP的体积分数、相比、铁锂物质的量比作为影响因素,选择4个水平,以锂萃取率为考察指标;采用L16(45)正交表进行正交实验。正交实验中水相c(H+)=0.05 mol/L,振荡时间为5 min。考察因素水平如表2所示,实验方案及结果见表3。

表2 因素水平表
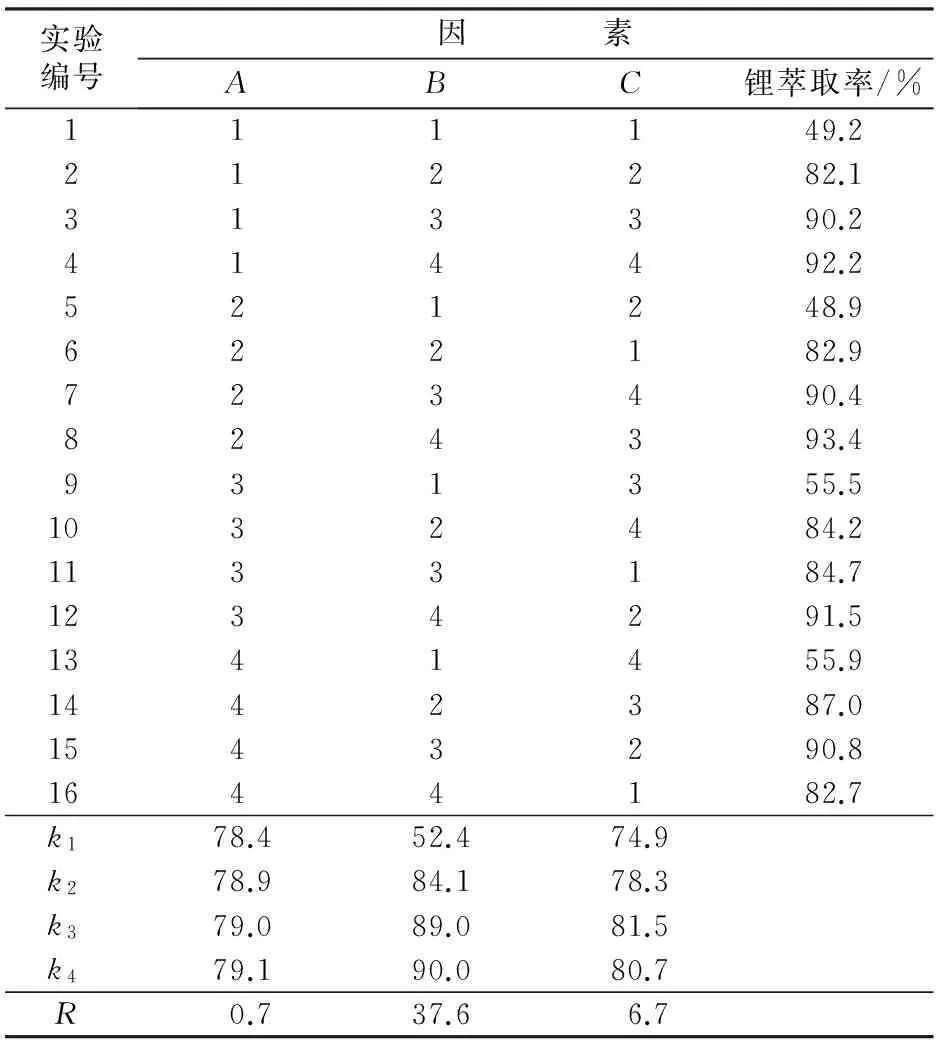
表3 正交实验方案及结果
由表3实验结果可知,相比B为影响实验指标锂萃取率最主要的因素,铁锂比C次之,TBP含量A的影响最小。以因素B的各水平为横坐标、各水平下锂萃取率的平均值为纵坐标作图(如图6所示)。由图6可知,锂平均萃取率随相比增大而增大,并在相比为1.5后增速明显减缓,在相比超过2.0后几乎无增长。为了兼顾实验成本和萃取效率,选择最佳相比为2.0(B3)。又因为因素A对实验指标影响很小,且同样需要兼顾实验成本,故因素A采用2水平。因此,实验最终选择的最优方案为A2B3C3,即φ(TBP)=80%、相比为2.0、铁锂物质的量比1.5,该结果与单因素实验所得结果相一致。

图6 相比各水平与平均萃取率的关系
2.2.2 正交实验结果的验证及其稳定性测试
为了验证正交实验所选择出的最优方案并测试其稳定性,需要按照最优方案的条件进行重复实验。实验条件固定为:φ(TBP)=80%、相比为2.0、n(Fe)∶n(Li)=1.5,c(H+)=0.05 mol/L、振荡时间为5 min。进行3个平行实验,其结果如表4所示。由表4可知,平行实验的锂平均萃取率约为91.4%,波动范围<0.6%,实验结果非常稳定。

表4 平行实验结果
3 结论
1)TBP-磺化煤油萃取体系在高镁含量的盐湖卤水中萃取锂效果较好,单级锂萃取率可达91.4%。
2)考察了TBP体积分数、相比(O/A)、铁锂物质的量比、H+浓度和振荡时间等因素对锂萃取率的影响,得到最佳实验条件为:φ(TBP)=80%、相比为2.0、n(Fe)∶n(Li)=1.5、c(H+)=0.05 mol/L、振荡时间为5 min。通过比较,各因素对锂萃取率的影响从大到小依次为相比、铁锂比、TBP体积分数。正交实验的结果与单因素实验结果一致。
3)该萃取工艺的实验结果具有良好的稳定性和重现性,可为工业扩大化生产提供可靠的参考依据。
[1] 童兆达,李发金,黄师强,等.从大柴旦盐湖脱硼卤水中用TBP连续萃取分离氯化锂[J].稀有金属,1987(1):66-69.
[2] 黄师强,催荣旦,张淑珍,等.磷酸三丁酯从大柴旦盐湖卤水萃取锂的研究[J].盐湖科技资料,1980(1/2):14-23.
[3] 徐徽,孙锡良,侯立松.从盐湖卤水萃取锂的影响因素分析[J].湖南有色金属,2005,21(1):9-10,35.

