妊娠奶牛PAPPA和PAG mRNA表达规律的研究
郭 宁,李 莲,周 璇,崔群维,王根林
(南京农业大学动物科技学院,江苏南京 210095)
妊娠相关血浆蛋白 A(pregnancy-associated plasma protein-A,PAPPA)是1974年Lin[1]等首次从孕妇血清中分离出来的一种大分子糖蛋白质,它在血清中的含量与妊娠周期密切相关。有研究发现,妊娠期PAPPA由胎盘滋养合体细胞和蜕膜细胞分泌合成并进入血循环[2],而PAPPA虽在其他组织也有微量表达,但水平远低于胎盘。目前,在人医上PAPPA已被作为孕妇血清学产前检查的一项重要生化指标,主要用于妊娠早期诊断。近年来大量的研究发现,母体外周血中PAPPA异常低值与胎儿染色体数目和结构异常相关,是目前妊娠早期最常用、最有希望的临床筛查指标之一。
妊娠相关糖蛋白(pregnancy-associated glycoprotein,PAG)是一种由胎盘分泌的妊娠特异性蛋白,已经在牛、绵羊、猪等[3]动物中发现。PAG已经被认为在妊娠过程中起着免疫保护作用,一些研究还表明PAG在妊娠期浓度不断增加与牛的免疫抑制有关[4]。在妊娠奶牛中,PAPPA和PAG都可以作为一种妊娠标记蛋白,且其在妊娠期均有着重要的作用。本试验通过分析PAPPA和PAG的mRNA在妊娠奶牛外周血中的相对表达量,研究其表达规律,从而为奶牛早期妊娠诊断提供参考。
1 材料与方法
1.1 试验材料
1.1.1 试验动物 试验动物来自于扬州大学实验农场无繁殖障碍的48头荷斯坦母牛,将其分为6组,分别为对照组(健康未经产青年奶牛和经产半年内未配种的奶牛)8头,试验组妊娠30 d、60 d、90 d、150 d和240 d母牛各8头。
1.1.2 主要试剂与仪器 柱式病毒RNAout(北京天恩泽基因科技有限公司)、反转录酶(TAKARA)、琼脂、SYBR Green Master(Roche)、7300型荧光定量PCR仪(ABI)、紫外分光光度计。
1.2 试验方法
1.2.1 样品采集 10 mL离心管在0.1%DEPC水中经过夜处理、干燥、高压等步骤彻底清除外源污染的RNA。尾静脉采集奶牛血液,柠檬酸钠抗凝剂与血液以1∶6的比例进行抗凝处理。
1.2.2 引物合成 以看家基因β-actin为内参,从GenBank中检索牛PAPPA和PAG的mRNA序列,使用Primer Premier 5.0软件设计引物,引物由上海英骏生物技术有限公司合成。引物序列见表1。

表1 目的基因的引物序列和片段大小
1.2.3 RNA的提取及检测 所采集的血样于两小时内以1 600 g/min离心10 min,将获得血浆转移至DEPC处理过的1.5 mL离心管中。进行低温高速(温度4℃,离心力24,000 g)离心60 min,取离心后的血浆0.2 mL按柱式病毒RNAout说明书提取RNA。在紫外分光光度计中测定RNA的纯度和浓度,并检测RNA的质量。将所提取的RNA置于-80℃保存备用。
1.2.4 cDNA的制备 在每个所得的RNA样中取2 μ L,按transverse kit(TAKARA)的说明进行反转录,最终获得 20μ L体系的 cDNA样。所得cDNA于-20℃冰箱保存备用。
1.2.5 RT-PCR检测PAPPA的相对表达量 采用20 μ L的反应体系,避光操作,按Roche定量的试剂盒依次加入试剂和模板,在实时荧光定量PCR仪进行反应。反应条件如下设置:94℃预变性2 min, 94℃变性30 s,60℃退火30 s,72℃延伸2 min,共40个循环。并纪录每个样本所得的Ct值。
1.3 数据分折
■Ct=样品 Ct均值-内参照 Ct均值,■■Ct=■Ct-(随机阴性对照样品Ct均值-该样品内参照Ct均值),以2-■■Ct表示样品中目的基因mRNA相对表达量。采用SPSS16.0对所得实验数据进行单因素方差分析,实验数据均用x±s表示。P<0.05为差异有统计学意义。
2 结果
2.1 PAPPA在外周血中的相对表达量
以血液中β-actin的表达量为参照,通过 RTPCR分析PAPPA的mRNA在血液中的相对表达量。试验所得数据见表2。
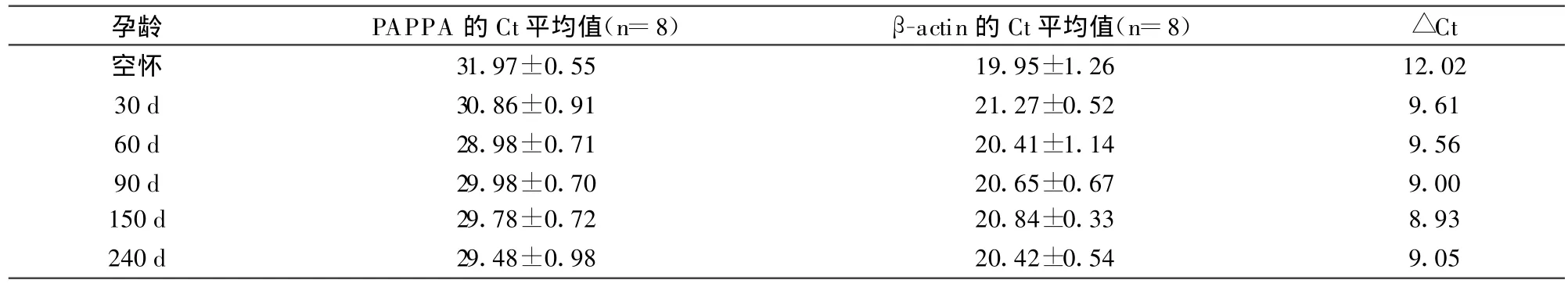
表2 PAPPA的Ct值

表3 PAG的Ct值
以未妊娠奶牛作为阴性对照,计算2-■■Ct,分析整个妊娠期PAPPA的mRNA在血浆的表达规律,结果见图1。与空怀组相比,奶牛妊娠期血浆中的PAPPA的mRNA水平均有显著性提高(P<0.05)。其特征为妊娠初期mRNA表达开始增加,妊娠30 d和60 d两组表达水平基本相同,妊娠150 d时达到表达峰值,妊娠150 d与空怀组比较差异极显著(P< 0.01)。妊娠240 d时表达量有所下降。妊娠5个不同时期PAPPA的mRNA表达水平无显著差异。
2.2 PAG在外周血中的相对表达量
RT-PCR检测PAG的mRNA表达,所得数据见表3。
分析PAG在整个妊娠期的表达规律,结果见图2。虽然在空怀期可以检测到PAG的mRNA表达,但其表达水平较低。以空怀期的表达量为对照,随着妊娠期的开始PAG的mRNA在血浆中的水平开始增加。与空怀期相比,在整个妊娠PAG的 mRNA表达量增加,妊娠30 d、90 d和150 d显著高于空怀期(P<0.05),妊娠60 d和240 d时极显著地高于空怀期(P<0.01)。但妊娠90 d和150 d表达水平下降,妊娠240 d则显著提高。

图1 PAPPA mRNA在空怀和妊娠牛血浆中的相对表达水平
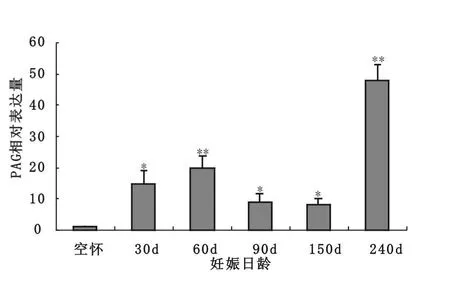
图2 PAG mRNA在空怀牛和妊娠牛的相对表达水平
3 讨论
3.1 血浆中游离RNA
结果表明,PAPPA和PAG的mRNA在血浆中的表达水平低。这两种基因表达水平低的主要原因是由于血浆中游离 RNA的浓度较低。目前,关于母体血浆中游离的胎盘或胎儿源的核酸分子认为有三种来源:①是来源于胎盘,可直接进入外周血循环;②是源于母体外周血循环的胎儿有核细胞凋亡所释放;③是胎儿核酸分子直接通过胎盘转移进入母体外周血循环[5]。2000年Poon等证实孕妇血浆中也存在着胎儿源的Y染色体锌指蛋白(ZFY) mRNA,且更易检测到[6];Ng等随后在孕妇血浆中成功检测到胎盘普遍表达的胎盘催乳素(hPL)和β-HCG的mRNA,并认为胎盘是孕妇血浆胎儿游离核酸的主要组织来源[7]。由于牛的胎盘结构不同于人类,母体血液中胎盘源RNA的来源也可能不同。母体外周血中游离RNA的存在形式比较特殊,其结构类似于病毒,RNA包裹于蛋白外衣内,故本试验中RNA的提取不同于普通血液中提取RNA的常规方法,特以病毒RNA试剂盒提取外周血中游离的RNA。由于个体差异及单个样本独立处理造成提取出的浓度差异极大,但因本试验是测定基因的相对表达量,故不影响最终结果。
3.2 PAPPA和PAG的mRNA在血浆中的表达
在妊娠期间,相对于其他组织,如肝脏和红细胞系,胎盘表达更多的功能性基因,但只有部分的功能是明确的。对于某些功能未明确的基因,目前仍有大量的试验在进行中。现在可通过公布的EST(已表达序列标志)序列、微阵列分析、构建的cDNA文库和联合分析的方法,作为一种研究分析胎盘表达的基因的资源[8,9]。在妊娠早期,如果缺乏某些胚胎自身表达的基因,将会导致妊娠的终止[10,11]。本研究主要通过检测PAPPA和PAG这两种基因的mRNA在妊娠奶牛外周血的表达水平,分析其在妊娠期的表达规律,根据其不同时期的表达量结合其功能更进一步地认识其在妊娠期发挥的作用。
本研究结果表明,妊娠开始后PAPPA的表达水平开始升高,到妊娠150 d时出现高峰。人医方面也有类似的研究成果[12],在妊娠早期单胎受精32 d和双胎受精21 d后孕妇血清中可检测到PAPPA,其含量随孕周而变化,妊娠7周后血清中PAPPA水平比未孕时高出5倍,妊娠终止后迅速消失。有大量研究表明,当妊娠期的PAPPA的表达明显降低时,出现流产、死胎、早产及妊娠高血压等病症的发病率往往较高[13-15]。虽然PAPPA在其他组织中也可以检测到,但是其在妊娠期血浆中的高水平表达,已将其列为一种妊娠标记蛋白[14]。
PAG是一种由胎盘在妊娠期特异产生的一种酸性糖蛋白,可以进入母体的外周血循环,因而提供了一种进行早期妊娠诊断的方法。有多项研究表明,在奶牛配种28或30 d后,用PAG的抗血清进行放射免疫测定可以进行妊娠诊断[16-19]。本试验检测PAG的mRNA在外周血中的表达,结果表明,在空怀期和妊娠期均检测到了PAG的mRNA在血液中的表达,但空怀期的表达极低。空怀期牛血液中 PAG含量并不为零,而是较低,小于1 ng/mL[20-22],这一结果与前人所得的研究结果基本一致。本试验中在妊娠末期(240 d)时,PAG的mRNA的表达量极显著地(P<0.01)高于空怀期,与Patel[23,24]等检测妊娠牛血清中PAG蛋白的结果相似,即血液中PAG蛋白含量高峰出现在分娩前。
PAG属于天冬氨酸蛋白酶家族,但是部分PAG并不具备酶活性,其功能仍然不清楚[25,26]。有研究证明PAG在妊娠期间发挥免疫保护作用,在着床和胎盘形成时有重要的作用[27]。在妊娠第三周,妊娠奶牛的外周血中可检测到PAG[28],并且被用于早期妊娠诊断中。有研究报道在妊娠晚期胚胎死亡后,血清中PAG的浓度迅速开始下降[29],这些研究都表明在妊娠期PAG有着重要的作用,不同时期可能发挥着不同的功能。
本研究证明,PAPPA和PAG可做为妊娠标记蛋白,但PAG的mRNA表达水平与PAPPA相比,在妊娠早期就可达到高水平,这一结果更有助于早期妊娠诊断的准确性。对于两种蛋白及其基因表达在妊娠期的作用,有待进一步研究。
[1] Lin T M,Galbert S P,Kiefer D,et al.Characterization of four human pregnancy-associated plasma proteins[J].Am J Obstet Gynecol,1974,118(2):223-236.
[2] Lin T M,Halbert S P,Kiefer D,et al.Quantitation analysis of pregnancy assiciated plasma protein in human placenta[J].J Clin Invest,1976,57:466.
[3] Overgaard M T,Oxving C,Christiansen M,et al.Messenger ribonucleic acid levels of pregnancy-associated plasma protein-A and the proform of eosinophil major basic protein:ex pression in human reproductive and nonreproductive tissues[J]. Biol Reprod,1999,61(4):1083-1089.
[4] Haugejorden G,Waage S,Dahl E,et al.Pregnancy associated glycoproteins(PAG)in postpartum cows,ewes,goats and their offspring[J].Theriogenology.2006,(66):1976-1984.
[5] 庄岳鹏,兰风华.循环游离核酸的检测及意义[J].临床检验杂志,2007,25(5):395-396.
[6] Poon L L,Leung T N,Lau T K,et al.Presence of fetal RNA in maternal plasma[J].Clin Chem,2000,46(11):1832-1834.
[7] Ng E K,Tsui N B,Lau T K,et al.mRNA of placental origin is readily dectable in maternal plasma[J].Proc Natl Acad Sci USA,2003,100(8):4748-4753.
[8] Tanaka T S,Jaradat S A,Lim M K,et al.Genome-wide expression profiling of mid-gestation placenta and embryo using a 15,000 mouse developmental cDNA microarray[J].Proc. Natl.Acad.Sci,1997,9127-9132.
[9] Hemberger M,Cross J C,Ropers H H,et al.UniGene cDNA array-based monitoring of transcriptome changes during mouse placental development[J].Proc.Natl.Acad.Sci,1998, 13126-13131.
[10] Latham K E,Schultz RM:Embryonic genome activation[J]. Front Biosci,2001,6:748-759.
[11] Han Y M,Kang Y K,Koo D B,et al.Nuclear reprogramming of cloned embryos produced in vitro[J].T heriogenology, 2003,59(1):33-44.
[12] Folkersen J,Grudzinskas J G,Hindersson P,et al.Pregnancy-associated plasma protein A:circulating levels during normal pregnancy[J].Am J Obstet Gynecol,1981,139(8):910-914.
[13] Milovanov A P,Boltovskaia M N,Fokina T V,et al.Nondeveloping pregnancy:histological and immunohistochemical markers of endocrine disorders in endometrial scrapes[J]. A rkh Patol,2008,70:22-25.
[14] Overgaard M T,Ox ving C,Christiansen M,et al.Messenger ribonucleic acid levels of pregnancy-associated plasma protein-A and the proform of eosinophil major basic protein:expression in human reproductive and nonreproductive tissues[J]. Biol Reprod,1999,61(4):1083-1089.
[15] Prefumo F,Canini S,Crovo A,et al.Correlation between first trimester fetal bone lenth and maternal serum pregnancyassociated plasma protein-A[J].Hum Reprod,2006,21: 3019-3021.
[16] Humblot P,Camous S,Martal J,et al.Diagnosis of pregnancy by radioimmunoassay of a preg nancy-specific protein in the plasma of dairy cows[J].Theriogenology,1988,30:257-268.
[17] Sasser R G,Ruder C A,Jvani K A,et al.Detection of pregnancy by radioimmunoassay of a novel pregnancy-specific protein in serum of cows and a profile of serum concentrations during gestation[J].Biol Reprod,1986,35:936-942.
[18] Szenci O,T averne MAM,Beckers J F,et al.Evaluation of false ultrasonog raphic diagnoses in cows by measuring plasma levels of bovine pregnancy-associated glycoprotein[J].Vet Rec,1988,142:304-306.
[19] Zoli A P,Guilbault L A,Delahaut P,et al.Radioimmunoassay of a bovine pregnancy-associated gly coprotein in serum: its application for preg nancy diagnosis[J].Biol Reprod,1992, 46:83-92.
[20] Silva E,Sterry R A,Kolb D,et al.Accuracy of a pregnancyassociated glycoprotein ELISA to determine pregnancy status of lactating dairy cows twenty-sever day s after timed artificial insemination[J].J Dairy Sci,2007,90(10):4612-4622.
[21] Gajew ski Z,Melo de Sousa N,Beckers J F,et al.Concentration of bovine pregnancy associated glycoprotein in plasma and milk:its application for pregnancy diagnosis in cows[J]. J Physiol Pharmacol,2008,59(9):55-64.
[22] Green J C,Volkmann D H,Poock S E,et al.T echnical note: A rapid enzyme-linked immunosorbent assay blood test for pregnancy in dairy and beef cattle[J].J Dairy Sci,2009,92 (8):3819-3824.
[23] Patel O V,Sulon J,Becker J F,et al.Plasma bovine pregnancy-associated glycoprotein concentrations throughout gestation in relationship to fetal number in cow[J].Eur J Endocrinol,1997,137:423-428.
[24] Mialon M M,Camous S,Reanand G,et al.Perpheral concentrations of a 600-kDa pregnancy serum protein during gestation and after calving and in relationship to embry onic mortality in cattle[J].Reprod Nutr Dev,1993,33:269-282.
[25] Becker J F,Drion P V,Garbayo J M,et al.Pregnancy-associated glycoproteins in the ruminants:inactive members of the aspartic protease family[J].Acta Vet Hung,1999,47: 461469.
[26] Roberts R M,Xie S,Mathialagan N.Maternal recognition of pregnancy[J].Biol Reprod,1996,54:294-302.
[27] Wooding FBP,Roberts R M,Green J A.Light and electron microscope immunocy tochemical studies of the distribution of pregnancy associated gly proteins(PAGs)throughout pregnancy in the cow:possible functional implications[J].Placenta,2005,26:807-827.
[28] Perenyi Z S,Szenci O,Sulon J,et al.Comparision of the ability of three radioimmunoassay to detect pregnancy-associated gly proteins in bovine plasma[J].Reprod Domest Anim, 2002,27:100-104.
[29] Szenci O,Beckers J F,Sulon J,et al.Effect of induction of late embryonic mortality on plasma profiles of pregnancy associated glyprotein 1 in heifers[J].Vet J,2003,59:1941-1948.

