mTEL-cFms激酶结构域融合蛋白真核表达载体的构建及其对信号转导和转录激活因子核转位的影响
杨胜乾,龙隆,李微,王莉莉
(军事医学科学院毒物药物研究所,北京100850)
mTEL-cFms激酶结构域融合蛋白真核表达载体的构建及其对信号转导和转录激活因子核转位的影响
杨胜乾,龙隆,李微,王莉莉
(军事医学科学院毒物药物研究所,北京100850)
目的构建激酶盘真核表达载体,观察豆蔻酰化的TEL转录调节因子HLH结构域与c-Fms激酶结构域融合蛋白(mTEL-cFmskd)的表达对信号转导和转录激活因子1(STAT1)和STAT3核转位的影响。方法利用DNA重组技术,将人的c-Src豆蔻酰化多肽、TEL转录调节因子HLH结构域、c-Fms激酶结构域以及c-Myc标签的DNA序列克隆在pCORON/neo载体上,构建pCORON/neo-HcSrc-Tel-cfmskd-Myc真核表达载体。将载体转染至稳定表达GFP-STAT1的人骨肉瘤细胞(U2OS)和稳定表达EGFP-STAT3的幼仓鼠肾细胞24 h后,采用IN Cell Analyzer1000获取细胞图像,分析细胞内GFP-STAT1或EGFP-STAT3融合蛋白的核转位程度。结果质粒酶切和测序鉴定表明,构建的pCORON/neo-HcSrc-Tel-cfmskd-Myc真核表达载体序列正确。载体转染细胞24 h后,绿色荧光蛋白标记的STAT1和STAT3均进入细胞核,发生核转位现象。c-Fms激酶抑制剂GW2580和Sutent能抑制mTEL-cFmskd诱导EGFP-STAT3核转位的发生。结论成功构建激酶盘真核表达载体pCORON/neo-HcSrc-Tel-cfmskd-Myc。载体在细胞中表达的mTEL-cFmskd豆蔻酰化融合蛋白具有M-CSF/c-Fms配体受体复合物激活下游信号分子的生物学功能。
巨噬细胞集落刺激因子受体;真核表达载体;TEL;豆蔻酰化;信号转导和转录激活因子;核转位;激酶抑制剂
激酶是细胞内一类最重要的功能蛋白,在细胞信号通路的调节过程中发挥着重要的作用。激酶组学(kinomics)的最新研究表明,人类共有518种激酶[1]。大量研究表明,酪氨酸激酶不仅在细胞之间和细胞内部信号传递、协调细胞分裂等复杂过程发挥着重要的作用,还与癌症、心血管疾病[2]、糖尿病[3]、类风湿性关节炎[4]等疾病也密切相关。以酪氨酸蛋白激酶作为靶标开发新药,已经成为新药研发的热点。目前,以BCR-ABL激酶、表皮生长因子受体(epithelial growth factor receptor,EGFR)酪氨酸激酶、血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)酪氨酸激酶、血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)酪氨酸激酶等为靶标研发的抑制剂,都已发展为成功的上市药物。然而,由于激酶种类繁多,耗时、低效的分子水平激酶抑制剂的筛选方法已经严重制约新的多样化的激酶抑制剂的发现。因此,发展高效的筛选方法具有重要意义。
c-Src蛋白N端的豆蔻酰化多肽,使c-Src蛋白能够锚定在细胞膜上[5]。TEL(转位E26转化特异性白血病,translocation E26 transforming-specific leukemia)是转录调控因子E26转化特异性(E26 transformation-specific,Ets)因子家族成员之一,含有两个功能性的结构域——易于形成二聚化的N端螺旋-环-螺旋结构域(helix-loop-helix domain,HLH结构域)[6]和C端的DNA结合结构域[7-8]。Melnick等[9]构建了一种TEL转录调控因子融合的酪氨酸激酶盘表达载体,转染白介素3(interleukin-3,IL-3)依赖的BaF3细胞后,用于激酶抑制剂的筛选。高内涵筛选(high content screening,HCS)是一种能够进行荧光显微成像和定量图像分析的自动化筛选技术,在保持细胞结构和功能完整性的前提下,能同时检测被筛样品对细胞的形态、生长、周期、分化、迁移、凋亡、代谢途径及信号转导等方面的影响[10]。细胞内荧光标记信号分子的转位分析是高内涵分析细胞信号转导效应的基本功能之一。研究表明,信号转导和转录激活因子(signal transducers and activators of transcription,STATs)是巨噬细胞集落刺激因子受体(macrophage colony-stimulating factor receptor,c-Fms)等受体酪氨酸激酶下游的信号分子,被激酶激活后形成同源或异源二聚体,进入细胞核,发生核转位现象[11]。构建真核表达载体将TEL的HLH结构域与酪氨酸激酶结构域在细胞中融合表达,HLH结构域使激酶结构域二聚化而表现出激酶活性,激活STATs发生核转位,结合高内涵分析技术,不失为一种新的、高效的激酶抑制剂筛选策略。
通过构建激酶盘真核表达载体,将c-Fms激酶结构域与c-Src蛋白的豆蔻酰化肽段、TEL转录调节因子的HLH结构域在细胞内融合表达具有酪氨酸激酶活性的mTEL-cFmskd蛋白。观察mTEL-cFmskd对c-Fms所介导信号通路下游信号分子STAT1和STAT3的激活作用,并探讨c-Fms激酶抑制剂对mTEL-cFmskd诱导STAT3核转位的影响。
1 材料与方法
1.1 质粒、菌株及细胞株
pCORON/neo-EGFPn,pCORON/neo-cfms质粒由本室保存;感受态大肠杆菌(DH5α)购自天根生化科技(北京)有限公司;CHO-K1中国仓鼠卵巢细胞由本室保存,GFP-STAT1_U2OS人骨肉瘤细胞、EGFP-STAT3_BHK幼仓鼠肾细胞购自Thermo(Bio Image)公司。
1.2 试剂
限制性内切酶、Ex Taq酶、dNTPs、T4 DNA连接酶、DNA标志物(Marker)DL2000、DL5000均购自TaKa-Ra公司,KOD plus DNA聚合酶购自Toyobo公司,质粒小量提取试剂盒、凝胶回收试剂盒购自Omega Bio-Tek公司,高糖DMEM培养基、F12培养基、LipofectamineTM2000、Hoechst33342染料购自Invitrogen公司,新霉素(G418)购自Merck公司,胎牛血清购自Hyclone公司。37%甲醛溶液购自西陇化工股份有限公司。
1.3 引物合成与测序
所用到引物的合成及DNA测序由北京三博远志生物技术有限公司和中美泰和生物技术(北京)有限公司完成。
1.4 TEL转录调控因子HLH结构域cDNA序列的设计与合成
根据NCBI序列数据库提供的人ETV6(TEL)cDNA序列(NM_001987.4)获得编码TEL转录调节因子HLH结构域的cDNA序列,长度为930 bp(275~1204 bp)。在HLH结构域的cDNA序列下游,紧接一个多克隆位点(multiple cloning sites,MCS),长度为39 bp。MCS下游,再接一个编码c-Myc标签的DNA序列,长度为30 bp。总长度为999 bp的DNA序列,由中美泰和生物技术(北京)有限公司合成。合成的DNA序列插入pUC19克隆载体EcoRⅠ和XbaⅠ位点,获得pUC19-Tel-Myc质粒载体。
1.5 PCR扩增c-Fms激酶结构域的DNA片段
根据NCBI序列数据库提供的人c-Fms cDNA序列(NM_005211)设计合成引物。上游引物:5'-GAAGAGCTAGCGTACAAGTATAAGCAGAAGCC-3';下游引物:5'-AGTACGGATCCCGCAGAACTGATAGTTGTTGG-3'。以pCORON/neo-cfms质粒为模板,采用KOD plus DNA聚合酶,PCR扩增编码c-Fms激酶结构域的DNA片段。PCR条件:94℃,2 min;94℃,20 s,55℃,20 s,68℃,1 min 30 s,循环30次;68℃,10 min。
1.6 质粒载体的构建
合成编码人c-Src豆蔻酰化多肽的DNA序列HcSrcsense:5'-CTAGCATGGGTAGCAACAAGAGCAAGCCCAAGGATGCCAGCCAGCGGCGCCGCG-3';antisense:5'-AATTCGCGGCGCCGCTGGCTGGCATCCTTGGGCTTGCTC TTGTTGCTACCCATG-3'。将该DNA序列连接到pCORON/neo-EGFPn载体中,经连接产物转化、单克隆菌落PCR及DNA测序鉴定,获得pCORON/neo-HcSrc-EGFPn质粒。用NheⅠ和BamHⅠ分别酶切pUC19-Tel-Myc质粒及编码c-Fms激酶结构域的DNA片段回收产物,再经凝胶电泳回收、T4DNA酶连、连接产物转化、菌落PCR、限制性酶切及测序鉴定,获得pUC19-Tel-cfmskd-Myc质粒。pCORON/neo-HcSrc-EGFPn质粒及pUC19-Telcfmskd-Myc质粒分别经EcoRⅠ和XbaⅠ酶切,经凝胶电泳回收等步骤,获得pCORON/neo-HcSrc-Telcfmskd-Myc-EGFPn质粒。合成含有终止密码子的DNA序列MTAA,sense:5'-CTAGAGTCGACTAAGC-3';antisense:5'-GGCCGCTTAGTCGACT-3'。用XbaⅠ和NotⅠ切除pCORON/neo-HcSrc-Tel-cfmskd-Myc-EGFPn质粒中的EGFP DNA片段,将MTAA序列连接到质粒中,获得pCORON/neo-HcSrc-Telcfmskd-Myc载体。
1.7 细胞培养
CHO-K1细胞用含有10%FBS、青霉素5000 kU·L-1/链霉素5000 kU·L-1的F12培养基,GFPSTAT1_U2OS人骨肉瘤细胞、EGFP-STAT3_BHK幼仓鼠肾细胞用含有10%FBS、G418 500 mg·L-1的高糖DMEM培养基于37℃,5%CO2,80%湿度的培养箱中培养。
1.8 细胞转染
取对数生长期的细胞,制成细胞悬液,将密度调整为1×108L-1。将细胞接种于黑色透底的96孔培养板中,每孔100 μl,使用相应的培养基在37℃,5%CO2,80%湿度条件下培养,待细胞的丰度达到80%~90%后,使用LipofectamineTM2000将质粒载体瞬时转染细胞。首先将待转染的细胞换成无血清无抗生素培养基,于培养箱中孵育1 h。期间制备质粒-脂质体复合物,将0.5 μl LipofectamineTM2000加入到24.5 μl无血清无抗生素培养基中,混匀,室温静置5 min。期间将200 ng的质粒加入到24.5 μl无血清无抗生素培养基中,轻轻混匀。将质粒培养基混合物与静置5 min的LipofectamineTM2000培养基混合物按1∶1混合,轻轻混匀,室温静置20 min。20 min后,将细胞换成新鲜的无血清无抗生素培养基,每孔50 μl。再将制备好的质粒-脂质体复合物加入培养板,每孔50 μl,轻微振板混匀,置于培养箱中。培养6 h后,换成完全培养基每孔100 μl,37℃,5%CO2,80%湿度条件下继续培养。
1.9 细胞形态的观察及分析
采用LipofectamineTM2000将质粒载体瞬时转染细胞24 h后,将细胞用37℃预热PBS 0.01 mol·L-1稀释的8%(V/V)甲醛溶液固定,每孔100 μl,室温避光放置20 min。弃液,加入含有Hoechst33342 1 μmol·L-1染料的PBS 0.01 mol·L-1,每孔200 μl,室温避光放置30 min或4℃放置过夜。IN Cell Analyzer1000获取细胞图像,用细胞膜定位分析模块(Membrane Trafficking Analysis Module)和细胞核转运分析模块分析得到的细胞图像。以绿色荧光蛋白(green fluorescent protein,GFP)膜定位的细胞比率表示豆蔻酰化多肽膜锚定功能的强弱,绿色荧光膜定位的细胞比率=荧光发生膜定位细胞数/表达GFP细胞总数;以转核指数表示绿色荧光的转核程度,转核指数=每孔获得细胞的细胞核平均荧光亮度/细胞质平均荧光亮度。
1.10 c-Fms激酶抑制剂活性的检测
将质粒载体转染细胞,于培养箱中培养12 h后,加入分别含终浓度为0.03和0.3 μmol·L-1的c-Fms抑制剂GW2580或Sutent的完全培养基,培养箱中继续培养12 h后,将细胞固定、Hoechst33342染料处理。IN Cell Analyzer1000获取细胞图像,分析GFP的转核程度。
1.11 统计学分析
2 结果
2.1 c-Src蛋白豆蔻酰化多肽的细胞膜锚定功能验证
将合成的编码人c-Src蛋白豆蔻酰化多肽的DNA序列(图1A),连接到含有增强型绿色荧光蛋白(enhanced GFP,EGFP)的质粒中,构建pCORON/neo-HcSrc-EGFPn真核表达载体(图1B)。通过菌落PCR鉴定,得到含有目标载体的单克隆菌落(图1C)。提取pCORON/neo-HcSrc-EGFPn质粒经测序鉴定后,利用LipofectamineTM2000转染试剂将其转染CHO-K1细胞。载体转染24 h后,甲醛固定细胞并分析细胞内GFP的细胞膜分布情况。结果显示,与转染pCORON/neo-EGFPn载体相比,转染pCORON/neo-HcSrc-EGFPn载体细胞内的绿色荧光,更多地分布在细胞膜上,而不是均匀地分布在细胞内(图2)。转染pCORON/neo-HcSrc-EGFPn载体24 h后,绿色荧光发生膜定位的细胞占表达绿色荧光细胞总数的(88.8±1.3)%,显著高于转染pCORON/neo-EGFPn载体组的(51.2±1.7)%(n=4,P<0.01)。
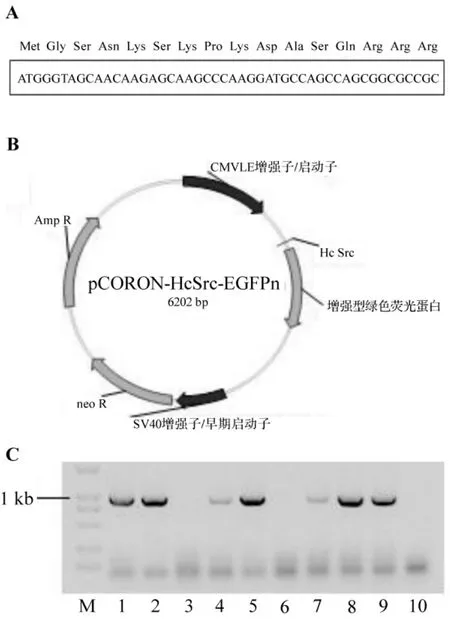
图1 pCORON/neo-HcSrc-EGFPn质粒的构建.A:编码人c-Src蛋白豆蔻酰化多肽的DNA序列HcSrc.B:pCORON/neo-HcSrc-EGFPn质粒.C:单克隆菌落产物(944 bp).M:DL2000标志物;泳道1~10为可能含有pCORON/neo-HcSrc-EGFPn质粒的菌落.Fig.1 Construction of pCORON/neo-HcSrc-EGFPn plasmid.
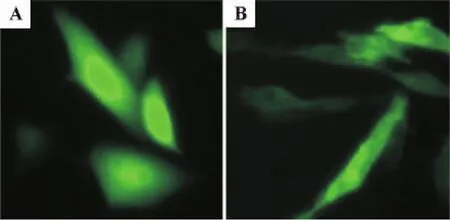
图2 HcSrc融合增强型绿色荧光蛋白(EGFP)的CHO-K1细胞膜定位.pCORON/neo-EGFPn(A)和pCORON/neo-HcSrc-EGFPn(B)质粒转染CHO-K1细胞24 h.Fig.2 Localization of HcSrc-fused enhanced green fluorescent protein(EGFP)on CHO-K1 cell membrane.
2.2 PCR 扩增的c-Fms激酶结构域DNA片段及构建的重组载体
将设计合成编码HLH结构域和c-Myc标签的DNA片段(图3A)连接在pUC19克隆载体上,获得pUC19-Tel-Myc质粒。以含有c-Fms全长cDNA的pCORON/neo-cfms质粒为模板,PCR扩增编码c-Fms激酶结构域的DNA片段。与pUC19-Tel-Myc质粒分别行限制性酶切并回收后,进行琼脂糖凝胶电泳定量(图3B)。经T4 DNA酶联反应、产物转化、富集培养提取质粒,再经限制性酶切鉴定(图3C),获得pUC19-Tel-cfmskd-Myc质粒。
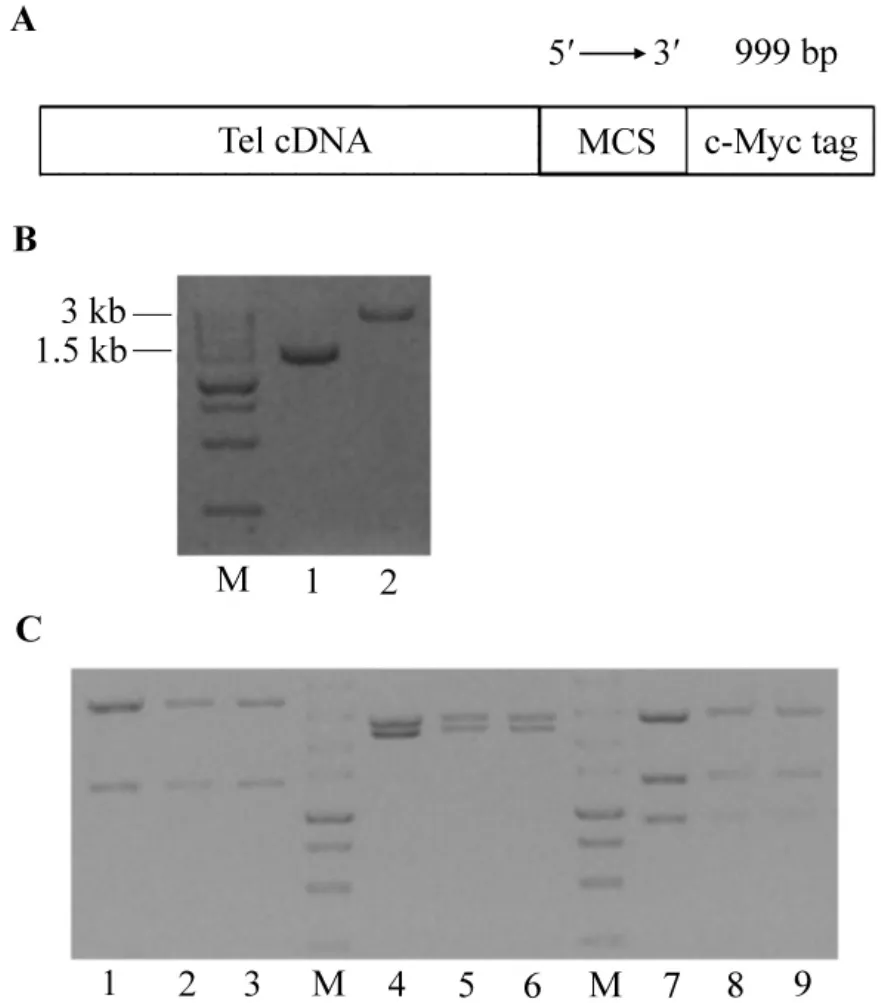
图3 pUC19-Tel-cfmskd-Myc质粒的构建.A.重组Tel cDNA.B.NheⅠ&BamHⅠ酶切的c-fmskd(1)和pUC19-Tel-Myc质粒(2).C.酶切pUC19-Tel-cfmskd-Myc质粒凝胶电泳结果.M:DL5000标志物.泳道1~3:XhoⅠ(3629 bp+1325 bp)酶切质粒;泳道4~6:XbaⅠ+EcoRⅠ(2659 bp+2295 bp)酶切质粒;泳道7~9:HindⅢ+XhoⅠ(2753 bp+1325 bp+876 bp)酶切质粒.Fig.3 Construction of pUC19-Tel-cfmskd-Myc plasmid.
用EcoRⅠ和XbaⅠ酶切pUC19-Tel-cfmskd-Myc质粒,释放出Tel-cfmskd-Myc DNA片段。将该DNA片段连接到pCORON/neo-HcSrc-EGFPn载体上,使得Tel-cfmskd-Myc DNA片段紧接在HcSrc的下游,得到pCORON/neo-HcSrc-Tel-cfmskd-Myc-EGFPn。为了检测载体中插入片段能否完整地在细胞内表达,将pCORON/neo-HcSrc-Tel-cfmskd-Myc-EGFPn载体瞬时转染CHO-K1细胞,观察细胞内GFP的表达情况。结果显示,载体转染细胞24 h后,能在细胞中表达出GFP,且部分GFP定位在细胞膜上(图4C)。说明HcSrc-Tel-cfmskd-Myc-EGFP DNA片段能在细胞中完整的表达。
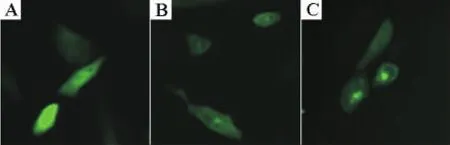
图4 CHO-K1细胞内EGFP的表达.A,B,C分别为转染了pCORON/neo-EGFPn,pCORON/neo-HcSrc-EGFPn和pCORON/neo-HcSrc-Tel-cfmskd-Myc-EGFPn质粒的CHO-K1细胞.Fig.4 Expression of EGFP in CHO-K1 cells.
为使EGFP不影响c-Fms激酶结构域的活性,用XbaⅠ和NotⅠ限制性内切酶切除pCORON/neo-HcSrc-Tel-cfmskd-Myc-EGFPn载体中的EGFP DNA片段,同时在c-Myc标签DNA序列下游插入含有终止密码子的MTAA序列,得到pCORON/neo-HcSrc-Tel-cfmskd-Myc载体(图5)。
2.3 mTEL-cFmskd对STAT1/3核转位的影响
分别将pCORON/neo-HcSrc-Tel-cfmskd-Myc载体转染GFP-STAT1_U2OS细胞和EGFP-STAT3_BHK细胞,使mTEL-cFmskd在细胞中表达。转染24 h后,检测细胞中绿色荧光的核转位程度。实验结果显示,与转染试剂对照组相比,转染pCORON/neo-HcSrc-Tel-cfmskd-Myc载体细胞组中的GFP进入细胞核,发生了明显的核转位现象。由于转染pCORON/neo-cfms载体的细胞中瞬时表达大量的c-Fms受体激酶,受体激酶彼此靠近活化激酶结构域,激活下游的信号分子STAT1和STAT3,导致绿色荧光标记的STAT1和STAT3进入细胞核,发生核转位,但程度明显低于表达mTEL-cFmskd的细胞组(表1,图6)。
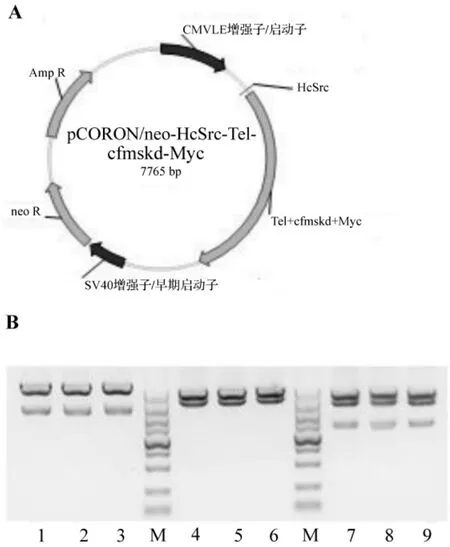
图5 pCORON/neo-HcSrc-Tel-cfmskd-Myc质粒的构建.A:pCORON/neo-HcSrc-Tel-cfmskd-Myc质粒图.B:M:DL5000标志物;泳道1~3:EcoRⅠ+NotⅠ(5457 bp+2311 bp)酶切质粒;泳道4~6:EcoRⅠ+KpnⅠ(4560 bp+3208 bp)酶切质粒;泳道7~9:XbaⅠ+HindⅢ(3815 bp+2678 bp+1275 bp)酶切质粒.Fig.5 Construction of pCORON/neo-HcSrc-Tel-cfmskd-Myc plasmid.
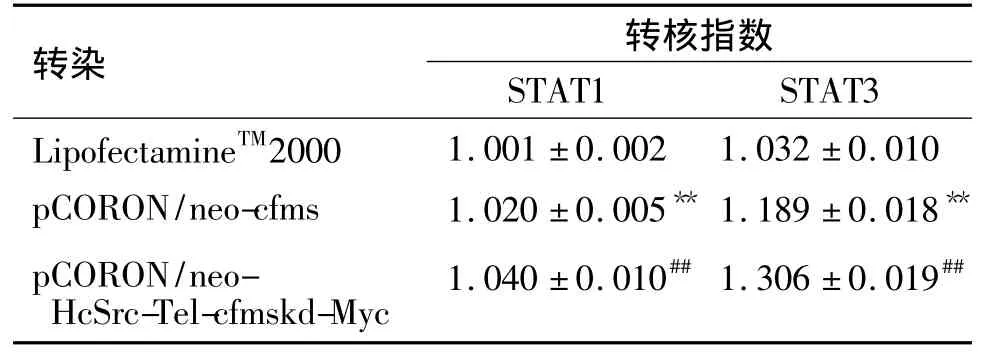
表1 转染pCORON/neo-HcSrc-Tel-cfmskd-Myc载体对信号转导和转录激活因子1(STAT1)和-STAT3核转位的影响Tab.1 Effect of pCORON/neo-HcSrc-Tel-cfmskd-Myc transfection on signal transducers and activators of transcription(STAT)1 and STAT3 nuclear translocation in GFP-STAT1_U2OS and EGFP-STAT3_BHK cells
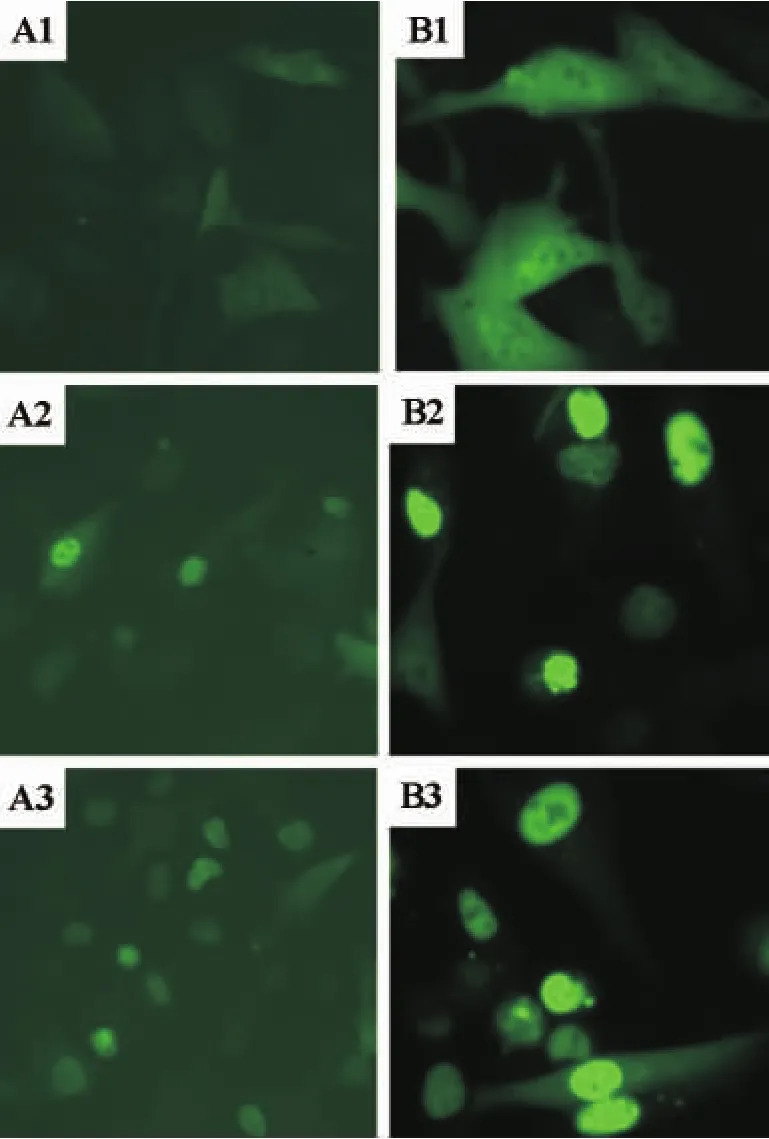
图6 mTEL-cFmskd融合蛋白诱导STAT1和STAT3发生核转位.见图1处理.A:GFP-STAT1_U2OS;B:EGFP-STAT3_BHK;1:LipofectamineTM2000;2:pCORON/neo-cfms质粒;3:pCORON/neo-HcSrc-Tel-cfmskd-Myc质粒.Fig.7 STAT1 and STAT3 nuclear translocation induced by mTEL-cFmskd.
2.4 c-Fms激酶抑制剂对mTEL-cFmskd诱导的STAT3核转位的影响
表2结果显示,与未转染无药物处理组相比,转染组转核指数明显增加(P<0.01),说明mTEL-cFmskd融合蛋白可显著诱导STAT3发生核转位。与转染无药物处理组相比,加入GW2580或Sutent 0.3 μmol·L-1可有效抑制mTEL-cFmskd诱导STAT3发生核转位,但浓度为0.03 μmol·L-1时,两药均无抑制作用。
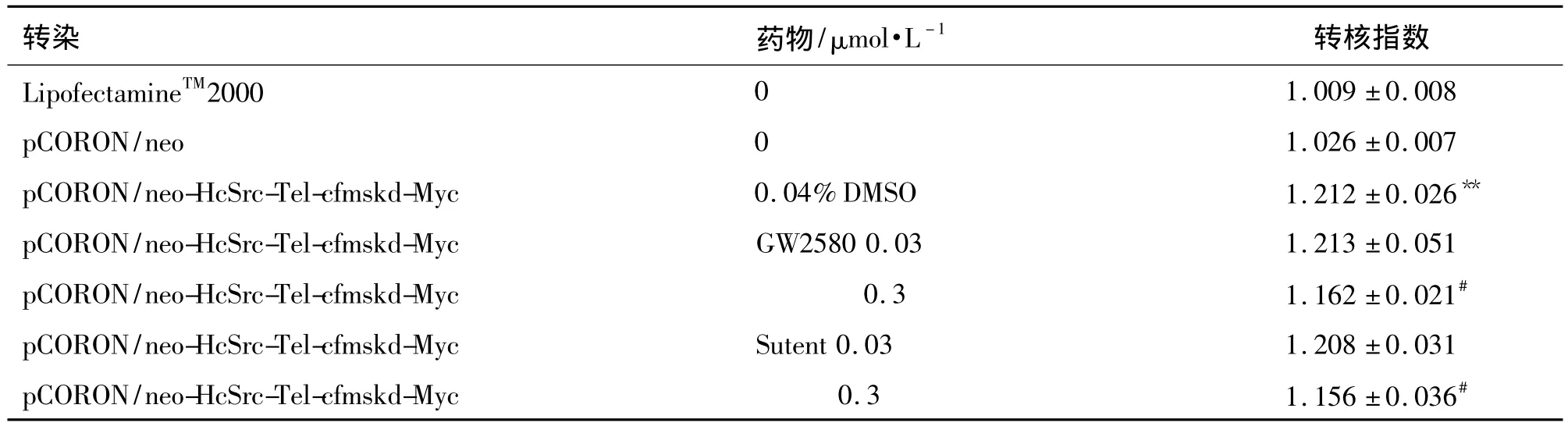
表2 c-Fms激酶抑制剂对mTEL-cFmskd诱导的STAT3核转位的影响Tab.2 Effect of c-Fms inhibitors on STAT3 nuclear translocation induced by mTEL-cFmskd
3 讨论
本实验所构建激酶盘真核表达载体在细胞内表达的mTEL-cFmskd豆蔻酰化融合蛋白包括4个部分:HcSrc豆蔻酰化多肽、TEL转录调节因子HLH结构域、c-Fms激酶结构域和c-Myc免疫印迹标签,分别具有锚定细胞膜、二聚化、酪氨酸激酶活性等功能。在c-Src蛋白的生物合成过程中,N端的甲硫氨酸被切除,导致紧接着的甘氨酸残基与豆蔻酰辅酶A(myristoyl-CoA)反应,结果在甘氨酸残基上添加了一个具有十四碳链的豆蔻酰基团[5]。具有豆蔻酰基团的c-Src蛋白能够锚定在细胞膜上,而以甘氨酸残基开始的7个氨基酸残基是豆蔻酰基团形成所必须的[12]。TEL是Ets转录因子家族的成员,含有保守的DNA结合结构域和HLH结构域,而HLH结构域易发生二聚化[13]。HLH结构域的二聚化使两个c-Fms激酶结构域相互靠近,催化结构域内部的酪氨酸残基磷酸化,活化激酶活性,进而通过转磷酸作用,激活下游的信号分子。STATs家族分子是酪氨酸受体激酶下游的主要信号分子,主要参与细胞JAK-STAT信号转导系统的信号传递过程,被激活后发生核转位现象。STATs的核转位程度,直接反映了上游特定激酶或者受体的活性。文献报道表明,除包括c-Fms[14]、EGFR[15-16]、成纤维细胞生长因子受体、胰岛素样生长因子1受体、VEGFR、PDGFR[17]、干细胞生长因子受体[18]等酪氨酸蛋白激酶受体超家族成员外,IL-2R,IL-3R等其他细胞因子受体也直接或通过SRC[19],JAKs[20]间接地激活STATs,诱导其发生核转位现象。这提示,本实验建立的激酶盘真核表达载体有广泛的实用性。
本实验利用DNA重组技术,将人c-Src豆蔻酰化多肽、TEL蛋白的HLH结构域、c-Fms激酶结构域、c-Myc标签以及EGFP的DNA序列克隆到载体上,构建了pCORON/neo-HcSrc-Tel-cfmskd-Myc-EGFPn真核表达载体,并通过脂质体瞬时转染的方法将其转染CHO-K1仓鼠卵巢细胞,结果表明该载体能够在细胞中表达出GFP。说明HcSrc-Tel-cfmskd DNA片段没有发生移码突变,可以表达完整的mTEL-cFmskd融合蛋白。用限制性内切酶切除载体中的EGFP DNA序列,通过添加终止密码子,成功获得pCORON/neo-HcSrc-Tel-cfmskd-Myc载体。转染了此载体的GFP-STAT1_U2OS人骨肉瘤细胞和EGFP-STAT3_BHK幼仓鼠肾细胞中发生GFPSTAT1和EGFP-STAT3核转位;c-Fms激酶抑制剂能有效抑制mTEL-cFmskd诱导EGFP-STAT3核转位的发生。说明激酶盘真核载体表达的mTEL-cFmskd具有M-CSF/c-Fms配体受体复合物的生物学作用。然而,载体构建过程中酶切位点的局限性和载体转染细胞方式的低效率将是我们亟需解决的问题。分选获得稳定表达mTEL-cFmskd的EGFPSTAT3_BHK单克隆细胞株,可能更有利于建立可靠的细胞模型。
综上所述,成功构建pCORON/neo-HcSrc-Telcfmskd-Myc真核表达载体,转染细胞后表达的mTEL-cFmskd能诱导STATs转位,具有M-CSF/c-Fms配体受体复合物激活下游信号分子的生物学功能。该体系为快速建立种类齐全的激酶抑制剂筛选模型提供了一种可靠的通用模式,结合高内涵分析技术,可能成为激酶抑制剂筛选的高效方法。
[1]Netterwald J.Kinomics:the new star[J].Drug Discov Dev,2007,10(7):22-25.
[2]Chappell JC,Bautch VL.Vascular development:genetic mechanisms and links to vascular disease[J].Curr Top Dev Biol,2010,90:43-72.
[3]Matrougui K.Diabetes and microvascular pathophysiology:role of epidermal growth factor receptor tyrosine kinase[J].Diabetes Metab Res Rev,2010,26(1):13-16.
[4]D'Aura Swanson C,Paniagua RT,Lindstrom TM,Robinson WH.Tyrosine kinases as targets for the treatment of rheumatoid arthritis[J].Nat Rev Rheumatol,2009,5(6):317-324.
[5]Brown MT,Cooper JA.Regulation,substrates and functions of src[J].Biochim Biophys Acta,1996,1287(2-3):121-149.
[6]Golub TR,Barker GF,Lovett M,Gilliland DG.Fusion of PDGF receptor beta to a novel ets-like gene,tel,in chronic myelomonocytic leukemia with t(5;12)chromosomal translocation[J].Cell,1994,77(2):307-316.
[7]Szymczyna BR,Arrowsmith CH.DNA binding specificity studies of four ETS proteins support an indirect readout mechanism of protein-DNA recognition[J].J Biol Chem,2000,275(37):28363-28370.
[8]Poirel H,Oury C,Carron C,Duprez E,Laabi Y,Tsapis A,et al.The TEL gene products:nuclear phosphoproteins with DNA binding properties[J].Oncogene,1997,14(3):349-357.
[9]Melnick JS,Janes J,Kim S,Chang JY,Sipes DG,Gunderson D,et al.An efficient rapid system for profiling the cellular activities of molecular libraries[J].Proc Natl Acad Sci USA,2006,103(9):3153-3158.
[10]Bickle M.The beautiful cell:high-content screening in drug discovery[J].Anal Bioanal Chem,2010,398(1):219-226.
[11]Leonard WJ,O'Shea JJ.Jaks and STATs:biological implications[J].Annu Rev Immunol,1998,16:293-322.
[12]Schultz AM,Henderson LE,Oroszlan S,Garber EA,Hanafusa H.Amino terminal myristylation of the protein kinase p60src,a retroviral transforming protein[J].Science,1985,227(4685):427-429.
[13]Golub TR,Goga A,Barker GF,Afar DE,McLaughlin J,Bohlander SK,et al.Oligomerization of the ABL tyrosine kinase by the Ets protein TEL in human leukemia[J].Mol Cell Biol,1996,16(8):4107-4116.
[14]Hamilton JA.CSF-1 and cell cycle control in macrophages[J].Mol Reprod Dev,1997,46(1):19-23.
[15]Vasilenko KP,Grudinkin PS,Arnautov AM,Burova EB,Nikol'skiǐ NN.Dynamics of the interaction of Stat1 transcription factor with the internalized EGF receptor and karyopherins alpha in response to stimulation of cells with epidermal growth factor[J].Tsitologiia,2001,43(2):204-211.
[16]Shi CS,Kehrl JH.Pyk2 amplifies epidermal growth factor and c-Src-induced Stat3 activation[J].J Biol Chem,2004,279(17):17224-17231.
[17]Vignais ML,Gilman M.Distinct mechanisms of activation of Stat1 and Stat3 by platelet-derived growth factor receptor in a cell-free system[J].Mol Cell Biol,1999,19(5):3727-3735.
[18]Linnekin D.Early signaling pathways activated by c-Kit in hematopoietic cells[J].Int J Biochem Cell Biol,1999,31(10):1053-1074.
[19]Cirri P,Chiarugi P,Marra F,Raugei G,Camici G,Manao G,et al.c-Src activates both STAT1 and STAT3 in PDGF-stimulated NIH3T3 cells[J].Biochem Biophys Res Commun,1997,239(2):493-497.
[20]Yamaoka K,Saharinen P,Pesu M,Holt VE 3rd,Silvennoinen O,O'Shea JJ.The Janus kinases(Jaks)[J].Genome Biol,2004,5(12):253.
Establishment of mTEL-cFmskd eukaryotic expression vector and its effect on STAT1/3 nuclear translocation
YANG Sheng-qian,LONG Long,LI Wei,WANG Li-li
(Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing100850,China)
OBJECTIVETo construct a eukaryotic expression vector of mTEL-cFmskd and study its effect on nuclear translocation of the signal transducer and activator of transcription 1/3(STAT1/3).METHODSBy recombinant DNA technology,the DNA sequence of polypeptide for myristoylation of human c-Src,helix-loop-helix domain of human TEL,kinase domain of macrophage colony-stimulating factor receptor and c-Myc tag were inserted into pCORON/neo plasmid to generate pCORON/neo-HcSrc-Tel-cfmskd-Myc eukaryotic expression vector.The mTEL-cFmskd expression vector pCORON/neo-HcSrc-Tel-cfmskd-Myc and the c-Fms expression vector pCORON/neo-cfms were transfected into U2OS(expressing GFP-STAT1)and BHK(expressing EGFPSTAT3)cells.After 24 h,the cells were fixed,stained and then imaged on the IN Cell Analyzer 1000.The image was analyzed using the Nuclear Trafficking Analysis Module.RESULTSRestriction enzyme digestion and plasmid sequencing confirmed the successful construction of pCORON/neo-HcSrc-Tel-cfmskd-Myc plasmid.mTEL-cFmskd was expressed in cells,and caused nuclear translocation of GFP-STAT1 and EGFP-STAT3 24 h after transfection.c-Fms inhibitors GW2580 and Sutent could block the nuclear translocation of EGFP-STAT3 by mTEL-cFmskd.CONCLUSIONmTEL-cFmskd expression vector pCORON/neo-HcSrc-Tel-cfmskd-Myc is successfully constructed and functional mTEL-cFmskd is expressed in GFP-STAT1_U2OS and EGFPSTAT3_BHK cells.
macrophage colony-stimulating factor receptor;TEL;myristoylation;STATs;nuclear translocation;kinase inhibitors
The project supported by National Mega-project of Science Research of China(2009ZX09501-031)
WANG Li-li,E-mail:wangll63@yahoo.com.cn,Tel:(010)66874603
R966,Q81
A
1000-3002(2011)05-0456-07
10.3867/j.issn.1000-3002.2011.05.008
(来稿日期:2011-04-28接受日期:2011-08-24)
(本文编辑:乔虹)

