气流式微注射器萃取技术与GC-MS联用直接分析不同植物叶片中痕量的多环芳烃
汪浩, 宋玉梅, 耿仁杰
(长白山生物资源与功能分子教育部重点实验室(延边大学),吉林延吉133002)
气流式微注射器萃取技术与GC-MS联用直接分析不同植物叶片中痕量的多环芳烃
汪浩, 宋玉梅, 耿仁杰
(长白山生物资源与功能分子教育部重点实验室(延边大学),吉林延吉133002)
为实现植物样品中痕量多环芳烃(PAHs)的简单、快速、准确、高效分析,利用气流式微注射器萃取技术(GP-MSE)结合 GC-MS检测植物(落叶松、旱柳和侧柏)叶片中的PAHs,通过加标回收率评价了方法的准确性,并通过定量离子色谱图分析了目标物的定量干扰.结果显示:供试6种 PAHs的方法回收率分别为60.81%~119.83%,69.26%~116.68%和62.82%~104.71%;相对标准偏差(RSD)分别为0.92%~16.56%,6.71%~12.34%,3.57%~14.06%.定量离子色谱图的分析表明,该方法不需采用其他净化技术,6种PAHs分离效果好,定量离子基质干扰少,可用于植物叶片中PAHs的检测分析.
微萃取;气流式;多环芳烃;GC-MS;植物叶片
0 引言
多环芳烃除了某些天然源外,(Polycyclic aromatic hydrocarbons,PAHs)主要来自各种化石燃料如煤炭、石油等的不完全燃烧[1-3],是广泛分
布于全球环境中的痕量有毒有机污染物,其毒性主要体现在对生物体的强烈致癌致畸变作用[4],是近年来环境科学研究领域中的持续热点之一[5].环境中的 PAHs可被植物吸收,因此多种植物被用于多环芳烃的污染特征研究[6-7],大量研究表明,植物叶片中多环芳烃的积累与分布特征与大气中的多环芳烃有一定的相关关系.
目前植物中 PA Hs的常用提取技术有索氏提取、超声萃取、超临界流体萃取和微波辅助萃取[8],以上提取技术均存在提取时间较长,操作相对较繁琐,溶剂用量大等缺点,且由于植物叶片基质复杂,腊质含量较高,在进行 PAHs分析时,共萃取物往往需进行净化分离(如柱层析净化)来满足仪器分析的需要[9].气流式微注射器萃取技术是一种新型的样品前处理方法[7],集萃取、净化和浓缩于一体,可用于挥发性和半挥发性目标物的快速分离与富集.本研究采用气流式微注射器萃取技术直接萃取落叶松、旱柳和侧柏叶片中的痕量多环芳烃,并结合 GC-MS进行分离检测,探讨基于该技术建立的分析方法在不同植物叶片中痕量多环芳烃分析上的应用效果.
1 材料与方法
1.1 试剂与仪器
正已烷,丙酮,均为色谱纯,购买于加拿大Caledon公司;多环芳烃标准品(2-甲基萘,1-甲基萘 ,苊 ,二氢苊 ,芴 ,菲)和[2H10]菲标准品 ,纯度均高于99%,购自于美国 Supelco公司;氮气,纯度为99.999%.
研磨机,100μL微注射器,气体流量控制器,冷凝器,加热器,日本岛津 GC MS-QP2010p lus气相色谱与质谱联用仪.
1.2 样品采集和预处理
1.2.1 植物叶片对照样品 分别采集落叶松(Larixgmelinii)、旱 柳 (Salixmatsudana koidz)和侧柏(Platycladusorientalis(L.)franco)叶作为供试植物样品.样品采集后用蒸馏水充分漂洗,滤纸蘸干表面水分后自然风干;用研磨机粉碎样品,混匀后作为对照样品.
1.2.2 植物叶片加标样品 取上述样品,分别加入一定量的 PA Hs混合标准溶液(用正已烷稀释配制),挥干溶剂后,充分摇匀,制得植物叶的PAHs加标样品,用于分析植物叶片中 PA Hs的方法回收率.
1.3 样品萃取
植物样品的气流式微注射器萃取装置按文献[7]方法组装.具体的萃取过程为:准确称取0.020 0 g经预处理的植物样品填装入样品池中,然后将样品池置于加热装置中,并用隔垫密封样品池口;将100μL微注射器经冷凝装置垂直插入样品池中,至隔垫下适当位置;设置样品池温度为280℃,冷凝温度为-4℃,气流吹扫速率为1 mL/min;在微注射器中加入含2 ng/μL[2H10]菲(作为仪器内标)的有机萃取溶剂(体积比为1∶1的丙酮和正已烷混合溶液)10μL,开始萃取,萃取时间为2 min.萃取结束后,取下微注射器,用于GC-MS进样分析.
1.4 色谱分析
毛细管色谱柱为DB-5MS(30 m×0.32 mm×0.25μm),载气流速为1 m L/m in,进样口温度为280℃,分流进样与分流比为24∶1.采用程序升温,起始温度为80℃,保留1m in,20℃/m in升温至100℃,10℃/min升温至200℃,20℃/min升温至280℃,保留20 min.离子源为电子轰击源,离子源温度为200℃.以SIM模式扫描并进行样品的定性与定量.
2 结果与讨论
为了评价分析方法的准确度,按照前述植物样品的前处理方法和分析条件分别分析对照样品和加标样品.PAHs的加标回收率的计算方式为:
式中A表示峰面积.
表1给出了落叶松、旱柳和侧柏叶中 PA Hs的加标回收率.3种植物叶中供试6种PA Hs的加标回收率分别为60.81%~119.83%,69.26%~116.68%和62.82%~104.71%;相对标准偏差分别为0.92%~16.56%,6.71%~12.34%,3.57%~14.06%.这表明,对于不同植物叶片,本方法均能达到较满意的回收率.另外,本方法的萃取时间只有几分钟,单个样品处理的溶剂用量也只有微升级,与索氏提取、超声萃取等方法相比,节约了分析成本,提高了工作效率.
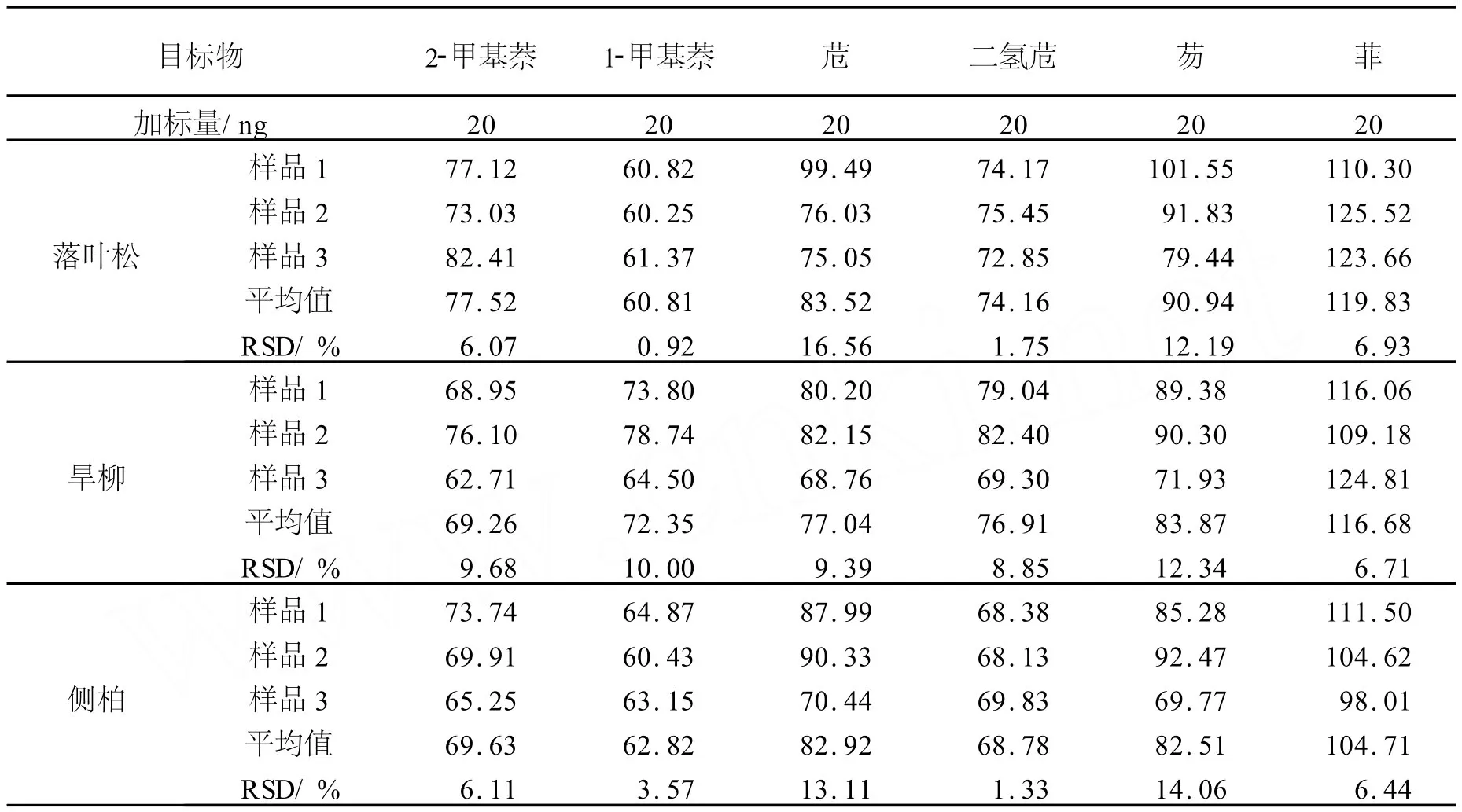
表1 植物样品中PAHs的加标回收率 %
图1为落叶松、旱柳和侧柏3种植物的加标样品中各PAHs的定量离子色谱图.从图中可以看出,不同植物基质对目标物的定量干扰小,目标物分离效果好,这表明运用选择性离子模式能够提供较好的定量结果.

图1 植物叶片加标样品PAHs的定量离子色谱图
3 结论
本文通过气流式微注射器萃取(GP-MSE)的前处理方法结合 GC-MS分析了落叶松、旱柳和侧柏3种植物叶片中痕量的 PA Hs本文方法具有操作简单、省时、回收率较高、重复性较好的优点.植物样品中供试6种PA Hs的加标回收率范围为60.81%~119.83%,相对标准偏差均小于20%,该方法可用于植物叶片的PAHs检测分析.
[1]Mark B Y,Robie W M,Roxanne V,et al.PAHs in the Fraser River Basin:a Critical App raisal of PAH Ratios as Indicatorsof PAH Source and Composition[J].O rganic Geochemistry,2002,33:489-515.
[2]于国光,王铁冠,朱先磊,等.北京市西北郊大气气溶胶中多环芳烃的源解析[J].环境化学,2008,27(2):245-250.
[3]Ma W L,Li Y F,Qi H,et al.Seasonal Variations of Sources of Polycyclic A romatic Hydrocarbons(PAHs)to a Northeastern U rban City,China[J].Chemosphere,2010,79:441-447.
[4]Menzie C A,Potoki B B,Santodonato J.Exposure to Carcinogenic PAHs in the Environment[J].Environment Science and Technology,1992,26(7):1278-1284.
[5]汤莉莉,牛生杰,朱永官,等.北京市部分地区土壤和植物中多环芳烃的分布[J].南京气象学院学报,2006,29(6):750-755.
[6]Prajapati S K,Tripathi B D.Biomonito ring Seasonal Variation of U rban Air Polycyclic A romatic Hydrocarbons(PA Hs)U sing Ficus benghalensis leaves[J].Environmental Pollution,2008,151:543-548.
[7]Wang Y Q,Tao S,Jiao X C.et al.Polycyclic A romatic Hydrocarbons in Leaf Cuticles and Inner Tissues of Six Species of Trees in U rban Beijing[J].Environmental Pollution,2008,151:158-164.
[8]何燕,冯琳.多环芳烃的样品前处理技术研究进展[J].重庆师范大学学报:自然科学版,2007,24(3):64-68.
[9]Meudec A,Dussauze J,Jourdin M,et al.Gas Chromatographic-Mass Spectrometric Method fo r Polycyclic A romatic Hydrocarbon Analysis in Plant Bio ta[J].Journal of Chromatography A,2006,1108:240-247.
[10]Yang Cui,Piao Xianfan,Qiu Jinxue,et al.Gas Purge Microsyringe Extraction fo r Quantitative Direct Gas Chromatographic-Mass Spectrometric Analysis of Volatile and Semivolatile Chemicals[J].Journal of Chromatography A,2011,1218:1549-1555.
Gas Purge Microsyringe Extraction Combined with Gas Chromatographic-Mass Spectrometric Directly Analysis of Polycyclic Aromatic Hydrocarbons in Plant Leaves
WANG Hao, SONG Yu-mei, GENG Ren-jie
(KeyLaboratoryofNaturalResourcesoftheChangbaiMountain&FunctionalMolecules(YanbianUniversity),MinistryofEducation,Yanji133002,China)
To achieve a simp le,rapid,accurate and efficient analysis of PAHs in p lant samp les,the gas purge microsyringe extraction(GP-MSE)combined with GC-MS isapp lied to determination of PAHs for plant leaves(Larixgmelinii,Salixmatsudanakoidz,Platycladusorientalis(L.)franco).The accuracy of thismethod is evaluated by spiked recoveries.The quantitative interferencesof targets also are analyzed by quantitative ion chromatograms.The results sho wthat the recoveries of six PAHs fo r plant leaves are 60.81%-119.83%,69.26%-116.68%and 62.82%-104.71%, with relative standard deviations(RSD)0.92%-16.56%,6.71%-12.34%,3.57%-14.06%,respectively.The quantitative analysisof ion chromatograms further indicates that the separation effect of six PAHs is good and has little matrix interferences without any clean-up course.Therefo re,it can be used fo r the determination of PAHs in plant leaves.
microextraction;gas purge;PAHs;GC-MS;p lant leaf
O656.31
A
1004-4353(2011)02-0132-04
2011-03-11
吉林省科技发展计划重点项目(20100340)
汪浩(1989—),女,硕士研究生,研究方向为有机分析研究.

