负载型铁催化剂的制备及其在2,4,6-三甲基苯甲酸合成中的应用
李 华,周鹏松,金 曼,田 晏
(1.中国石油锦州石化公司,锦州121001;2.东北化工销售公司辽西分公司)
1 前 言
2,4,6-三甲基苯甲酸作为一种化工中间体,具有广泛的用途。早期的合成方法研究中,由于采用的原料比较特殊,不适合工业化生产。近年来随着均三甲苯的生产规模不断扩大,以均三甲苯为原料的合成方法逐渐得到推广和应用。这些方法主要包括格林试剂法[1-3]、均三甲苯酰化法[4-5]、2,4,6-三甲基苯甲醛氧化法[6]、二氧化碳直接羧化芳烃法[7-9]等,其中均三甲苯酰化法中的氯乙酰氯酰化法[10]比较具有代表性。在传统的酰基化反应过程中,由于AlCl3催化活性较高,因此大多采用AlCl3作为催化剂,但AlCl3用量大,且易于水解,不仅造成产物分离困难,还存在再生困难、环境污染等问题,所以开发环境友好的催化剂尤为必要。本研究制备了负载型铁催化剂,并讨论其在2,4,6-三甲基苯甲酸合成中的应用情况。
2 实 验
2.1 仪器与原料
仪器:DZTW型调温电热套;JJ-1型精密增力电动搅拌器;DZF-6020型真空干燥箱;马福炉;Nicolet-460FTIR红外光谱仪和400MHz AR×400型核磁共振仪(用来确定酰基化反应产物α-氯代-2,4,6-三甲基苯乙酮的生成);810系列高效液相色谱仪(用于α-氯代-2,4,6-三甲基苯乙酮的纯度分析),色谱柱为Kromasil Ods(4.6mm×150mm),流动相为乙腈-水(体积比为80/10),流速0.8mL/min,柱温45℃,检测器波长240nm。
原料:均三甲苯;氯乙酰氯;SiO2;硅藻土;ZrO2;Cr2O3;Al2O3;FeCl3;AlCl3。
2.2 负载型铁催化剂的制备
将载体干燥脱水后放入干燥器中待用;配置一定浓度的FeCl3溶液,测定其金属离子浓度;将一定质量的干燥载体置于溶液中浸渍,为了准确控制铁负载量,对溶液中金属离子浓度进行跟踪分析,达到实验要求后进行过滤,并测定溶液中的金属离子浓度,计算出铁负载量;将浸渍后的载体放入鼓风干燥箱中干燥,然后置于高温马福炉中焙烧;温度降至室温后,用蒸馏水洗涤,再放入鼓风干燥箱中干燥,最后置于干燥器中备用。
2.3 α-氯代-2,4,6-三甲基苯乙酮的合成
在装有电动搅拌装置、恒压滴液漏斗和球形冷凝管(上口装有氯化钙干燥管)的250mL三口烧瓶内加入干燥的催化剂和均三甲苯;升温至反应温度后滴加氯乙酰氯,并在保持温度恒定的条件下反应一定时间;反应结束后,将上述生成物倒入烧杯中,置于冰浴中结晶,得到α-氯代-2,4,6-三甲基苯乙酮粗产品;重结晶后得到高纯度α-氯代2,4,6-三甲基苯乙酮。
3 结果与讨论
通过实验考察催化剂载体、铁负载量、活化温度对均三甲苯酰基化反应的影响,根据反应中间产物α-氯代-2,4,6-三甲基苯乙酮产率筛选出最优的催化剂载体和催化剂制备条件,其中α-氯代-2,4,6-三甲基苯乙酮的产率为实验中实际酮产量与理论酮产量的比值。
3.1 载体对α-氯代-2,4,6-三甲基苯乙酮产率的影响
SiO2、硅藻土、ZrO2、Cr2O3、Al2O3是常用的催化剂载体。在均三甲苯与氯乙酰氯摩尔比1∶2、反应时间4h、反应温度80℃、催化剂用量为均三甲苯质量的0.25%的条件下,使用SiO2、硅藻土、ZrO2、Cr2O3、Al2O3载体制备的催化剂得到的酰基化反应中间体α-氯代-2,4,6-三甲基苯乙酮产率分别为55%,45%,30%,38%,80%,以Al2O3为载体的催化剂活性最高,因此本研究以Al2O3为载体进行催化剂的活性研究。
3.2 铁负载量对α-氯代-2,4,6-三甲基苯乙酮产率的影响
在均三甲苯与氯乙酰氯摩尔比1∶2、反应时间4h、反应温度80℃的条件下,催化剂铁负载量与酰基化反应中间体α-氯代-2,4,6-三甲基苯乙酮产率的关系见图1。从图1可以看出,当铁负载量小于20%时,催化剂活性随铁负载量的增加而增加,当铁负载量大于20%时,催化剂活性随铁负载量的增加而降低。这是由于铁负载量低时分散性较好,随铁负载量的增加活性位增多,从而使反应活性增加;当铁负载量继续增大时则铁的分散度下降,造成活性降低。最优的铁负载量为20%。
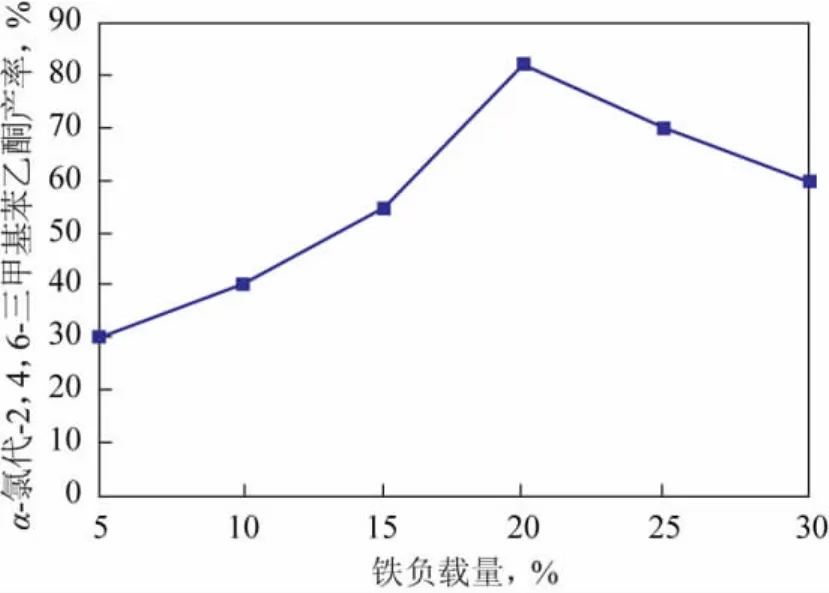
图1 催化剂铁负载量与α-氯代-2,4,6-三甲基苯乙酮产率的关系
3.3 催化剂活化温度对α-氯代-2,4,6-三甲基苯乙酮产率的影响
在均三甲苯和氯乙酰氯摩尔比1∶2、反应时间4h、反应温度80℃、催化剂用量为均三甲苯质量0.25%的条件下,催化剂活化温度与酰基化反应中间体α-氯代-2,4,6-三甲基苯乙酮产率的关系见图2。从图2可以看出,催化剂活化温度低于400℃时,随着催化剂活化温度的提高,酰基化反应中间体α-氯代-2,4,6-三甲基苯乙酮产率逐渐提高,这主要是因为随着活化温度的升高,催化剂的活化分子数不断增加;当催化剂活化温度超过400℃时,随活化温度的升高,α-氯代-2,4,6-三甲基苯乙酮产率逐渐降低,这是因为随着活化温度的升高,催化剂与载体发生强相互作用形成新的形态结构从而导致催化剂活性下降。催化剂的最优活化温度为400℃。
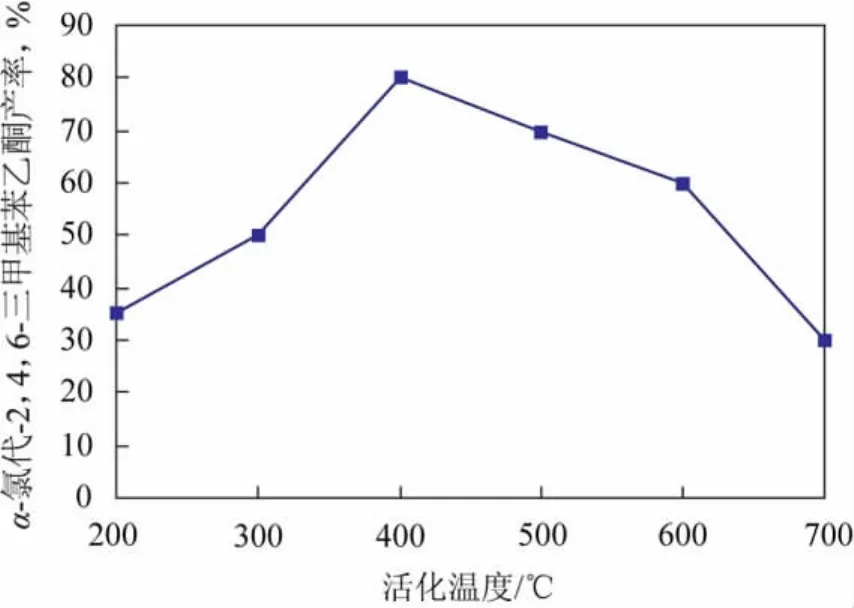
图2 催化剂活化温度与α-氯代-2,4,6-三甲基苯乙酮产率的关系
3.4 催化剂用量对α-氯代-2,4,6-三甲基苯乙酮产率的影响
在均三甲苯和氯乙酰氯摩尔比1∶2、反应时间4h、反应温度80℃的条件下,催化剂用量对酰基化反应中间体α-氯代-2,4,6-三甲基苯乙酮产率的影响见图3,其中催化剂用量为相对于均三甲苯的质量比。由图3可以看出,随着催化剂用量的增加,α-氯代-2,4,6-三甲基苯乙酮产率逐渐增加,当催化剂用量大于0.25%时,α-氯代-2,4,6-三甲基苯乙酮产率增加不明显。因此,选择催化剂相对质量比为0.20%,0.25%,0.30%做正交实验。
3.5 反应条件的正交实验
采用均三甲苯与氯乙酰氯摩尔比、催化剂相对用量、反应温度、反应时间四个因素,每个因素三个条件为设计标准进行正交实验,四个因素及其各自的三个条件见表1,正交实验方案和结果见表2。表2中Ki为其所在列因素第i个条件所对应的三组α-氯代-2,4,6-三甲基苯乙酮产率之和;ki为其所在列因素第i个条件对应的三组α-氯代-2,4,6-三甲基苯乙酮产率的平均值,ki=Ki/3;R为所在列因素的最大与最小α-氯代-2,4,6-三甲基苯乙酮产率之差,R=max(k)-min(k),R数值大表示所在列因素对α-氯代-2,4,6-三甲基苯乙酮产率的影响大。
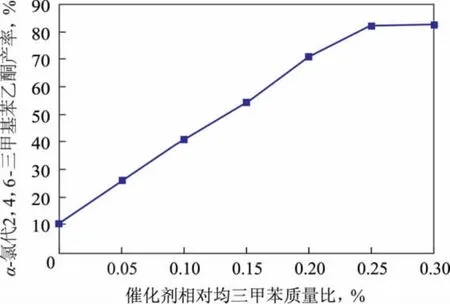
图3 催化剂用量与α-氯代-2,4,6-三甲基苯乙酮产率的关系

表1 正交实验四因素及其各自的三个条件
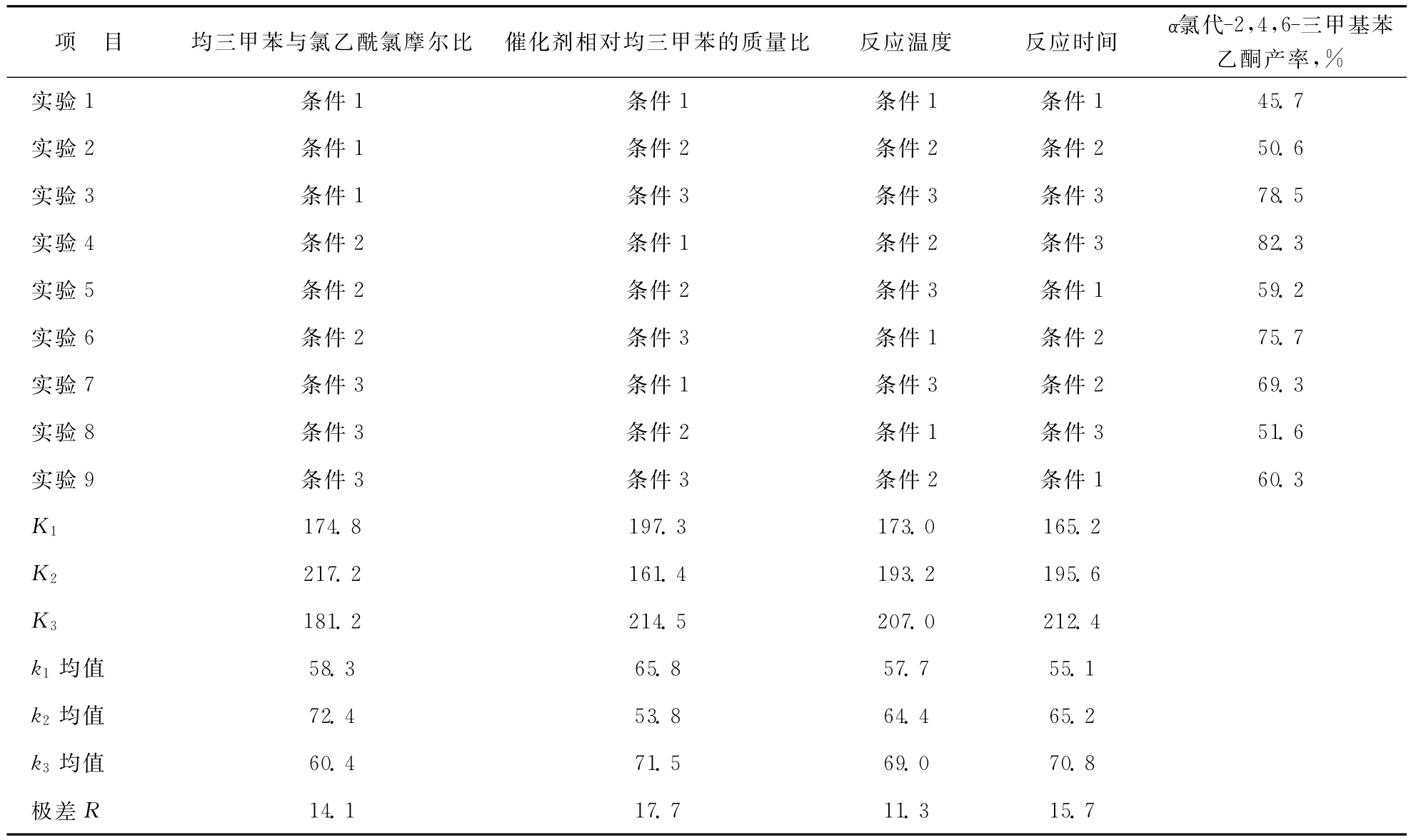
表2 L9(34)正交实验方案和结果
由表2中极差R大小关系可以看出,影响均三甲苯酰基化反应的因素由强到弱的顺序为:催化剂用量>反应时间>物料配比>反应温度。
根据正交结果的ki值得出最佳反应条件为:均三甲苯与氯乙酰氯的摩尔比1∶2,反应时间8h,反应温度80℃,催化剂相对均三甲苯的质量比0.30%。但是,根据图3结果,催化剂相对均三甲苯的质量比为0.25%时,α-氯代-2,4,6-三甲基苯乙酮产率为82.2%,催化剂相对均三甲苯的质量比为0.3%时,α-氯代-2,4,6-三甲基苯乙酮产率为82.4%,催化剂相对用量在0.25~0.30%范围内变化时,α-氯代-2,4,6-三甲基苯乙酮产率仅相差0.2百分点,因此从经济角度考虑,催化剂相对均三甲苯的质量比以0.25%为宜。反应时间分别为1,2,3,4,5,6,7,8h时,α-氯代-2,4,6-三甲基苯乙酮产率分别为39.4%,55.5%,68.8%,81.7%,82.3%,83.3%,83.4%,83.5%,反应4h后,随反应时间的延长,α-氯代-2,4,6-三甲基苯乙酮产率的提高幅度很小,从能耗等因素考虑,反应时间以4h为宜。由此确定适宜的反应条件为:均三甲苯与氯乙酰氯的摩尔比1∶2,反应时间4h,反应温度80℃,催化剂相对均三甲苯的质量比0.25%。
3.6 优化反应条件后酰基化反应实验结果
在优化的实验条件下,采用Fe/Al2O3催化剂进行均三甲苯的酰基化反应,得到α-氯代-2,4,6-三甲基苯乙酮的平均产率为81.8%,纯度为97.8%。而使用AlCl3催化剂的对比实验中,α-氯代-2,4,6-三甲基苯乙酮的产率仅为78.0%,纯度仅为79.8%。
新鲜催化剂在使用后如果不经过再生而直接使用,则α-氯代-2,4,6-三甲基苯乙酮的产率会降低。这可能是由于催化剂的一部分活性中心被所沉积的有机物覆盖所致。重复使用两次以上的催化剂经再生后重新用于同样条件下的酰基化反应仍能得到较高的α-氯代-2,4,6-三甲基苯乙酮产率,表明催化剂可以重复使用。
4 结 论
(1)适宜的负载型铁催化剂制备条件为:以Al2O3为载体,铁负载量20%,活化温度400℃。
(2)Fe/Al2O3催化剂能够催化均三甲苯与氯乙酰氯的酰基化反应,得到α-氯代-2,4,6-三甲基苯乙酮,是一种新型有效的环境友好催化剂。
(3)采用Fe/Al2O3催化剂时酰基化反应的优化条件为:均三甲苯与氯乙酰氯的摩尔比1∶2,反应时间4h,反应温度80℃,催化剂相对均三甲苯的质量比0.25%。在此条件下,α-氯代-2,4,6-三甲基苯乙酮的产率为81.8%。参考文献
[1] Giluan H,Gaj B J.Alkylation of carbon-metallic compounds with trialkyl phosphates[J].J Am Chem Soc,1960,82(24):6326-6329
[2] Rosenberg S D.Some halogen-metal interconversion reactions with methylphenyl halides[J].J Am Chem Soc,1954,76(17):4389-4390
[3] Kodomari M,Satoh H,Yoshitemi S.Selective nuclear halopenation of polymethylbenzenes with alumina-supported copper:Ⅱhalides[J].Bull Chem Soc TP,1988,61(11):4149-4152
[4] Pinkus A G,Gopalan R.Studies on the mechanism of acidcatalyzed bromination of a hindred alkyl aryl ketone:2,4,6-Trimethylacetophenone:Rate dependence on bromine concentration[J].J Am Chem Soc,1984,106(9):2630-2633
[5] Noller C R,Adams R.The use of aliphatic acid anhydrides in the preparation of ketones by the friedel and crafts reaction[J].J Am Chem Soc,1924,46(8):1889-1892
[6] 花文廷,李龙润,译.现代合成反应[M].北京:北京大学出版社,1985:638
[7] 肖发,邝生鲁.二氧化碳在化学合成上的研究进展[J].化学研究与应用,2000,12(3):237-241
[8] 李正西.国内二氧化碳在精细化工中的应用[J].吉林化工,1997,12(3):71-73
[9] 唐蓉萍.2,4,6-三甲基苯甲酸的制备方法[J].甘肃化工,2003,(3):23-25
[10]刘传玉,洪家琏.2,4,6-三甲基苯甲酸的合成及应用[J].化学与黏合,2002,(4):1-3

