牛血清白蛋白和苯甲酸钠相互作用的荧光光谱研究
王志军,郑 静,王慧慧
(长治学院 化学系,山西 长治 046011)
牛血清白蛋白和苯甲酸钠相互作用的荧光光谱研究
王志军,郑 静,王慧慧
(长治学院 化学系,山西 长治 046011)
利用荧光光谱研究了牛血清白蛋白(BSA)与苯甲酸钠(SB)的相互作用,结果表明,随着苯甲酸钠浓度的增加,BSA荧光强度逐渐减弱。二者以1:1的结合比结合,考察了不同pH、离子强度、不同金属离子,表面活性剂的条件下,苯甲酸钠与BSA的结合情况。
苯甲酸钠;牛血清白蛋白;荧光光谱
苯甲酸钠(sodium benzoate),又称安息香酸钠,是苯甲酸的钠盐。在酸性食品中能部分转为有活性的苯甲酸,有防止变质发酸、延长保质期的效果,由于比苯甲酸更易溶于水,而且在空气中稳定,抑制酵母菌和细菌的作用强,所以使用很广泛[1]。苯甲酸钠对人的长期毒性尚不很明确,特别是婴儿是否含有把苯甲酸钠转化为马尿酸的转化酶系未知[2],因此研究苯甲酸钠的毒性具有现实意义。
牛血清白蛋白(BSA),是牛血清中的一种球蛋白,主要起维持渗透压作用、pH缓冲作用、载体作用和营养作用。作为血浆中含量最丰富的重要载体蛋白,它能与许多内源性和外源性物质广泛结合,还能结合大、中、小分子化合物,具有重要的生理意义[3-4],在生命体内起着重要的储存和运输作用。苯甲酸钠与血清白蛋白间的相互作用已有报道[3],但生命是一个复杂体系,生命过程中的物质分子间相互作用远不仅限于二者之间。文章研究了在不同化学环境中,苯甲酸钠与牛血清白蛋白的相互作用,以期说明二者作用受各种条件的影响,为二者在体内可能的作用模式提供理论依据。
1 实验部分
1.1 仪器与试剂
雷磁PH-3B型pH计(上海精科),TU-1900双光束紫外可见分光光度计(北京普析通用仪器有限责任公司),F-4600荧光仪(日本日立),FA电子分析天平(上海越平科学仪器有限公司)。
牛血清白蛋白(BSA)(北京奥特星生物有限责任公司),三羟基氨基甲烷(Tris)(湖南湘中化学试剂有限公司),十二烷基苯磺酸钠(SDS)(成都市科龙化工试剂厂),十六烷基三甲基溴化铵(CTAB)(中国湘中地质实验研究所),Triton X-100(河南天方药业有限公司)。实验所用试剂均为分析纯,实验用水为二次蒸馏水。
1.2 光谱测定
称取一定量的牛血清白蛋白,加入一定量的Tris-HCl缓冲溶液,pH=7.4,其准确浓度用吸收光谱法测定。BSA工作浓度3.57×10-7mol/L。扫面300nm-500nm波长范围内的荧光光谱,激发波长是290nm,狭缝宽度均为2.5nm。
2 结果与讨论
2.1 苯甲酸钠与BSA作用的荧光光谱分析
图1为苯甲酸钠存在下,牛血清白蛋白的荧光光谱图。由图知,牛血清白蛋白随着苯甲酸钠浓度的增加,在340nm处荧光强度降低,且有明显蓝移。当苯甲酸钠加入一定量时,荧光强度几乎不变。表明苯甲酸钠与牛血清白形成了稳定的复合物,在静态猝灭中,荧光体的荧光强度与其游离浓度成正比,利用lg[(F0-F)/F]=lgK+nlg[Q][3],以lg(F0-F/F)对lg[Q]作图得到一条直线,根据直线斜率及截距分别求得结合常数K和结合位点数n,计算得出y=0.8116x+3.6705,n=0.8116,约等于 1,即苯甲酸钠与BSA结合比为1:1[3],和文献报道相符合。
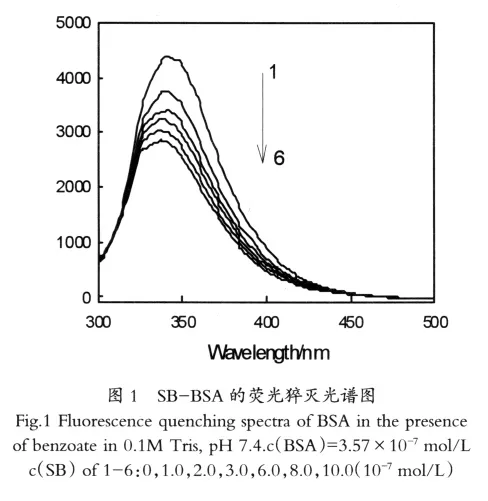
2.2 pH对苯甲酸钠-BSA荧光光谱的影响
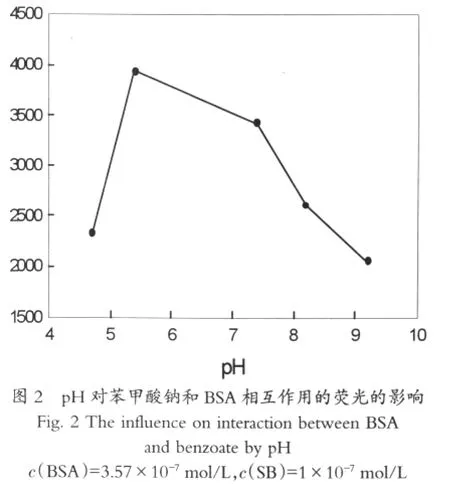
pH对苯甲酸钠和BSA相互作用的荧光强度密切相关。图2可知,在pH=5.4的时候苯甲酸钠与BSA相互作用的荧光光谱的强度最大,pH大于5.4时,随着pH的增加,荧光强度随之减弱。然后pH小于5.4,荧光强度也降低。溶液pH的变化对一定配比的苯甲酸钠和BSA有很大的影响。这是因为苯甲酸钠-BSA是弱酸性或弱碱性物质,溶液对PH的改变非常灵敏,且在等电点附近,BSA不带电荷,对pH的改变影响较小。
2.3 金属离子对苯甲酸钠-BSA荧光光谱的影响
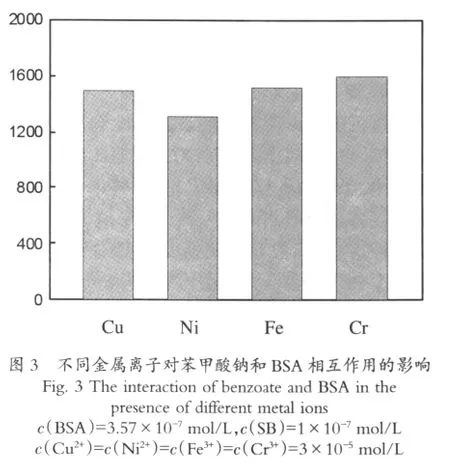
金属元素在有关生命过程中起着极其重要的作用,如铬、镍是生物体所必需的微量元素之一,铬是生物必需的微量元素,在酶的催化和加强糖代谢等方面具有重要作用,铬在动物体内的吸收和转运机制仍不确定[5],铬(Ⅲ)是环境中常见的重金属污染物,是一种毒性较大的制畸、致突变剂,被国际癌症研究机构归为一类人类职业致癌物。铜是人体的必须元素[6],铜作为各种金属酶的活性中心,催化电子转移、氧化反应和氧合反应,也是生物体作为载体氧蛋白活性部位的基本成分。铁元素是人体含量最多的必须微量元素[7],它是多种蛋白质和酶类的关键组分,在人体中具有造血功能,并且参与血蛋白、细胞色素及各种酶的合成,同时还在血液中起运输氧和营养物质的作用。人的颜面泛出红润之美,也离不开铁元素,人体缺铁会发生小细胞性贫血、免疫功能下降和新陈代谢紊乱,如果铁质不足可导致缺铁性贫血。但重金属元素在高浓度下是有毒的,对不同金属离子对苯甲酸钠与牛血清白蛋白的影响做了研究。结果表明,如图3,Cu2+,Ni2+,Fe3+,Cr3+均对BSA与苯甲酸钠相互作用的荧光光谱产生协同猝灭作用,均能提高BSA与苯甲酸钠的结合能力。猝灭作用从强到弱依次为Cr3+,Fe3+,Cu2+,Ni2+。这可能是由于金属离子与BSA及苯甲酸钠形成了三元配合物,带电的蛋白质和苯甲酸钠以及金属离子通过静电作用相互吸引到蛋白质的表面,从而引起荧光猝灭。Fe3+、Cr3+电荷数高,离子半径小,静电作用强更有利于配合物的形成,但浓度较高时由于离子强度的增大使这种结合受到一定程度的影响。Cu2+,Ni2+影响次之。
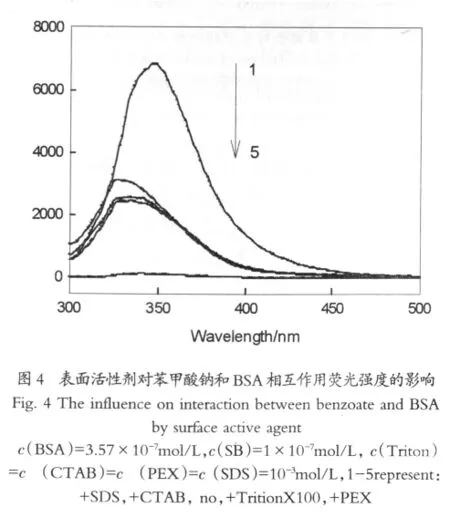
2.4 表面活性剂对苯甲酸钠-BSA荧光光谱的影响
蛋白质——表面活性剂复配体系不仅在药物、化妆品、生物及食品等领域中有着广泛的应用,而且还可用于模拟生物体系,对加快生物技术向化工、医药等传统领域的渗透和应用具有重要的意义。如图4可知,表面活性剂对一定配比的苯甲酸钠和BSA相互作用的溶液的荧光强度有明显的影响作用。其中CTAB使得荧光明显增强,有敏化作用,其次是十二烷基苯磺酸钠(SDS),也有一定的敏化作用,而Triton X-100及PEX则使荧光强度减弱。
这可能是由于离子型表面活性剂在其浓度低于CMC(临界胶束浓度)时,对体系有不同程度的增强作用,当其浓度超过CMC时,对体系有不同程度的抑制作用。所以阳离子表面活性SDS、阴离子表面活性剂CTAB使得荧光强度增强,而阴离子表面活性剂PEX则使荧光光谱猝灭。非离子表面活性剂表面不带电荷,与蛋白质的相互作用通常是很弱的,有的甚至没有作用,所以荧光强度减弱[9]。因此,Triton X-100对苯甲酸钠-BSA的荧光光谱稍有猝灭,或几乎没影响。

2.5 离子强度对苯甲酸钠-BSA荧光光谱的影响
如图5所示,氯化钠对苯甲酸钠与BSA相互作用的荧光强度有一定的影响。随着氯化钠浓度的增加,荧光强度在逐渐减弱。这是由于随着氯化钠的加入,在BSA周围的Cl-增多,从而减弱苯甲酸钠与BSA之间的结合,引起荧光强度的稍稍减弱。
3 结论
通过荧光光谱,监测了牛血清白蛋白和苯甲酸钠的相互作用。实验结果表明:苯甲酸钠的加入能降低牛血清白蛋白的荧光,二者形成了稳定的复合物;在pH=5.4时,二者作用最强;金属离子的加入亦猝灭复合物的荧光强度,作用从强到弱依次为Cr3+,Fe3+,Cu2+,Ni2+;表面活性剂 SDS 和 CTAB 敏化复合物荧光,PEX则强烈猝灭荧光。离子强度的变化对二者的作用也有一定的影响。通过上述研究,为寻找二者最佳的结合条件提供一定的理论依据。
[1]金时俊.食品添加剂-现状、生产、性能、应用[M].上海化工化学院出版社,上海:1922.17.
[2]Brusilow S W,Valle D L,Batshaw M L.New Pathways of Nitrogen Excretion in Inborn Errors of Urea Synthesis.LacetⅡ[J].1979,2(8140):452-454.
[3]王亚俐,王海芳.光谱法研究苯甲酸钠与牛血清白蛋白的相互研究[J].北京大学学报(自然科学版),2002,38(2):159-163.
[4]吴丽敏,张美玲,娄依依,等.小檗碱与牛血清白蛋白相互作用的核磁共振研究[J].分析化学,2011,39(8):1223-1227.
[5]Davis CM,Vincent JB.Chromium in Carbohydrate and Lipid Met abolism [ J].J Biol Inorg Chem,1997,(2):675-679.
[6]梁宏,刑本刚,王修键,等.Cu与HSA或BSA相互作用的平衡透析研究[J].科学通报,1997,42(22):2395-2399.
[7]奥西埃著,罗锦新,张乃正,等合译.生物无机化学导论[M].化学化工业出版社,北京:1987.9.
[8]杨发树.温度对鲁米诺-过氧化氢体系化学发光的影响及牛血清白蛋白的测定研究[J].四川大学,2008.5.
[9]魏晓芳,刘会洲.Triton X-l00与牛血清白蛋白的相互作用[J].分析化学,2000,28(6):699-701.
Study of Interaction Between Bovine Serum Albumin with Sodium Benzoate by Fluoresence Spectroscopy
WANG Zhi-jun,ZHENG Jing,WANG Hui-hui
(Department of Chemistry,Changzhi University,Changzhi,Shanxi 046011)
The interaction of bovine serum albumin(BSA)with sodium benzoate were studied by the fluorescence spectra.The results showed that fluorescence intensity decreased gradually with increasing concentration of sodium benzoate,sodium benzoate binds BSA by 1:1.The binding of sodium benzoate and BSA were measured in the presence of different pH,ionic strength,different metal ions and surfactant conditions.
bovine serum albumin;fluorescence spectroscopy;sodium benzoate
O657.39
A
1673-2014(2011)05-0008-04
2011—04—11
山西省高校科技开发项目(20081042);山西省高等学校大学生创新创业训练项目;长治学院校级资助项目(2011116)。
王志军(1980—),男,山西原平人,副教授,博士,主要从事生物无机化学研究工作。
(责任编辑 王璟琳)

