高效价冻干人用狂犬病疫苗暴露后免疫程序的研究
汝东宇,雷连成
(吉林大学畜牧兽医学院微生物与免疫学实验室,吉林长春130000)
狂犬病是由狂犬病病毒引起的人兽共患疾病。根据世界卫生组织的报告,全世界每年死于狂犬病的患者约55 000例,99%的病例发生在发展中国家,其中亚洲约占全球狂犬病发病总数的56%,非洲约占发病总数的44%。其中印度发病人数最多,位居第一,我国次之[1-2]。人用狂犬病疫苗的免疫分为暴露前免疫及暴露后免疫,各国推荐使用的人用狂犬病疫苗免疫程序也不相同[3-4]。世界卫生组织推荐的狂犬病毒暴露前免疫方案为0、7、21或28 d各免疫1剂量的疫苗,疫苗效力不低于2.5 IU/剂。暴露后免疫则有多种方案:埃森法(Essen regimen),第0、3、7、14和28天各肌肉注射1个剂量的疫苗(2.5 IU)。萨格勒布法(Zagreb regimen,2-1-1),第0天,分别在左和右上臂肌肉各注射1个剂量的疫苗,此后于第7和21天,各将1个剂量的疫苗注射至上臂,此种程序可免去2次就诊和1剂疫苗。泰国红十字会皮内注射法(Thai Red Cross Schedule“2-2-2-1-1”法),第0、3、7天,在2个不同的淋巴引流区(通常为左、右上臂)皮内注射1个剂量(0.1 mL)的疫苗,在第30和90天各注射0.1 mL疫苗。8部位皮内注射法(8-0-4-0-1-1),第0天,在8个不同部位皮内注射1个剂量疫苗(0.1 mL)。第7天,在每侧上臂和每侧大腿的外侧皮内注射4个0.1 mL的疫苗,此后,第28和90天各注射0.1 mL剂量的疫苗。上述各国应用的人用狂犬病疫苗免疫方案均需接种4针次以上疫苗,全程免疫时间为21~90 d。在萨格勒布方案中,虽只接种4针,但在暴露后第3天没有接种疫苗,而第3天对暴露后伤口的检查是非常重要的。本文制备了一种高效价的冻干人用狂犬病疫苗,在高效价的基础上,以减少狂犬病疫苗的免疫针次并缩短全程接种时间,对暴露后免疫程序进行了初步研究。
1 材料与方法
1.1 材料
1.1.1 实验动物BALB/c小鼠,雌性,11~13 g;比格犬,5~6 kg(上海交通大学实验动物中心,经狂犬病毒抗体检测为阴性)。
1.1.2 病毒和细胞狂犬病街毒株CNX8601(由中国疾病预防控制中心病毒病预防控制所提供,1986年分离自中国宁夏病人脑组织);狂犬病街毒株BD06(由军事医学科学院军事兽医研究所流行病学研究室提供);狂犬病病毒株CVS11;BSR细胞(由武汉生物制品研究所基因工程室提供)。
1.1.3 试剂和标准品人用狂犬病毒免疫球蛋白(21.4 IU/mL),购自中国药品生物制品检定所;FITC标记的抗狂犬病毒核蛋白荧光抗体(Chemico);胎牛血清、胰蛋白酶、牛血清白蛋白、谷氨酰胺、DMEM培养基(GIBCO);丙酮(北京化工厂);依文思蓝(Sigma)。
1.1.4 实验样品高效价冻干人用狂犬病疫苗(HPRabV),效价6.0 IU/剂,冻干人用狂犬病疫苗(RabV),效价3.1 IU/剂。
1.2 方法
1.2.1 以小鼠为试验动物HPRabV暴露后保护效果评价BALB/c小鼠,11~13 g,随机分成3组,每组32只;狂犬病街毒株CNX8601,毒力为4.2 LgLD50,病毒采用30 LD50剂量接种于小鼠咬肌,接种病毒后2 h,腹腔免疫0.5 mL实验用疫苗。HPRabV(6.0 IU/剂)按0、3、14免疫程序免疫,RabV按0、3、7、14、28免疫程序免疫,设病毒对照组。于第5、7、10、14、18、22、26、33、37、44天于眼眶后静脉采血,分离血清,采用RFFIT法测定血清中的中和抗体效价[5]。对HPRabV和RabV产生的中和抗体进行统计分析。每天观察小鼠死亡情况,于第4天开始记录死亡的小鼠,根据病毒对照组死亡率及疫苗组的生存率计算HPRabV和RabV的保护率,并对两者进行评价。
1.2.2 以比格犬为实验动物HPRabV暴露后保护效果评价实验动物为比格犬,体重5~6 kg,随机分成4组,每组10只,每只均咬肌接种200 000 LD50狂犬病街毒BD06株,前腿肌肉注射HPRabV(效价6.0 IU/剂)或RabV(效价3.1 IU/剂),并设病毒对照组。免疫程序:①HPRabV于0、3、10 d各接种1剂量的疫苗;②HPRabV于0、3、14 d各接种1剂量的疫苗;③RabV于0、3、7、14、28 d各接种1剂量的疫苗;④病毒对照组。各组分别在5、7、10、14、18、22、26、33、37、44 d用注射器颈部静脉取血1.0 mL,37℃放置1 h,4℃12 h,5 000 r/min离心10 min,吸取上层血清,56℃灭活30 min,利用RFFIT法检测血清中的中和抗体效价。观察并记录实验动物死亡情况,计算疫苗保护率。
2 结果与分析
2.1 小鼠暴露狂犬病街毒后接种HPRabV和RabV产生的中和抗体比较
以小鼠为实验动物的暴露后免疫保护实验中和抗体测定结果显示,HPRabV 0/3/14同RabV 0/3/7/14/28比较,经统计分析,P<0.05,2组之间相比有显著性差异,HPRabV 0/3/14产生的中和抗体高于RabV 0/3/7/14/28组。
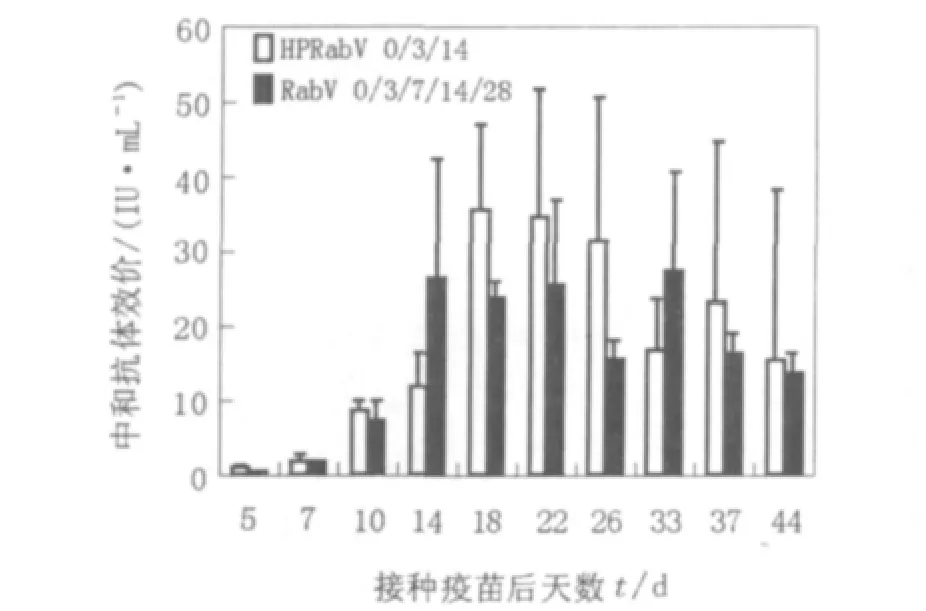
图1 小鼠暴露街毒后接种HPRabV和RabV产生的中和抗体检测结果Fig.1 RVNA responses induced by HPRabV(6.0 IU/dose)and RabV(3.1 IU/dose)in BALB/c post exposure
2.2 小鼠暴露狂犬病街毒后接种HPRabV及RabV的保护率
小鼠咬肌接种狂犬病街毒CNX8601,剂量为30LD50,结果病毒对照组死亡率为93.8%,HPRabV组疫苗保护率为56.2%,RabV组的保护率为40.6%,结果见图2。

图2 小鼠暴露狂犬病街毒后接种HPRabV及RabV的保护率Fig.2 Survival rate of BALB/c mice after post-exposure prophylaxis
2.3 以比格犬为实验动物暴露后免疫中和抗体检测结果
利用RFFIT法检测血清中的中和抗体效价,计算各组中和抗体几何平均效价(IU/mL),结果见图3。经统计学分析,HPRabV 0/3/10组、HPRabV 0/3/14组与RabV 0/3/7/14/28组之间分别进行中和抗体水平比较,经t检验,P>0.05,不同免疫程序产生的中和抗体效价均无显著性差异。免疫后10 d前HPRabV组中和抗体水平明显高于RabV组。第10天抗体检测,RabV组为23.8 IU/mL,HPRabV组为29.5 IU/mL和29.0 IU/mL,HPRabV组与RabV组分别进行t检验,P<0.001,有极显著性差异。同时第5、7天HPRabV组中和抗体水平均高于RabV组。HPRabV能够更早的刺激机体产生高效价的中和抗体。HPRabV 0/3/10组与HPRabV 0/3/14组间比较,两者前期(0~18 d)中和抗体几何平均效价基本持平,而后者在后期(22~56 d)中和抗体几何平均效价均高于前者。
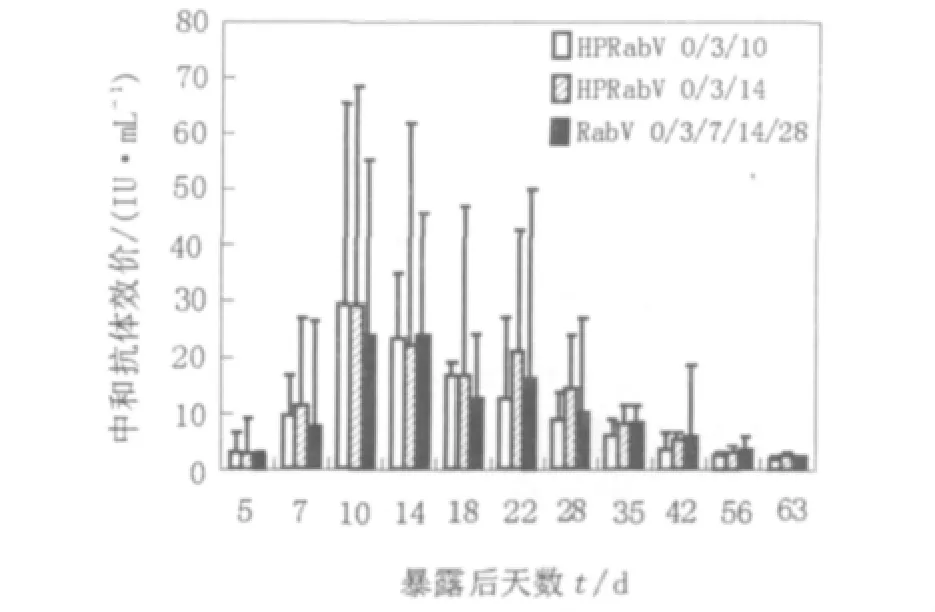
图3 比格犬暴露后2种疫苗不同免疫程序产生的抗体效价比较Fig.3 RVNA responses induced by HPRabV and RabV in beagles post exposure prophy laxis
2.4 比格犬暴露狂犬病街毒后疫苗保护率结果
比格犬经200 000 LD50狂犬病毒街毒株BD06攻击后,2种不同效价疫苗的保护率结果见图4。由图4可见,病毒对照组死亡率为100%,表明比格犬街毒暴露后保护率试验结果成立。街毒攻击后HPRabV 0/3/10免疫程序死亡3只实验动物,疫苗保护率为70%;HPRabV 0/3/14免疫程序死亡2只实验动物,疫苗保护率为80%;RabV 0/3/7/14/28免疫程序死亡3只实验动物,疫苗保护率为70%。保护率试验结果表明HPRabV 0/3/10组、HPRabV 0/3/14组与RabV 0/3/7/14/28组街毒攻击均具有保护作用,HPRabV 0/3/14组疫苗保护率高于其他2组。
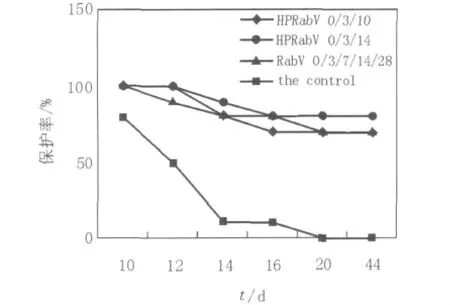
图4 街毒攻击后2种疫苗不同免疫程序免疫比格犬保护率结果Fig.4 Survival rate of beagles after post-exposure prophylaxis
3 讨论
狂犬病疫苗主要应用于暴露后免疫,WHO推荐使用的是埃森法,在0、3、7、14、28 d各免疫1个剂量的人用狂犬病疫苗,疫苗的效力不低于2.5 IU/剂,本研究制备的高效价冻干人用狂犬病疫苗(6.0 IU/剂)目标是使暴露后免疫针次减少到3针,达到和现有疫苗同样的保护效果。
以小鼠为实验动物的暴露后免疫保护实验中和抗体测定结果显示,HPRabV 0/3/14同RabV 0/3/7/14/28比较,经统计分析,P<0.05,2组之间相比有显著性差异,HPRabV 0/3/14产生的中和抗体高于RabV 0/3/7/14/28组。并且2组的最高值均出现在18~22 d,2组产生的中和抗体水平消长情况比较相似,是高效价冻干人用狂犬病疫苗比较理想的免疫程序。
在以比格犬为实验动物的暴露后免疫程序研究中,以BD06株作为攻击用毒株,病毒对照组死亡率为100%,表明本次比格犬街毒暴露后保护率试验结果成立。HPRabV 0/3/10免疫程序疫苗保护率为70%;HPRabV 0/3/14免疫程序疫苗保护率为80%;RabV 0/3/7/14/28免疫程序疫苗保护率为70%。保护率试验结果表明HPRabV 0/3/10组、HPRabV 0/3/14组与RabV 0/3/7/14/28组街毒攻击均具有保护作用,HPRabV 0/3/14组疫苗保护率高于其他2组。
[1] 俞永新.狂犬病和狂犬病疫苗(第2版)[M].北京:中国医药科技出版社,2009.
[2] WHO Weekly Epidemiological Record[M].2007,49/50:425-435.
[3] Manning SE,Rupprecht CE,Fishbein D,et al.Human rabies prevention-United States,2008:recommendations of the Advisory Committee on Immunization Practices[J].MMWR Recomm Rep,2008,57(RR03):1-26,28.
[4] LeGuerrier P,Pilon PA,Deshaies D,et al.Pre-exposure rabies prophylaxis for the international traveler:a decision analysis[J].Vaccine,1996,14(2):167-176.
[5] F-X Meslin,MM Kaplan,H Koprowski.Laboratory techniques in rabies.4th Edn[M].World Health Organization publications,1996.

