甘草甜素对树突状细胞表型及生物学功能的影响
于洪涛,华慧,李伟伟,孟一鸣,李璇,张朕杰,单风平
(中国医科大学免疫学教研室,辽宁沈阳110001)
树突状细胞(dendritic cells,DCs)是功能最强的专职抗原提呈细胞,能有效刺激初始型T细胞的增殖,是机体免疫反应的始动者,参与机体多种自身免疫性疾病、免疫缺陷病、肿瘤及一些炎症反应的病理过程,在机体抗感染免疫及肿瘤应答免疫中起重要作用[1-2]。甘草甜素(glycyrrhizin,GL)是中药甘草的主要成分,具有免疫调节、抗炎、抗病毒、抗变态反应等作用,现运用于临床各种疾病的治疗,取得了明显确切的疗效[3-4]。鉴于甘草甜素和树突状细胞在免疫系统中的显著地位,本实验就甘草甜素对小鼠髓系DC2.4细胞株表型及功能的调节作用进行研究,并探讨其免疫刺激功能及机制。
1 材料与方法
1.1 材料
1.1.1 来源DC来源为C57小鼠髓系DC2.4细胞株,本教研室保存并传代。
1.1.2 药物与主要试剂甘草甜素,美国Sigma公司;IL-12 ELISA试剂盒,eBioscience;PE-MHCⅡ抗体、PE-CD86抗体、FITC-CD40抗体,BD Biosciences;酸性磷酸酶试剂盒,南京建成科技有限公司。
1.2 方法
1.2.1 小鼠髓系树突细胞2.4(DC2.4)复苏和培养取出冻存的DC2.4细胞,迅速放入37℃水浴中,不断地搅动直到冻存管中的细胞溶化。1 000 r/min离心10 min,弃上清,用含10%胎牛血清的RPMI 1640培养液柔和地吹打,直到完全散开。将吹打后的液体转移到准备好的培养瓶(含10%胎牛血清的RPMI 1640培养液)中,于倒置显微镜下观察细胞状态后,放到温度37℃、5%CO2的培养箱中培养。
1.2.2 药物处理甘草甜素溶解于RPMI 1640中,加入培养至对数生长期的DC细胞培养液中,甘草甜素浓度为12.5 μg/mL(预实验发现此浓度效果最好),RPMI 1640作为阴性对照,LPS(10 ng/L)作为阳性对照。①扫描电镜观察DC表面形态:按照上述药物处理方法培养DC,48 h后收集细胞,经过常规扫描电镜制样流程:戊二醛固定、清洗、锇酸后固定、清洗、置换、临界点干燥、粘台、喷金,最后在扫描电镜(JEOL.JSM-7300)下观察;②流式细胞仪检测DC表面分子:药物处理过的细胞经48 h培养后,用胰酶消化为细胞悬液,用FASC缓冲液(含2%FCS的PBS)洗2遍,1 000 r/min离心10 min,调整细胞浓度为1×107个/mL,每管加0.1 mL细胞悬液,加PE标记的MHCⅡ和CD86(BD Biosciences),FITC标记的CD40(BD Biosciences)单克隆抗体,4℃下温育30 min,FACS缓冲液洗2遍,然后用300 μL FACS缓冲液重悬细胞置于流式细胞仪(FACS Cabulir BD)上检测;③体外刺激淋巴细胞增殖实验:取1×106/mL DC细胞悬液作为刺激细胞,同时无菌取C57小鼠脾淋巴细胞4×107/mL作为反应细胞。于96孔培养板每孔加入刺激细胞和反应细胞各100 μL,并设反应细胞自身对照。置37℃、5%的CO2培养箱孵育48 h。在培养结束前4 h于每孔加入20 μL MTT试剂,继续培养4 h。培养结束后用酶标仪读570 nm处的吸光度值;④4-氨基安替比林(4-AAP)比色检测DC内酸性磷酸酶活性:DC经药物处理后培养48 h,再用胰酶消化成细胞悬液,调整细胞浓度为1×106个/mL,按照测酸性磷酸酶试剂盒(南方建成生物工程研究所)提供方法操作;⑤ELISA检测培养上清中IL-12的分泌:DC经甘草甜素和LPS作用48 h后收集上清,应用双抗体夹心法酶联免疫吸附试验(ELISA)检测细胞培养上清中IL-12的含量,试验按照购买的ELISA试剂盒(eBioscience)的步骤操作。反应终止后用酶标仪检测450 nm处吸光值(A450),再根据标准曲线确定所测细胞因子的浓度。
1.2.3 统计学分析采用SPSS16.0统计软件进行分析,计量资料以¯χ±s表示,多样本均数比较应用单因素方差分析(One-way ANOVA),样本均数间的多重比较采用LSD检验。P<0.05为差异有统计学意义。
2 结果与分析
2.1 扫描电镜观察DC表面形态
DC经药物刺激48 h,按照材料与方法中所述的制样步骤处理后,在扫描电镜下观察其表面形态。如图1所示,甘草甜素处理后的DC形态不规则,表面粗糙,有层叠状的皱襞,细胞表面有长短不等的大量的树枝样突起,此外尚有短小的圆形、椭圆形突起,而阴性对照组DC细胞突起显著减少,层叠不明显。
2.2 甘草甜素对DC表面MHCⅡ、CD86、CD40表达的影响
DC高表达MHCⅡ、CD86、CD40是DC趋向成熟的标志之一[2,5-6]。与阴性对照组(RPMI 1640)相比,12.5 μg/mL甘草甜素与LPS类似,能够上调MHCⅡ、CD86、CD40的表达(P<0.05),即甘草甜素与LPS相似均能够促进DC的成熟(图2)。
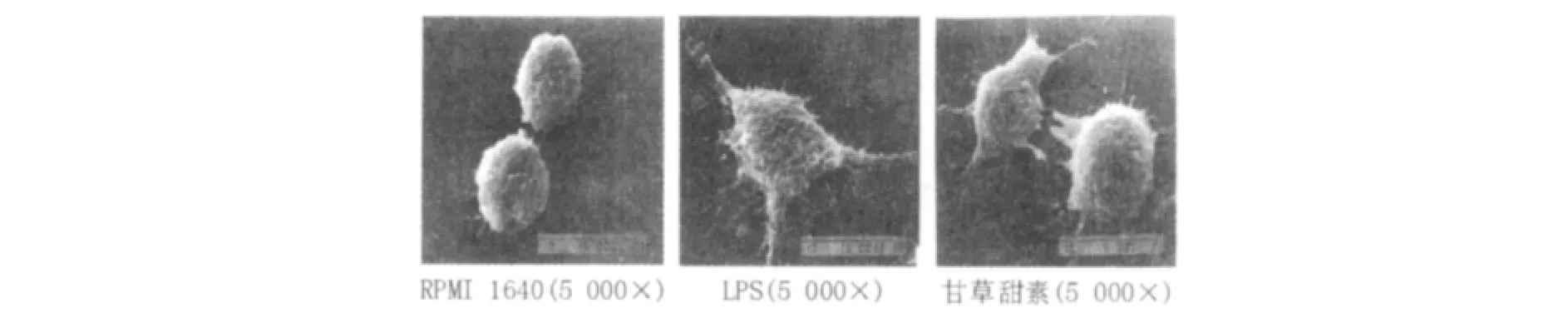
图1 DC的扫描电镜图片Fig.1 Scanning eledtronic microscopy for DCs’morphology

图2 甘草甜素能够上调DC表面MHCⅡ、CD40、CD86的表达Fig.2 Up-regulation of the expressiong of MHCⅡ、CD40 and CD86 on the DCs after treatment with GL
2.3 甘草甜素对DC刺激T淋巴细胞增殖的影响
DC刺激同种异体小鼠脾脏T淋巴细胞增殖反应的程度用A值(A570)表示。与对照组相比,甘草甜素组和LPS组刺激同种异体小鼠脾脏T淋巴细胞增殖能力均明显增强(P<0.05,表1)。
2.4 甘草甜素对酸性磷酸酶活性的影响
酸性磷酸酶是溶酶体内主要的效应酶,酸性磷酸酶含量的下降说明溶酶体含量的减少,间接说明DC吞噬加工抗原的能力减弱,细胞趋向成熟。用甘草甜素刺激DC2.4 48 h后,与阴性对照组相比,甘草甜素组和LPS组酸性磷酸酶活性均下降(表2)。
表1 甘草甜素增强同种异体小鼠脾脏T淋巴细胞增殖(A570)(±s,n=6)Table 1 GL enhance the proliferation of allogenic spleen T lymphocytes(A570)(±s,n=6)

表1 甘草甜素增强同种异体小鼠脾脏T淋巴细胞增殖(A570)(±s,n=6)Table 1 GL enhance the proliferation of allogenic spleen T lymphocytes(A570)(±s,n=6)
GroupA570P RPMI 16401.48±0.07 LPS2.33±0.11<0.01 GL1.56±0.05<0.05
表2 甘草甜素下调酸性磷酸酶活性(A520)(±s,n=6)Table 2 GL enhance the activity of acid phophatase(A520)(±s,n=6)

表2 甘草甜素下调酸性磷酸酶活性(A520)(±s,n=6)Table 2 GL enhance the activity of acid phophatase(A520)(±s,n=6)
GroupA520P RPMI 16400.53±0.01 LPS0.44±0.03<0.01 GL0.48±0.01<0.05
2.5 ELISA检测培养细胞上清液IL-12含量
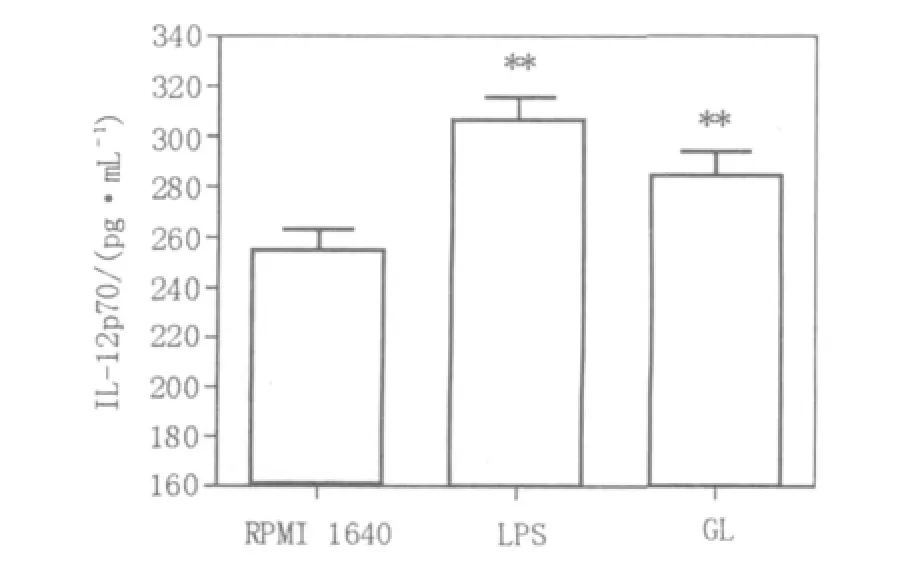
图3 甘草甜素能够增强DC对IL-12的分泌Fig.3 GL can enhance the ability of DC to secrete IL-12
IL-12是DC受刺激后比较特异的一种产物[7-8]。根据标准品浓度制定标准曲线(方程y=0.002 7x+0.060 3(R2=0.999 2)),与RPMI 1640组相比,甘草甜素处理的DC能够增加DC培养液上清中IL-12的含量,LPS作为阳性对照。ELISA结果显示DC在未做任何处理时(即RPMI 1640组)IL-12分泌量少((254.83±8.31)pg/mL),甘草甜素和LPS处理的DC能够分泌较高水平的lL-12(分别为(284.17±9.52)pg/mL、(306.67±8.75)pg/mL),结果显示甘草甜素与LPS类似,能够促进DC功能的成熟(图3)。
3 讨论
甘草甜素具有调节细胞因子功能,纠正Th1/Th2比例失衡的作用,主要通过抑制前列腺素合成的限速酶—磷脂酶A2的活性,减少前列腺素的产生,并诱导IL-1的产生,从而促进IL-2的产生,促进INF-γ的分泌,同时可能抑制IL-4的产生,从而使Th1的功能增强,抑制Th2的功能,调节Th1/Th2失衡[9-10]。DC最大的特点是能够显著刺激初始型T细胞(naive T cells)增殖,因此DC是机体免疫反应的始动者,在诱导免疫应答过程中具有独特的地位。DC在体内广泛分布,是一种异质性细胞群体,具有多种不同形态、表型和功能。正常情况下绝大多数体内DC处于非成熟状态,不成熟的树突状细胞(immature dendritic cells,iDC)具有高效的抗原摄取和处理能力,因其低表达共刺激分子和主要组织相容复合体(major histocompatibility complex,MHC)分子,对T细胞的激活作用差,故其抗原提呈能力较弱。未成熟DC在摄取抗原或接受到某些刺激因素(如LPS、TNF-α)后,细胞表面MHC-Ⅱ分子和协同刺激分子如CD40、CD80/CD86、CD58表达增加,呈递抗原的能力逐渐增强,而摄取、加工处理抗原的能力逐渐减弱,并同时向淋巴器官迁移,逐渐分化成熟,增殖并分泌多种细胞因子,最终发育为成熟树突状细胞(mature dendriticcells,mDC)[5]。本实验应用的DC2.4细胞株是首先将GM-CSF转染C57BL/6小鼠骨髓培养细胞,然后再转染myc和raf癌基因而建立的永生化细胞株[11]。DC2.4具有很强的吞噬功能,是一种标准的用于DC研究用的未成熟的细胞系,目前多用于抗肿瘤的免疫治疗。
DC的免疫功能有赖于其表面免疫分子的表达情况,DC对抗原多肽的提呈除需MHCⅡ类分子的参与外,T细胞的激活还需要其表面所表达的共刺激分子、黏附分子的参与。本实验研究了浓度为12.5 μg/mL的甘草甜素对DC2.4表型和功能的影响,研究结果表明,甘草甜素刺激后的树突状细胞形态不规则,表面粗糙,有层叠状的皱襞,细胞表面有长短不等的大量树枝样突起,细胞表面高表达MHCⅡ、CD86、CD40分子,且DC激活T细胞能力及T细胞增殖能力增强,提示甘草甜素通过促进DC膜免疫分子的表达进而明显提高DC抗原的提呈功能。此外,本研究还发现12.5 μg/mL的甘草甜素降低了细胞内酸性磷酸酶的活性,酸性磷酸酶是溶酶体内主要的效应酶,酸性磷酸酶含量的下降说明溶酶体含量的减少,间接说明DC吞噬抗原的能力减弱,递呈能力加强,细胞趋向成熟。包括DC在内的许多免疫细胞可分泌IL-12因子,主要作用于T细胞和NK细胞,参与调节细胞免疫应答,DC在非刺激状态即可产生IL-12,在受到细菌、病毒或其自身表面分子的配体的刺激下分泌更明显[12]。IL-12还有强大的诱生干扰素的作用,故DC可通过IL-12介导Th1型免疫反应,从而促进细胞免疫应答,本实验经检测DC的培养上清中IL-12的含量,发现甘草甜素能够促进IL-12的表达。IL-12是DC的功能性产物,其含量的增高以及抗原提呈方面的成熟和形态学上的成熟是对应的,IL-12含量的增加可以进一步促进CD4+T细胞增殖,增强CTL杀伤活性,刺激T细胞和NK细胞产生INF-γ,抑制IgE合成。
甘草甜素是从中药甘草提取的有效成分,具有免疫调节的作用。本实验应用甘草甜素体外对DC2.4细胞株诱导培养出了表达成熟免疫表型的DC,并具有显著的刺激T细胞增殖的作用,可特异性激活T细胞,同时可促进DC功能性产物IL-12表达的增高。研究结果不仅为今后DC的诱导提供了一条经济便捷的途径,而且为甘草甜素免疫治疗提供了理论依据。
[1] Steinman RM.The dendritic cell system and its role in immunogenic-city[J].Annu Rev Immunol,1991,(9):271-296.
[2] Banchereau J.,Steinman RM.Dendritic cell and the control of immunity[J].Nature,1998,392(6673):271-296.
[3] Chung WT,Lee SH,Kim JD,et al.Effect of the extracts from Glycyrrhiza uralensis Fisch on the growth characteristics of human cell lines:Anti-tumor and immune activation activities[J].Cytotechnology,2001,37(1):55-64.
[4] Ashfaq UA,Masoud MS,Nawaz Z,et al.Glycyrrhizin as antiviral agent against Hepatitis C Virus[J].J Transl Med,2011,(9):112.
[5] Bancherau J,Briere F,Caux C,et al.Immunobiology of dendritic cells[J].Ann Rev Immunol,2000,18:767-811.
[6] Liu YJ.Dendritic cell subsets and lineages,and their functions in innate and adaptive immunity[J].Cell,2001,106(3):259-262.
[7] Mosca PJ,Hobeika AC,Clay TM,et al.A subset of human monocyte-derived dendritic cells expresses high level of interleukin-12 in response to combined CD40 ligand and interferongamma treatment[J].Blood,2000,96(10):3499-3504.
[8] Lapointe R,Toso JF,Butts C,et al.Human dendritic cells require multiple activation signals for the efficient generation of tumor antigen-specific T lymphocytes[J].Eur J Immnol,2000,30(11):3291-3298.
[9] Nakajima N,Utsanomiya T,Kobayashi M,et al.In vitroinduction of anti-type 2 T cells by glycyrrhizin[J].Burns,1996,22(8):612-617.
[10] Yoshikawa M,Matsui Y,Kawamoto H,et al.Effects of glycyrrhi-zin on immune-mediated cytotoxicity[J].J Gastroenterol Hepatol,1997,12(3):243-248.
[11] Shen Z,Reznikoff G,Dranoff G,et al.Cloned dendritic cells can present exogenous antigens on both MHC class I and II molecules[J].J Immunol,1997,158(6):2723-2730.
[12] Lutz MB,Assmann CU,Girolomoni G,et al.Dif-ferent cytokines regulate antigen uptake and presentation of a precursor dendritic cell line[J].Eur.J Immunol,1996,26(3):586-594.

