迟钝爱德华氏菌菌蜕系统的构建
牟为,管玲玉,王启要,刘琴,张元兴
(华东理工大学生物反应器国家重点实验室,上海200237)
迟钝爱德华氏菌(Edwardsiella tarda,E.tarda)是一种革兰阴性的兼性胞内寄生菌。该菌不仅是多种淡、海水养殖鱼类的致病菌,同时也能感染两栖类及哺乳类等。迟钝爱德华氏菌是目前在水产养殖中有极大危害的病原菌,目前已在许多种海洋鱼类养殖中引发病害造成了巨大损失[1-2]。它的感染能引起鱼类的出血性败血病,使其出现腹部积水肿胀、体表出血、肠内出现黏液等症状,称为爱德华菌病(Edwardsiellosis)[3-5]。用化学试剂或者抗生素控制此类细菌性鱼病会引起微生物的抗生素耐药性,有害物质残留和环境污染等影响,因此,以预防为目的的鱼用疫苗已成为防止渔业病害最为有效的方法。近年来,鱼用疫苗的发展相当迅速,疫苗的种类日益增多,其中多数为灭活疫苗(Killed vaccine),也有少数减毒活疫苗(Live attenuated vaccine)和亚单位疫苗(Subunit vaccine)等[4,6-7]。鱼类免疫的方法主要包括腹腔或肌肉内注射,浸泡和口服。这3种方法在实用性和成本方面均有各自的优缺点。注射免疫能有效利用抗原,获得较强的免疫效果,但易使鱼受伤,且费时费力,对较小的鱼不适用。浸泡免疫省时方便,但疫苗进入鱼体的效率和吸收效果受到多种因素限制,并且利用细菌减毒活疫苗进行浸泡免疫时,存在菌株返毒和与野生毒株发生重组导致新毒株出现的可能,有一定的安全隐患[6,8]。菌蜕(Bacterial Ghost,BG)是革兰阴性菌被噬菌体PhiX174裂解基因E裂解后形成的。lysisE基因并不导致宿主细胞完全裂解,而是引起细胞膜出现孔道,使得细胞内容物经由裂解孔道排出,形成不含核酸、核糖体及其他组分的几乎完好无损的空壳细胞[9-11]。传统的菌蜕系统是在温度诱导系统PI/pR-cI857转录控制下形成E基因的可控表达,当温度低于30℃时,热敏感阻遏蛋白cI857的表达使基因E能被稳定抑制,细菌正常生长;温度高于30℃时,因阻遏蛋白cI857的热失活而使基因E开始表达,细菌裂解形成菌蜕,在42℃时细菌的裂解达到最佳状态。铁是一种重要而必需的过渡金属元素,几乎所有的生物体都需要游离铁离子来进行呼吸作用和氧运输等,但是过量的铁也会造成机体损伤[12-13]。因此,微生物在进化过程中生成了多种调控系统以严格控制铁元素的摄取和释放。多数细菌铁摄取系统在铁丰富的环境中并不表达,主要原因是其编码基因的-35至-10区通常存在着一个Fur蛋白结合盒(Fur box)。Fur是一种铁依赖性的全局调控因子(Global regulator),存在于各种细菌铁摄取系统,在大肠埃希菌中超过90种基因的表达受Fur调控。其中35种与铁摄取相关的基因在富铁环境中受Fur严格抑制,保证铁转运系统受到铁浓度的严格调控[14-16]。本研究利用受铁浓度调控的启动子PyncE[15,17]来构建新型的迟钝爱德华氏菌菌蜕系统,研究并比较其裂解效率、制备条件、菌体形态与传统菌蜕的区别,为进一步研究高效的菌蜕疫苗奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒E.coli Top10F'为本实验室保藏,含有大质粒pEIB202的E.tarda EIB202菌株为本实验室前期分离得到,所有菌株于-80℃保存于含20%甘油的LB培养基中。商业化原核表达质粒pUC18、pBV220为本实验室前期购买保藏(Invitrogen),菌蜕质粒pPR-cI-Elysis为Lubitz W教授惠赠。
1.1.2 主要试剂本实验所需的常规化学试剂主要采购自中国医药集团上海化学试剂公司。限制性内切酶SalⅠ、HindⅢ以及PCR所用DNA聚合酶(Pyrobest DNA polymerase)、DNA连接试剂盒(DNA ligation kit 2.0)均购自宝生物(TaKa-Ra),普通Taq酶预混反应液(2×Taq Marster Mix)及质粒抽提、胶回收试剂盒、DNA产物纯化试剂盒均购自天根生化(Tiangen,北京)。
1.1.3 主要仪器电泳仪、琼脂糖电泳槽、iCycler PCR反应仪以及酶标仪购自BIORAD公司;FR-200紫外与可见分析装置购自上海复日生物工程公司;扫描电子显微镜(Hitachi S-2400)购自Olympos公司。
1.2 方法
1.2.1 质粒构建常规DNA技术操作参照文献[18]进行,所用引物见表1。裂解基因lysisE通过PCR从PhiX174基因簇上得到,PR-cI857调控系统从质粒上获得,铁调控启动子PyncE及其上游序列来源于E.coli TOP10基因组。用overlap PCR的方法分别将两类启动子与lysisE基因融合,扩增出的融合片段PR-E和PyncE-E用SalⅠ、HindⅢ酶切到表达质粒pUC18中,构建重组质粒,分别命名为LPR-E/pUC18和PyncE-E/pUC18。
1.2.2 迟钝爱德华氏菌菌蜕制备及检测将上文构建的2种质粒LPR-E/pUC18、PyncE-E/pUC18电转化至E.tarda EIB202感受态细胞,得到的阳性菌株接种于含有Ampr抗性的LB液体培养基中,28℃200 r/min摇床过夜培养;次日,2重组

表1 所用引物列表Table 1 Primers used in this study
1.2.3 扫描电镜观察将诱导后生成的E.tarda菌蜕用2.5%戊二醛4℃固定2 h后用PBS洗涤3次,经乙醇逐级脱水和醋酸异戊脂置换等步骤处理后,将细胞进行冷冻干燥,用含银离子的包埋剂处理后即可进行扫描电镜(Hitachi S-2400)观察。
2 结果与分析
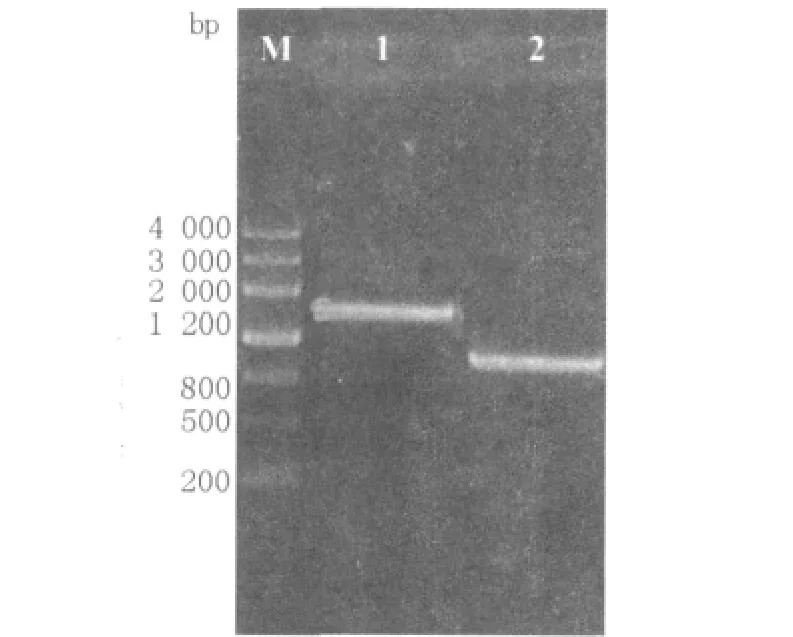
图1 融合片段PR-E和PyncE-E的overlap PCR扩增产物验证Fig.1 Overlap PCR amplification of PR-E and PyncE-E
分别以菌蜕质粒pPR-cI-Elysis和E.coli Top10F'染色体DNA为模板,利用PCR扩增出裂解基因lysisE、温度诱导启动子PR和铁调控启动子PyncE(图1),胶回收纯化后的产物进行重叠延伸(overlap)-PCR,得到融合片段LPR-E和PyncEE。将融合片段经酶切SalⅠ、HindⅢ后连接到pUC18中,构建重组质粒LPR-E/pUC18和PyncEE/pUC18。将连接液电转化入E.tarda EIB202,并对其转化子进行菌落PCR检测,经1%琼脂糖电泳后,分别出现1 543 bp和874 bp的条带,其结果跟预期的一致,测序后发现无突变碱基,说明重组质粒LPR-E/pUC18、PyncE-E/pUC18已经成功转化进入E.tarda EIB202中。
2.2 菌蜕系统生成效率检测
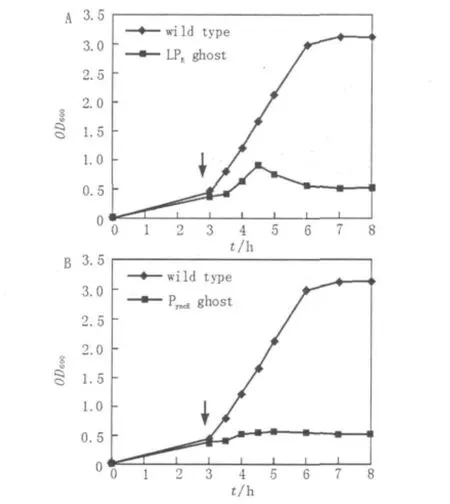
图2 菌蜕系统对E.tarda的溶菌过程Fig.2 Growth curves of E.tarda harboring plasmidPyncE-E/pUC18 or PR-E/pUC18
将重组菌株E.tarda EIB202(LPR-E/pUC18)在28℃培养至对数中期,将菌株在42菌株分别转接种于30 mL Ampr抗性的LB液体中,28℃200 r/min摇床培养至OD600为0.3~0.5时,将含有PR-E/pUC18的菌株移至42℃摇床中培养,在含有PyncE-E/pUC18的菌株加入铁离子螯合剂二联吡啶后继续28℃培养。自此,每30 min取样,测OD600的吸光度值,直到诱导后培养物的OD600趋于平稳为止。
2.1 菌蜕系统构建
℃环境下继续培养,诱导lysis E表达。如图2A所示,细菌在继续生长一段时间后开始裂解,在温度升高后1.5 h,可检测到OD600开始下降,OD600的检测数值从0.92持续下降到0.48,至诱导后4 h开始趋于平稳。同样,将重组菌株E.tarda EIB202(PyncE-E/pUC18)在28℃培养至对数生长中期,在培养基中加入铁螯合剂二连吡啶诱导lysisE表达。结果如图2B显示,诱导后菌株即停止生长。这说明E蛋白能够在2套ghost系统中正常表达,并对宿主菌E.tarda EIB202产生致死或抑制其生长的作用。随后的菌落涂板实验也证实实际活菌数量与OD600所显示情况相符。
2.3 扫描电镜观察
扫描电镜观察如图3所示,大多数传统菌蜕E.tarda EIB202(LPR-E/pUC18)在诱导后生成空泡状结构,细菌的细胞两极可见直径之间的溶菌孔道和部分胞内物质,说明E蛋白能够融合在迟钝爱德华氏菌的形成特异性跨膜通道,并使得细菌内外渗透压发生改变,从而使内含物流出。而新型菌蜕E.tarda EIB202(PyncE-E/pUC18)诱导后的细菌有一些并未全部裂解或形成孔道结构,仅有部分形成了致死的菌蜕细胞,但由于胞内压力和部分胞内物质被溶解等原因,铁诱导表达系统介导的菌蜕使细菌表面形态有明显的皱缩和拉长等现象。

图3 扫描电镜观察菌蜕形成情况Fig.3 Scanning electron micrograph of E.tarda ghost
3 讨论
菌蜕作为新型非活性疫苗,能够保持与活细菌相同的完好形态结构,可诱导机体产生体液免疫和细胞免疫,包括黏膜免疫,并且不具有活菌疫苗的致病作用[9]。同时,由于菌蜕保留有细菌的菌毛、纤毛,具有生物亲和性,能够进行特异的细胞和组织定位,可用作核酸和药物的亲和性载体。利用菌蜕系统作为抗原载体接收大量的外源抗原或重组蛋白,将这些抗原蛋白通过特定的膜锚定结构插入细胞膜,或填充于胞周间隙和细胞空腔中,可以获得重组菌蜕多价苗和多联苗[19-20]。之前的研究表明,细菌菌蜕特别适合作为黏膜免疫的疫苗运送系统,通过口服途径也可激发体液和细胞免疫应答[21-23],但由于传统的菌蜕生成调控系统是依靠温度调控,因此,该系统要求在30℃以下的条件进行细菌的培养,而许多病原菌在这一温度培养时很难达到正常的生长。因而,开发新型的可调控系统将有利于菌蜕疫苗的生产。
本研究利用细菌在生长过程中严格受铁调控这一特性,挑选出一个铁调控型启动子PyncE,并以此为基础构建了新型的铁调控菌蜕系统。因为在细菌普通培养基LB中含有丰富的游离铁离子,正常培养时受Fur蛋白调控的PyncE在丰富铁环境下不表达裂解lysisE基因,而当培养基中加入铁螯合剂后,因为铁离子缺乏,PyncE开启转录表达,使得细菌裂解。
与传统菌蜕受到诱导后大量死亡不同,铁调控菌蜕能够让宿主菌在诱导后保持低密度生长。
电镜结果表明,铁调控菌蜕除生成孔洞外,还有一些因内部裂解压力而发生拉伸,细菌分化不完全等现象,这可能与PyncE与LPR启动效率不同有关,说明在不同的启动子调控下,菌蜕会出现不同的形式。目前,利用细菌菌蜕作为抗原呈递载体已成为疫苗开发的热点,本实验中构建新型的调控系统,使得细菌在维持少量生存的情况下形成菌蜕,对以后迟钝爱德华氏菌菌蜕疫苗及载体疫苗的开发和设计奠定了基础。
[1] 单晓枫,高云航,李影.鱼用疫苗研究进展[J].中国兽药杂志,2005,39(11):19-22.
[2] Sakazaki R,Murata Y.The new group of the Enterobacteriaceae,Jap[J].J.Bacteriol,1962,17(13):616-617.
[3] Brenner DJ,Fanning GR,Steigerwalt AG.Polynucleotide sequence relatedness in Edwardsiella tarda[J].J.Syst.Bacteriol,1974,24(21):186-190.
[4] Castro N,Toranzo AE,Barja JL,et al.Characterization of Edwardsiella tarda strains isolated from turbot,Psetta maxima[J].J.Fish.Dis,2006,29(14):541-547.
[5] Chowdhury R,Wakabayshi H.Survival of four major bacterial fish pathogens in different types of experimental water[J].J.Microbiol,1990,7(16):47-54.
[6] Gudding R,Lillehaug A,Evensen O.Recent developments in fish vaccinology[J].Vet.Immunol.Immunopathol,1999,72(11):203-212.
[7] Smith GP.Filamentous fusion phage:novel expression vectors that display cloned antigens on the virion surface[J].Science,1985,228(21):1315-1317.
[8] Sang YL,Jong HC,Xu ZH.Microbial cell-surface display[J].Trends.Biotechnol,2003,21(31):45-52.
[9] Detmer A,Glenting J.Live bacteria vaccines:a review and identification of potential hazards[J].Microbial.Cell.Factories,2006,5(12):23-26.
[10] Witte A,Wanner G,Sulzner M,et al.Dynamics of PhiX174 protein E-mediated lysis of Escherichia coli[J].Arch.Microbiol,1992,157(31):381-338.
[11] Serruto D,Rappuoli R.Post-genomic vaccine development[J].FEBS.Letters,2006,580(21):2985-2992.
[12] Dill BD,Raulston JE.Examination of an inducible expression system for limiting iron availability during Chlamydia trachomatis infection[J].Microbes.Infect,2007,9(41):947-953.
[13] Ratledge C,Dover LG.Iron metabolism in pathogenic bacteria[J].Annu.Rev.Microbiol,2000,54(17):881-941.
[14] Wooldridge KG,Williams PH,Wanner G.Iron uptake mechanisms of pathogenic bacteria FEMS[J].Microbiol.Rev,1993,12(13):325-348.
[15] McHugh JP,Rodriguez F,Abdul H,et al.Global iron-dependent gene regulation in Escherichia coli.A new mechanism for iron homeostasis[J].J.Biol.Chem,2003,278(41):29478-29486.
[16] Stojiljkovic I,Baumler J,and Hantke K.Fur regulon in gramnegative bacteria.Identification and characterization of new iron-regulated Escherichia coli genes by a fur titration assay[J].J.Mol.Biol,1994,236(31):531-545.
[17] Baba-Dikwa A,Thompson D,Spencer NJ,et al.Overproduction,purification and preliminary X-ray diffraction analysis of YncE,an iron-regulated Sec-dependent periplasmic protein from Escherichia coli[J].Acta.Crystallogr.Sect.F.Struct.Biol.Cryst.Commun,2008,64(11):966-969.
[18] Sambrook J,Russell DW.黄培堂等译.分子克隆实验指南(第3版)[M].北京:科学出版社,2002.
[19] Eko FO,Witte A,Huter V,et al.New strategies for combination vaccines based on the extended recombinant bacterial ghost systern[J].Vaccine,1999,17(41):1643-1649.
[20] Schon P,Sehrot G,Lubitz W,et al.Two-stage model for integration of the lysis protein E of PhiX174 into the cell envelope of Escherichia coli[J].FEMS.Microbiol..Rev,1995,17(11):207-212.
[21] Huter V,Hensel A,Brand E,et al.Improved protection against lung colonization by Actinobacillus pleuropneumoniae ghosts:characterization of a genetically inactivated vaccine[J].J.Biotechnol,2000,83(21):161-172.
[22] Jalava K,Hensel A,Szostak MP,et al.Bacterial ghosts as vaccine candidates for veterinary applications[J].J.Control.Release,2002,85(17):17-25.
[23] Mayr UB,Hailer C,Haidinger W,et al.Bacterial ghosts as an oral vaccine:a single dose of Escherichia coli O157∶H7 bacterial ghosts protects mice against lethal challenge[J].Infect.Immun,2005,73(51):4810-4817.

