溶胶—凝胶法制备Nd掺杂纳米TiO2
朱晓东,白 昱
(1.成都大学工业制造学院,四川成都 610106;2.成都印钞有限公司,四川成都 611130)
0 引 言
纳米TiO2具有独特的颜色效应、光催化作用及紫外屏蔽等功能,在汽车工业、防晒化妆品、废水处理、空气净化及环境保护等领域有广泛的应用[1-5].但研究者在对其应用研究中发现,由于其结构关系,要想成为一种好的光催化材料,TiO2还存在一些缺陷,主要表现在:带隙较宽,仅能吸收波长小于387.5 nm的紫外光,而辐射到地面的紫外光部分仅占太阳光的3%~5%[6],太阳能的利用率极低;光生电子—空穴对的复合率较高,导致光催化活性降低;大规模工业化应用时存在如回收困难等不便.为了克服这些缺陷,科研人员在提高TiO2光催化剂结构和性能、开拓新应用领域等方面作了大量的深入研究.例如,在半导体材料中掺入微量杂质原子或离子(简称掺杂)来调节半导体的性能,采用恰当的方法将稀土元素掺杂到半导体纳米材料中等.
稀土离子掺杂,是利用物理或化学方法将稀土离子引入到TiO2晶格中,从而在其晶格中引入新电荷、形成缺陷或改变晶格类型,导致TiO2的结构特性、电子特性、光学特性发生改变.在稀土掺杂纳米TiO2的制备方面,不同方法所制备的掺杂纳米TiO2的形状、尺寸、表面结构等物化性质存在差异,各种方法的技术难度和制备成本也不尽相同.目前,主要有以下几种制备方法:溶胶—凝胶法,浸渍法,水热合成法,醇盐水解法和均匀沉淀法[7-12].
溶胶—凝胶法是20世纪80年代迅速发展起来的湿化学合成方法,被广泛应用于各种无机功能材料的合成当中.该方法在常温或近似常温下把金属醇盐溶液加水分解,同时发生缩聚反应制成溶胶,进一步反应形成凝胶,再进行高温煅烧处理,即可制得纳米级氧化物粉末.由于溶胶—凝胶技术从纳米单元开始,在纳米尺度上进行反应,最终制备出具有纳米结构特征的材料,且是一种低温制备纳米结构材料的特殊工艺,特别适于掺杂纳米氧化物的制备[7].基于此,本文选择溶胶—凝胶法制备稀土元素Nd掺杂纳米TiO2以及纯纳米TiO2.
1 纳米TiO2的溶胶—凝胶法制备
1.1 溶胶—凝胶法反应步骤
溶胶—凝胶法主要反应步骤为前驱物溶于溶剂(水或有机溶剂)中形成均匀的溶液,溶质与溶剂产生水解或醇解反应,反应生成物聚集成纳米尺度粒子并形成溶胶,溶胶经蒸发干燥转变为凝胶.其基本反应如下:
(1)溶剂化.金属盐的阳离子MZ+吸引水分子形成溶剂单元M(H2O)nZ+(Z为M离子的价数),并释放出H+,
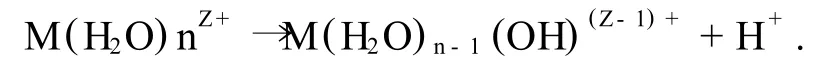
(2)水解反应.金属醇盐M(OR)n(n为金属M的原子价,R代表烷基)与水反应,
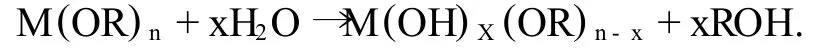
反应可延续进行,直至生成M(OH)n.
(3)缩聚反应.其可分为,
失水缩聚,

失醇缩聚,

1.2 溶胶—凝胶法的工艺参数选择
由于钛醇盐的水解速度很快,其水解反应和缩聚反应几乎同时发生,因而不能独立地描述水解和缩聚反应,但通过控制反应条件,可以得到预期结构的材料.其主要的影响因素参数选择如下.
1.2.1 醇盐与溶剂的选择.
(1)醇盐的选择.由于,同一种元素的不同醇盐的水解速率不同,随着C链的增长,醇盐电负性降低,Ti(OR)4接受电子的能力变差,使Ti4+易与·OH配位.因此,随着烷基中C原子数增加,醇盐的水解速率下降.故应选择水解动力学稳定性差即配位基团小的金属醇盐作为反应前驱体.另外,随着醇盐浓度的增大,水解反应加快,凝胶化时间缩短,但如果浓度过高,水解缩聚产物聚合度过高,容易引起粒子的聚集沉淀,但凝胶化时间过短,反应不易控制.在实验中,醇盐选择钛酸丁酯.
(2)溶剂的选择.金属醇盐水解反应是亲核试剂OH-与金属M的亲核反应,反应过程中亲核试剂被溶剂分子包围.随着溶剂配位基C链增长,电负性减弱,亲核试剂与M结合能力增强,为除掉亲核试剂周围的一部分溶剂分子,使溶剂与醇盐接触发生反应,必须付出更多的能量.同时,醇分子中的烃基对酸与水的缔合有空间阻碍作用,烃基愈大,阻碍作用愈大,生成氢键能力减小,使水解反应变慢,成核诱导时间变长,体积平均粒径增加,单分散性能更好.因而,溶剂配位基的选择应与底物相同或相近,其作用是把多相溶液调成均相.在实验中,采用乙醇作溶剂.
此外,乙醇的加入量也要合适,如果加入过多,将会延长凝胶时间.其原因是醇不但抑制水解反应,还会发生酯醇反应,溶剂和醇盐的OR差别愈大,转化率愈高,而且醇量的增加必然导致金属醇盐浓度下降,使已水解的金属醇盐分子之间的碰撞机率下降,对缩聚反应也不利;但如果醇的加入量太少,会导致金属醇盐浓度过高,水解缩聚产物浓度过高,也容易引起粒子的聚集或沉淀.根据以上分析,实验中,我们选择钛酸丁酯为前驱体,乙醇作为溶剂,乙醇与钛酸丁酯的比例为2.5∶1.
1.2.2 水 量.
加水量的多少直接影响水解缩聚产物的结构.水量过少,醇盐水解速度慢,醇盐分子上水解形成的-OH基团少,其缩聚易于形成低交联度的产物.反之,则易于形成高度交联的产物.同时,当加水量小于水解化学计量水量时,则随着金属醇盐M(OR)n中烷基R的增加,溶胶的粘度增大,凝胶化时间缩短;当加水量过多时,由于过量水冲淡了缩聚物的浓度,则随R的增加,粘度下降,凝胶化时间延长.此外,如果加水量过多,将会使凝胶的干燥收缩和干燥应力增加,从而延长干燥时间.在实验中,确定钛醇盐和水的比例为2∶1.
1.2.3 抑制剂.
抑制剂的作用在于控制钛酸丁酯的水解反应速度,从而进一步控制所制备纳米材料的尺寸.一般认为,在酸抑制体系中,水解反应主要是H3O+对OR基的取代反应,而在碱抑制体系和不加抑制剂的体系中,水解反应主要是OH-对OR基的取代反应.由于抑制机理不同,对同一种醇盐的水解缩聚,酸抑制和碱抑制将产生结构和形态完全不同的水解产物.在实验中,采用冰乙酸作抑制剂.
1.2.4 反应温度.
从反应动力学角度考虑,温度升高,水解速率增大,缩聚速率也增大,并且原料易挥发,得到产品的粒径将会增大;而温度降低,水解速率降低,缩聚速率降低,凝胶化时间变短,此时产品粒径减小.同时,醇盐的水解反应是微放热可逆反应.综合考虑,温度不宜过高或过低,选择反应温度在25~30℃之间.
2 实验及分析
2.1 试样制备
在实验中,我们采用溶胶—凝胶法制备稀土元素Nd掺杂纳米TiO2及纯纳米TiO2试样,具体步骤为:
(1)先将适量的0.1 mol硝酸钕溶液加入到10 mL冰醋酸、40 mL无水乙醇与10 mL蒸馏水的混合液中,充分搅拌后得到溶液A.
(2)将20 mL的钛酸丁酯与50 mL无水乙醇均匀混合得到溶液B,置于分液漏斗中.
(3)在剧烈搅拌下将溶液B逐滴加入到溶液A中,滴加完毕后继续搅拌2 h以形成均匀透明的稀土元素Nd掺杂TiO2溶胶,然后室温放置陈化,以形成凝胶.
(4)将凝胶在100℃下烘干,研磨并过400目筛后得到样品粉体.
(5)样品粉体在500℃下焙烧3 h后最终得到Nd掺杂纳米TiO2.
同时,在A溶液中不添加稀土盐溶液制得的粉体为纯纳米TiO2.
2.2 结果分析
将制得的稀土元素Nd掺杂纳米TiO2及纯纳米TiO2试样采用透射电镜(TEM)表征粉体形貌,结果如图1所示.从图1中可以看出,溶胶—凝胶法制备的纯纳米TiO2与Nd掺杂纳米TiO2粒子大部分呈球形,基本由小粒子组成,纯纳米TiO2粒径在12 nm左右,掺杂Nd5%-TiO2粒径在8 nm左右.

图1 纯纳米TiO2和掺杂纳米Nd5%-TiO2的TEM图
3 结 论
采用溶胶—凝胶法制备稀土元素Nd掺杂纳米TiO2以及纯纳米TiO2的具体参数为:乙醇与钛酸丁酯的比例为2.5∶1,钛醇盐和水的比例为2∶1,选用冰乙酸作抑制剂,反应温度为25~30℃.经过形成溶胶、凝胶以及焙烧研磨后得到稀土元素Nd掺杂纳米TiO2以及纯纳米TiO2粉体试样.经TEM分析表明,试样的粒子大部分呈球形,纯纳米TiO2粒径在12 nm左右,掺杂纳米Nd5%-TiO2粒径在8 nm左右,均达到了纳米级别.
[1]Hagfeldt A,Gratzel M.Light-induced Redox Reactions in Nanocrystalline Systems[J].Chemical Reviews,1995,95(1):49-68.
[2]Fox MA,Dulay M T.Heterogeneous Photocatalysis[J].Chemical Reviews,1993,93(1):314-357.
[3]Hoffmann M R,Martin S T,Choi W,et al.Environmental Applications of Semiconductor Photocatalysis[J].Chemical Reviews, 1995,95(1):69-96.
[4]Stafford U,Gray KA,Kamat P V.Photocatalytic Degradation of Organic Contaminants,Halophenols and Related Model Compounds,Heterogeneous[J].Chemistry Reviews,1996,96(3):77 -104.
[5]Iwasaki M,Hara M,Kawada H,et al.Cobalt Iondoped TiO2Photocatalyst Response to Visible Light[J].Journal of Colloid Interface Science,2000,224(1):202-204.
[6]李慧泉,周新木,李越湘.稀土掺杂二氧化钛光催化的研究进展[J].江西化工,2003,19(4):81-84.
[7]Li X Z,Li F B,Yang CL,et al.Photocatalytic Activity of WOx-TiO2Under Visible Light Irradiation[J].Journal of Photochemistry and Photobiology(A):Chemistry,2001,141(2-3):209-217.
[8]Xu A W,Gao Y,Liu H Q.The Preparation,Characterization, and their Photocatalytic Activities ofRare-Earth-Doped TiO2Photocatalysts[J].Journal of Catalysis,2002,207(2):151-157.
[9]Bahtat A,Bouazaoui M,Bahtat M,et al.Fluorescence of Er3+Ions in TiO2Planar Waveguides Prepared by a Sol-gel Process [J].Optics Communications,1994,111(1-2):50-60.
[10]He C,Yu Y,Hu X F,et al.Influence of Silver Doping on the Photocatalytic Activity of Titania Films[J].Applied Surface Science,2002,200(1-4):239-247.
[11]Ohno T,Tanigawa F,Fujihara K,et al.Photocatalytic Oxidation of Water by Visible Light Using Ruthenium-doped Titanium Dioxide Powder[J].Journal of Photochemistry Photobiology (A):Chemistry,1999,127(1-3):107-110.

