含单种杂原子的桥联杯芳烃的合成研究进展
张德春,王文革
(湖南工学院材料与化学工程系,湖南衡阳421002)
含单种杂原子的桥联杯芳烃的合成研究进展
张德春,王文革
(湖南工学院材料与化学工程系,湖南衡阳421002)
综述了含单种杂原子的桥联杯芳烃的合成研究进展。目前合成的大多数的杯芳烃都是碳桥联的,除了碳,如硼、硅、锗、锡、氮、磷、氧、硫、硒原子都可以作为桥联原子建构杯芳烃,其中硅、氮、氧、硫桥杯芳烃报道文献较多,介绍了含单种杂原子的桥联杯芳烃的合成条件及其应用。
超分子化学;大环化合物;杯芳烃;有机合成;桥联原子
杯芳烃最初是由德国的化学家Baeyer在酚醛实验中偶然得到的一种高熔点、难溶的化合物。100多年来,关于杯芳烃及其衍生物的合成和性质研究受到国内外学者的广泛关注。
杯芳烃中的芳香单元可以自由旋转,因此杯[4]芳烃呈现4种构象异构体:锥形、部分锥形、1,3-交替和1,2-交替;与杯[4]芳烃相比,杯[n]芳烃(n=5-8)的环径增大,空间自由度更大,所以可以有更多的构象变化:比如杯[6]芳烃共有8种可能的构型[1];杯[7]芳烃和杯[8]芳烃由于环较大,进行修饰中存在更多问题,所以对这两类化合物进行构型固定的报道较少。
杯芳烃的合成主要有多步合成法和一步合成法。多步合成法步骤多、收率低,但在设计和合成一些特殊的具有不对称取代基杯芳烃时应用较多。一步合成法步骤少、一锅操作简单、收率相对较高,促进了杯芳烃的广泛合成及应用。
本文将对不同桥联原子的杯芳烃的合成进行讨论。
1 非杂原子构建的桥联杯芳烃
非杂原子构建的桥联杯芳烃是指桥联原子为碳原子的杯芳烃。目前合成的大多数的杯芳烃都是碳桥联的,而且几乎所有的应用研究也都是以这类杯芳烃为基础的,这里就不详细说明了。
2 单种杂原子构建的桥联杯芳烃
2.1 硼桥联杯芳烃
1998年Carre等[2]报道了第一个硼桥联化合物,它是以N,N-二异丙基二(2-噻吩)硼胺为原料先与LiTMP作用生成负离子,再与Cl2BN(i-Pr)2反应制备的,产率62%。通过X-射线晶体衍射试验测定它是1,2-交替结构。2002年,Koehler等[3]用类似的方法将N-甲基吡咯单元引入大环合成了噻吩和N-甲基吡咯单元交替的硼桥联杯[4]芳烃。
2.2 硅桥联杯芳烃
硅与碳属于同族元素,性质相近,硅桥杯芳烃的合成方法却于碳桥联杯芳烃不同。1991年Wildeman等[4]通过二甲基硅桥联的二噻吩负离子制备了硅桥和双硅桥联化合物。1995年,Kǒnig等[5]通过芳杂环噻吩、呋喃以及N-甲基吡咯和二甲基二氯硅烷在去质子试剂正丁基锂的作用下得到一系列的硅桥联杯芳烃。硅桥联杯芳烃的合成工作发展迅速,研究人员[6]用各种类型的芳香环建构了硅桥联杯芳烃的骨架。一般情况,用丁基锂、四甲基乙二胺和硅试剂的方法一步就可以合成噻吩、呋喃、吡咯型的大环,苯环单元大环需要先生成硅桥联二苯化合物,再聚合生成大环。
2.3 锗桥联杯芳烃
1997年,Koenig等[7]合成化合物1及苯环单元大环和Barrau等[8]合成化合物2、3,填补了锗桥联杯芳烃的空白。呋喃、噻吩和N-甲基吡咯等杂环与锂化合物反应先生成单负离子后,与Me2GeCl2发生反应生成Me2Ge-桥联二聚物,二聚物的双负离子再与Me2GeCl2以1/1比例反应时,就生成大环化合物。
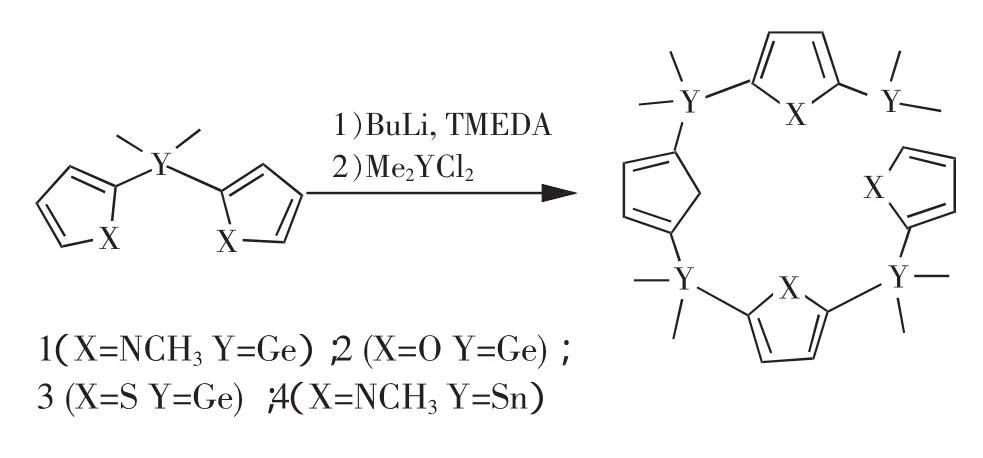
2.4 锡桥联杯芳烃
由于受到稳定性的限制,关于锡桥联杯芳烃的报道很少,仅有的文献使我们看到了建构锡桥联杯芳烃的可行性和难易性。
1995年,Koenig等[5]由N-甲基吡咯双负离子和Me2SnCl2反应合成了化合物4,。产率只有8%。由于它在空气中不稳定会迅速发生分解,有关应用研究没有报道。
2.5 氮桥联杯芳烃
氮桥杯芳烃合成方法多样,内容丰富,研究人员合成了多种不同芳香单元和不同大小的杯芳烃。1997年,Graubaum等[9,10]利用三氮烯和胺反应合成化合物5及类似化合物。1999年,Selby等[11]报道了用Ullmann反应,将2,7-二氨基萘和1,4-二碘苯、1,3-二碘苯一锅煮合成了具有萘环单元的杯[4]芳烃,产率分别为28%和21%。6[12]的报道显示了一锅煮方法的优越性,可以得到多个产物,六个产物的产率分别为1.6%、12.9%、5.6%、2.0%、3.3%和1.3%。最近两年,Hirohito Tsu工作组报道了用多步合成法合成氮桥联杯[4]和杯[8]芳烃[13,14],产率分别为37%和23%。王梅祥课题组[15~17]在氮桥杯芳烃方面极具特色,他们利用芳香二溴和芳香二胺类物质经过两步反应合成包含吡啶环的杯芳烃和嘧啶环的杯芳烃,其合成路线新颖,产物结构独特,丰富了氮桥联杯芳烃的内容。
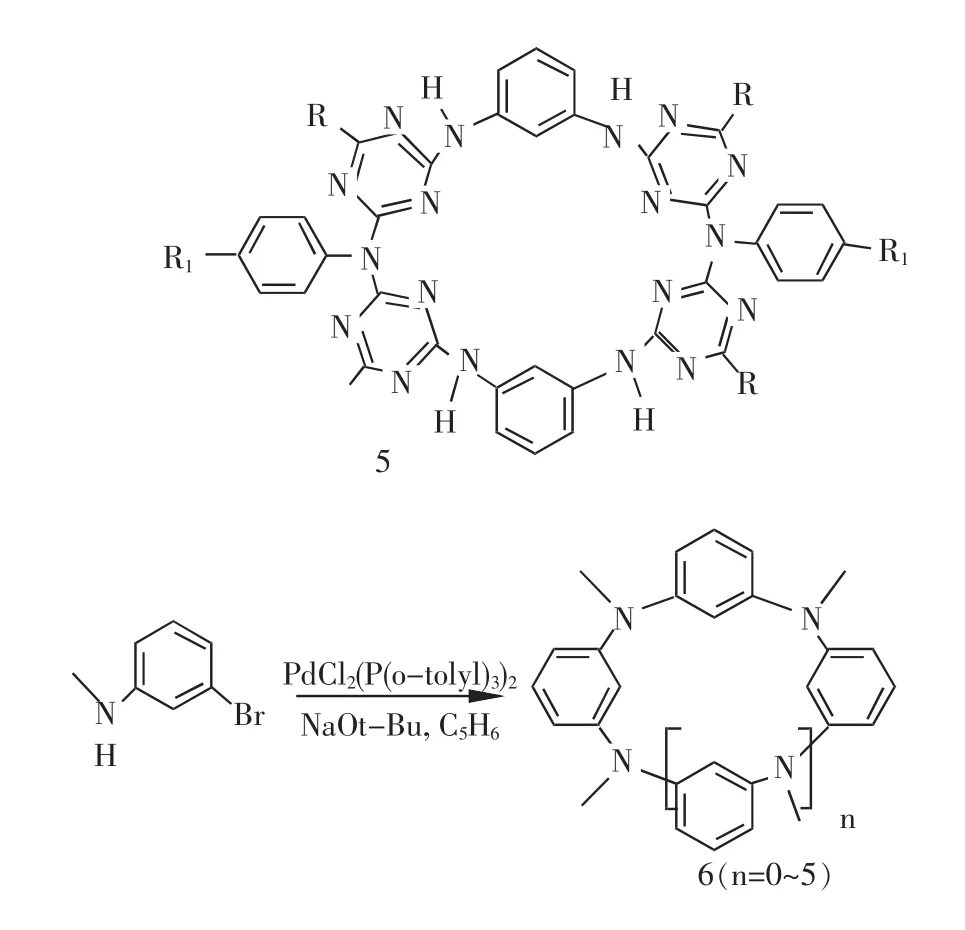
2.6 磷桥联杯芳烃
磷桥联杯芳烃报道极少。1995年B.kǒnig等[5]用PhPCl2与噻吩的2,5-双负离子一步反应得到两种异构体混合的磷桥大环,产率17%。它极易被氧化,这使得对此化合物与金属离子络合能力的研究难以进行。
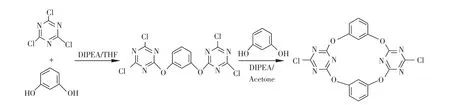
2.7 氧桥联杯芳烃
氧桥联杯芳烃可以看作是芳香冠醚,芳香单元构成的骨架使得它的结构更加刚性。Takeuchi[18]合成了多种邻位和对位的由6-10个苯环单元构成的大环化合物。王梅祥课题组[19~21]在氧桥杯芳烃的合成方面也很突出,通过两步反应将三氮烯单元引入到氧桥联杯芳烃当中,合成了7和类似的化合物,其中7的产率为47%,通过X-射线晶体衍射试验测定为1,3-交替结构。
2.8 硫桥联杯芳烃
硫桥联杯芳烃和亚甲基桥联杯芳烃相比,芳香大环结构的柔性增加,这使它与金属离子的配合能力增强。硫桥杯芳烃的合成方法主要有两种:硫化钠加热法和硫粉加热法。
硫化钠加热法:将间二溴苯和硫化钠混合加热,控制温度为200℃,可以生成多种大环,例如苯环硫桥联杯芳烃8的合成,总产率为35%。Ben等[22]和Nakayama等[23]利用该方法合成了吡啶环杯芳烃9和噻吩型硫桥联杯芳烃10。
硫粉加热法:在碱性条件下,把对叔丁基苯酚与硫粉加热到230℃,反应4 h。该方法产物后处理用沉淀或重结晶就可,操作方便容易,产率高,使硫杂杯芳烃的大量合成成为可能[24~26]。
此外,2001年,Hiroshi Katagiri[27]直接对杯芳烃骨架进行结构改造合成了一系列的羟基衍生化的硫桥杯[4]芳烃。由于羟基被氨基取代形成氢键的能力减弱,使得杯芳烃的构象由锥形构象变成1,3-交替构象。
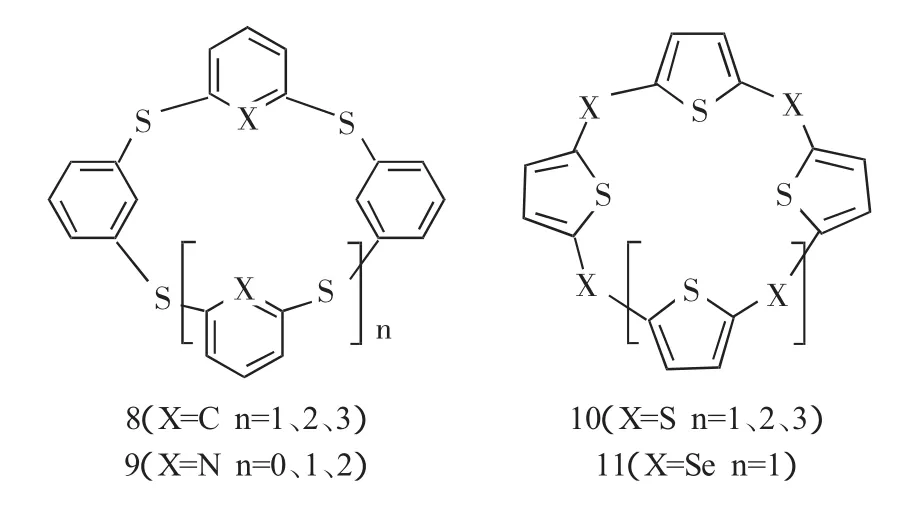
2.9 硒桥联杯芳烃
硒桥联杯芳烃早在七十年代就有报道。2002年,Kunnari等[28]合成了噻吩硒桥杯[4]芳烃11,对晶体结构进行测定证明它是1,2-交替结构。
3 结束语
以上综述了含杂单原子杯芳烃合成方面的研究进展,其中关于硅、氧、氮和硫的杯芳烃文献报道较多,可以看到不仅活泼的非金属原子可以桥联芳香单元形成杯芳烃,不活泼的非金属甚至金属都可以桥联芳香环建构杯芳烃。随着对杯芳烃化学的深入研究,将来会有更多种的元素原子参与建构新型杯芳烃。
[1]AIkeda,SShinkai.Novel CavityDesign UsingCalix[n]arene Skeletons:Toward Molecular Recognition and MetalBinding[J].Chem.Rev, 1997,97(5):1713-1734.
[2]FHCarré,RJPCorriu,TDeforthetal.ABoron-BridgedTetrathiaporphyrinogen[J].Angewandte Chemie,International Edition,1998,37 (5):652-654.
[3]TKöhler,HPritzkow,WSiebert.[3+1]-Cycloadditionswith Formation of Tetraboraporphyri-nogenes(In German)[J].Zeitschrift fuer Naturforschung,B:ChemicalSciences,2002,57(10):1101-1107.
[4]J Wildeman,J K Herrema,G Hadziioannou et al.Synthesis of poly[ (silanylene)thiophene]s[J].Journal of Inorganic and Organometallic Polymers,1991,1(4):567-580.
[5]BKǒnig,MRoedel,P?Bubenitschek et al.Synthesis,Structure,and Coordination PropertiesofSilicon-Bridged Macrocycles[J].Journalof OrganicChemistry,1995,60(23):7406-7410.
[6]STsutsui,KSakamoto.Preparation and structures ofnovel silamacrocycliccompounds:silacal-ix[4]quinoneandsilacalix[4]hydroquinone octamethyl ether[J].Chemical Communications(Cambridge,United Kingdom),2003,(18):2322-2323.
[7]B König,M Röde.Synthesis and Properties of Me2Ge-Bridged Arenes[J].Chemische Berichte/Recueil,1997,130(3):421-423.
[8]JBarrau,GRima,AAkkarietal.Polymericorganogermaniumsystems. Synthesis of poly[(germanediyl)thiophenes or furans]and poly[bis (2-thienyl)germanium][J].Inorganica Chimica Acta,1997,260(1): 11-15.
[9]HGraubaum,GLutze,BCostisellaetal.Polyazacalix[6]arene-SyntheseundNMR-Untersuch-ungenHerrnProf.Dr.D.Martin(Potsdam) zum 65.Geburtstag gewidmet[J].Journal fuer Praktis-che Chemie/ Chemiker-Zeitung,1997,339(7),672-674.
[10]H Graubaum,G Lutze,B Costisella.Polyazacalix[5]arene-Synthese und NMR-Untersuchun-genHerrn Prof.Dr.H.Schick zum60.Geburtstaggewidmet[J].Journalfuer PraktischeChemie/Chemiker-Zeitung,1997,339(3):266-271.
[11]TDSelby,SCBlackstock.MacrocyclicPolyArylaminesforRigidConnection ofPolyRadical Cation Spins[J].Organic Letters,1999,1(13): 2053-2055.
[12]A Ito,Y Ono,K Tanaka.N-Methyl-Substituted Aza(1n)metacyclophane:Preparation,Structure,and Properties[J].Journal of Organic Chemistry,1999,64(22):8236-8241.
[13]KIshibashi,HTsue,STokitaet.al.RegioselectivelyN-Methylated A-zacalix[8]arene Octamethyl Ether Prepared by Catalytic Aryl AminationReactionUsingaTemporalN-SilylationProtocol[J].OrganicLetters,2006,8(26):5991-5994.
[14]H Tsue,KIshibashi,H Takahashi et.al.ExhaustivelyMethylated Azacalix[4]arene:Preparation,Conformation,and Crystal Structure with ExclusivelyCH/π-Controlled Crystal Architecture[J].Organic Letters,2005,7(11):2165-2168.
[15]HYGong,XHZhang,DXWangetal.Methyazacalixpyridines:remarkable bridgingnitrogen tuned conformations and cavities with unique recognitionproperties[J].Chem.Eur.J.,2006,12:9262-9275.
[16]Bo Yao,De-Xian?Wang,Han-Yuan?Gong et al.Synthesis,structure and reactions ofNH-bridged calix[m]arene[n]pyridines[J].J.Org.Chem.,2009,74(15):5361-5368.
[17]Li-Xia Wang,De-Xian?Wang,Zhi-Tang?Huanget al.Synthesis and highlyselectivebrominationofazacalix[4]pyrimidinemacrocycles[J].J. Org.Chem.,2010,75(3):741-747.
[18]DTakeuchi,IAsano,KOsakada.SynthesisandStructureofCyclicOligo(p-phenyleneoxide)s,(C6H4O)n(n=6~10)[J].JournalofOrganicChemistry,2006,71(22):8614-8617.
[19]HBYang,DXWang,QQWangetal.J.EfficientFunctionalizationsof HeteroatomBridgedCalix[2]arene[2]triazineson theLarger Rim[J]. Org.Chem.,2007,72(10):3757-3763.
[20]Qi-QiangWang,De-Xian Wang,Qi-Yu Zhenget al.Formation and conformational conversion of flattened partial cone oxygen bridged calix[2]arene[2]triazines[J].Org.Lett.,2007,9(15):2847-2850.
[21]Bao-Yong Hou,De-Xian Wang,Hai-Bo Yang et al.Synthesis and structure of upper-rim 1,3-alternate tetraoxacalix[2]arene[2]triazine azacrowns and change of cavity in response to fluoride anion[J].J. Org.Chem.,2007,72(14):5218-5226.
[22]H BRomdhane,MBartholin et al.Polythioéthers à base de motifs 2,6-pyridinediyle,préparés par polycondensation par catalyse par transfert de phase[J].Comptes Rendus de l'Academie des Sciences, Serie II:Mecanique,Physique,Chimie,Sciences de la Terre et de l'Univers.1990,311(5):525-528.
[23]J Nakayama,N Katano,Y Sugihara et al.Cyclic Oligo(thio-2, 5-thienylenes)(Sulfur-bridged Calixarenes)[J].ChemistryLetters, 1997,9:897-898.
[24]H Fumio,H Yutaka,Y Kondo.Supramolecular assembly based on π-π stackingand π-cation interactions between thiacalix[6]arene andDMF[J].TetrahedronLetters,2006,47(31):5591-5593.
[25]D Buccella,G Parkin.Mononuclear and Dinuclear Molybdenum and Tungsten Complexes of p-tert-Butyltetrathiacalix[4]arene and p-tert-Butyltetrasulfonylcalix[4]arene:Facile Cleavage of the Calixarene Ligand Framework byNickel[J].J.Am.Chem.Soc.,2008, 130(27):8617-8619.
[26]H MColquhoun,B W Greenland,Z Zhu et al.A General Synthesis of Macrocyclic π-Electron-Acceptor Systems[J].Org.Lett.,2009, 11(22):5238-5241.
[27]HKatagiri,NIki,THattorietal.Calix[4]arenesComprised ofAniline Units[J].J.Am.Chem.Soc.,2001,123:779-780.
[28]S M Kunnari,R Oilunkaniemi,R S Laitinen et al.1,3,5,7-Tetraselena-2,4,6,8(2,5)-tetrathiop-henaoctaphane[J].ActaCrystallographica,Section C:Crystal Structure Comm-unications,2002,C58(10): o610-o611.
Progress on the synthesis of single heteroatom-bridged calixarenes
ZHANG De-chun,WANG Wen-ge
(Department of materials&Chemical Engineering,Hunan Institute of Technology,Hengyang Hunan 421002,China)
The progress on the synthesis of single heteroatom-bridged calixarenes was reviewed.At present Boron,Silicon,Ge,Nitrigen,Phosphor,Oxygen,Sulfur,Serium-bridged calixarens have been reported except for important carbon-bridged calixarens,and the synthetic conditions and applications of single heteroatom-bridged calixarenes were introduced in the paper.
supramolecular;macrocyclic;calixarenes;organic synthesis;bridge atom
10.3969/j.issn.1008-1267.2011.03.003
TQ25
A
1008-1267(2011)03-0008-04
2011-01-23
衡阳市科学技术局科技计划项目(2010KS42);湖南工学院科学研究项目(HY10009,HY09016)

