毕赤酵母表达风味强化肽的分离与纯化
田 雪,张宝持,白小佳,王艳萍
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457)
毕赤酵母表达风味强化肽的分离与纯化
田 雪,张宝持,白小佳,王艳萍
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457)
为了开发新型风味强化剂,采用硫酸铵分段盐析法、中空纤维超滤、阴离子交换树脂分离等方法,对构建的工程菌P.,postoris GS115-16B2发酵表达的16拷贝风味强化肽的分离纯化效果进行研究.实验结果表明,分离纯化最佳方法为:首先使用中空纤维进行超滤浓缩,经过两次稀释过滤浓缩后的浓缩液再采用离子交换树脂 DEAE–52进一步分离纯化.经SDS-PAGE检测,纯化后16拷贝风味强化肽的平均纯度可达93.19%.
毕赤酵母;风味强化肽;盐析;中空纤维超滤;离子交换树脂;分离纯化
风味强化肽最初是从牛肉的木瓜蛋白酶水解物中分离得到的一种八肽,它与食盐、味精有较好的协同呈味作用,并且具有很好的热稳定性,适合于食品工业生产中的热处理要求.因此,风味强化肽有望代替味精成为新一代风味强化剂,具有广阔的市场前景.
随着分子生物学的发展和应用,数百种外源蛋白实现了在毕赤酵母、酿酒酵母等表达体系中的成功表达[1–2],然而发酵液中目的蛋白难以分离纯化已成为影响其应用的主要问题.尤其是各种肽,由于其分子质量小,表达出来的产物难于分离[3].
本实验室构建出带有16拷贝风味强化肽的高效表达载体,并将其整合到毕赤酵母(Pichia pastoris)进行诱导表达[4].本文在前期工作的基础上,对构建的工程菌P. postoris GS115-16B2发酵表达的16拷贝风味强化肽的分离纯化方法作了探索性尝试,即分别运用硫酸铵分段盐析法、中空纤维超滤、阴离子交换树脂分离方法和两步分离法进行分离纯化,寻找出较好的分离纯化工艺.
1 材料与方法
1.1 材料
1.1.1 菌种
Pichia pastorisGS115-16B2,毕赤酵母基因组整合有16拷贝风味强化肽基因,由本实验室保存.
1.1.2 试剂与仪器
外源蛋白发酵样品由本实验室制备;DEAE–52阴离子交换树脂,南开大学化工厂;硫酸铵(分析纯),天津市天大化工实验厂.
中空纤维超滤膜(截留相对分子质量为 6,000、60,000),天津膜天膜公司;Power,PAC,3000电泳仪和全自动凝胶成像仪,美国Bio-Rad公司.
1.2 方法
1.2.1 发酵液预处理
将收集到的发酵液在 6,000,r/min离心 20,min,除去大部分菌体,然后加热到 100,℃煮沸 5,min,使大部分蛋白酶失活,迅速降温,于-20,℃储存备用.
1.2.2 硫酸铵分段盐析
一级盐析:取发酵上清液适量分装,每瓶200,mL.将硫酸铵烘干研细,按质量分数为 30%、35%、40%、45%、50%和 55%向发酵上清液中缓慢加入硫酸铵,不断搅拌至完全溶解,4,℃静置 2,h,6,000,r/min、4,℃离心 20,min,沉淀溶于蒸馏水中,透析,SDS-PAGE检测,找到目标蛋白16拷贝风味强化肽沉淀较少而杂蛋白沉淀最多时的硫酸铵质量分数.
二级盐析:取发酵上清液适量,按照一级盐析的最适硫酸铵质量分数盐析,然后将离心得到的上清液分装,每瓶 200,mL.向上清液中缓慢加入硫酸铵粉末,不断搅拌至完全溶解,使硫酸铵质量分数分别为60%、70%、80%和 90%.4,℃静置 2,h,6,000 r/min、4,℃离心20 min,弃上清液,将沉淀溶于蒸馏水中,透析,并取相对应的上清液进行透析,SDS-PAGE检测.
1.2.3 发酵上清液的中空纤维超滤
将预处理过的发酵液通过截留相对分子质量为60,000的中空纤维超滤膜,将小于60,000的超滤液再通过截留相对分子质量为6,000超滤膜,收集相对分子质量大于6,000的浓缩液,保存于-20,℃冰箱中.
1.2.4 阴离子交换层析分离
采用 DEAE–52层析柱(1.0,cm×40,cm),流量为0.5,mL/min,用4~5个柱体积的缓冲液平衡层析柱,含 NaCl 浓度分别为 0、0.10、0.15、0.20、0.25,mol/L的Tris-HCl(pH,7.0)缓冲液进行梯度洗脱.
回收率=(洗脱液中蛋白质量浓度×体积)/(原液蛋白质量浓度×体积)×100%
1.2.5 蛋白质量浓度与蛋白含量的测定方法
应用 Bradford法[5]测定发酵液总蛋白质量浓度.SDS-PAGE凝胶电泳检测蛋白含量[6].
2 结果与讨论
2.1 硫酸铵分段盐析
2.1.1 一级盐析的确定
将预处理后的发酵液用 HCl或 NaOH调节 pH至等电点 3.94.以硫酸铵作为盐析剂,在不同盐析质量分数下对16拷贝风味强化肽进行分段盐析沉淀实验,结果如图1所示.
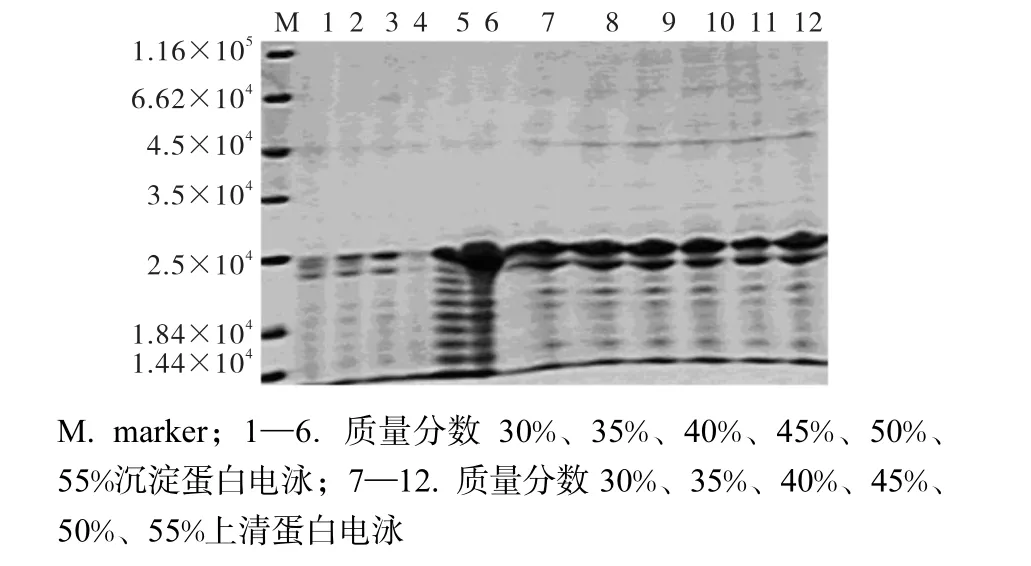
图1 硫酸铵盐析16拷贝风味强化肽沉淀SDS-PAGE电泳图Fig.1 SDS-PAGE of 16 copies flavor enhancing peptide precipitation by ammonium sulfate salting
目的蛋白相对分子质量为 2.5×104,从图 1可知,当硫酸铵质量分数为 45%以下时,蛋白沉淀较少,当达到50%时,开始出现较多的沉淀.因此,本研究选择一级盐析时硫酸铵质量分数为45%.
2.1.2 二级盐析
选择硫酸铵质量分数 45%进行一级盐析,通过SDS-PAGE检测,结果如图2所示.
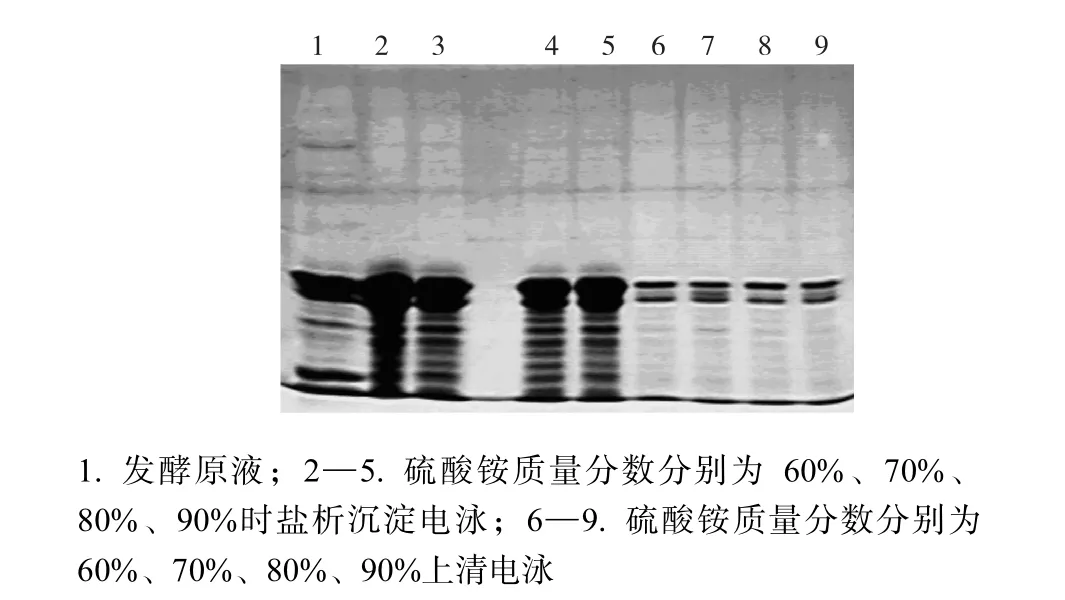
图 2 硫酸铵二级盐析 16拷贝风味强化肽沉淀 SDS-PAGE电泳图Fig.2 SDS-PAGE of 16 copies flavor enhancing peptide precipitation by ammonium sulfate salting
结合图 1和图 2可知,当硫酸铵质量分数为45%~60%时,蛋白质的溶解度随溶液质量分数的增加而降低,沉淀蛋白电泳条带越来越浓,当在 70%~90%时,硫酸铵溶液质量分数增加而沉淀蛋白电泳条带相对变稀.为了得到更多的沉淀蛋白,本研究选择二级盐析时硫酸铵质量分数为60%.
采用硫酸铵盐析的方法在粗提阶段提高所需蛋白纯度,这在很多相关文献中都有提及,如罗磊等[6]的“一步沉淀法”,Siegelman等[7]的“分步沉淀法”,胡一兵等[8]的“分段梯度盐析法”,但这些方法或产物纯度低,或重复性差,或盐析次数多,或盐析段过于狭窄等.本实验首先进行 0%~45%的硫酸铵盐析,这段沉淀物可以抛弃(去除大多数杂质);然后进行 45%~60%的硫酸铵盐析,可以得到较好的盐析效果.但是从图1和图2可以看出,当硫酸铵饱和度为 60%~90%时,上清液中仍然含有大量纯度较高的目标蛋白,回收率太低,因此放弃使用硫酸铵盐析的方法进行粗分,并且尝试使用中空纤维方法分离、浓缩目标风味肽.
2.2 发酵上清液的中空纤维超滤
稀释过滤即是在膜分离过程中向料液中加入渗透溶剂(一般是水),使小分子和渗透溶剂一起去除,直到达到所需要的分离要求.显然,如果产品是大分子,稀释过滤类似于洗涤;而当产品是小分子时,产品液体将被稀释.因 16拷贝风味强化肽相对分子质量小于 60,000,当通过截留相对分子质量 60,000的超滤膜时,是将溶液中的大分子杂质去除.为了提高16拷贝风味强化肽的回收率,必须采用稀释过滤.图3为中空纤维超滤膜浓缩后发酵液的 SDS-PAGE凝胶电泳图.

图3 中空纤维分离液SDS-PAGE电泳图Fig.3 SDS-PAGE of hollow fiber separation
3、8和12泳道为浓缩后相对分子质量在6 000~60,000样品,其蛋白浓度明显比 5号对照泳道深,说明经过中空纤维超滤膜浓缩后,16拷贝风味强化肽目的蛋白被高效浓缩;4、9和 13泳道蛋白条带很淡甚至没有条带,说明 6,000滤出液只含有少量的蛋白,达到很好的超滤浓缩效果.
2.3 离子交换树脂DEAE-52纯化16拷贝风味强化肽浓缩液

图4 洗脱液盐浓度对DEAE-52分离16拷贝风味强化肽影响Fig.4 Effect of eluent salt concentration on the separation of 16 copies flavor enhancing peptide by DEAE-52
通过预备实验,选择缓冲液pH为7.0,检测洗脱液在220,nm下的吸收峰,得到洗脱曲线如图4所示.图 4结果显示,Tris-HCl-NaCl梯度洗脱曲线在8、19、30、40和 49号管分别出现较高吸收峰,选择这些吸收峰以及其附近的洗脱液,进行 SDS-PAGE电泳检测,结果如图5所示.

图5 16拷贝风味强化肽洗脱峰SDS-PAGE电泳结果Fig.5 SDS-PAGE of 16 copies flavor enhancing peptide elution peak
根据图 5可知,目标蛋白在第 40~49管洗脱液中析出,此时 NaCl浓度为 0.25,mol/L,其中 46~49管洗脱液样品纯度较高.
2.4 两步分离纯化
首先使用中空纤维进行超滤浓缩,浓缩分别经过两次超滤,得到相对分子质量在 6,000~60,000的蛋白质,考马斯亮蓝结果显示其蛋白质量浓度为6.34,g/L,回收率达到 59%;采用 DEAE–52进行进一步分离纯化,经 SDS-PAGE检测,纯化后 16拷贝风味强化肽平均纯度可达 93.19%.将得到最佳的结果进行SDS-PAGE电泳,结果如图6所示.

图6 两步分离纯化结果的SDS-PAGE电泳图Fig.6 SDS-PAGE of the separation and purification results
3 结 语
蛋白质分离纯化很难用单一方法实现,往往要综合几种方法才能提纯出一种蛋白质[9].理想的蛋白质分离提纯方法要求产品纯度和总回收率越高越好,但实际上两者难以兼顾,因此,考虑分离提纯的条件和方法时,不得不在两者之间作适当的选择;一般情况下,科研上更多地选择前者,工业生产上更多地选择后者.因此,每当需要提纯某种蛋白质时,首先要明确分离纯化的目的和蛋白质的性质,以便选择最佳的分离纯化方法,从而得到理想的效果[10].
本研究将预处理过的发酵液进行分离纯化.分别采用了硫酸铵盐析法、中空纤维超滤法和 DEAE–52进行纯化.经过实验确定最佳方法为:首先使用中空纤维进行超滤浓缩,浓缩分别经过两次超滤,通过截留相对分子质量分别为60,000和6,000的膜,得到相对分子质量范围在 6,000~60,000之间的蛋白质,回收率达到 59%;采用 DEAE–52进一步分离纯化,经SDS-PAGE检测,纯化后16拷贝风味强化肽平均纯度可达93.19%.
[1]Shi X,Karkut T,Chamankhah M,et a1. Optimal conditions for the expression of a single-chain antibody(scFv)gene in Pichia pastoris[J]. Protein Expr Purif,2003,28(2):321–330.
[2]官孝群,王跃祥,吴良成,等. 血管生成抑制因子 K4K5 cDNA基因的克隆及其在毕赤酵母中的表达[J]. 生物工程学报,2001,17(2):126–130.
[3]朱家文,武斌,陈葵,等. 离子交换层析分离纯化重组人血清白蛋白[J]. 华东理工大学学报:自然科学版,2002,28(4):341–345.
[4]王艳萍,高文,侯建华,等. 牛肉风味强化肽(BMP)表达载体的构建[J]. 天津科技大学学报. 2008,23(3):16–20.
[5]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1979,72:248–254.
[6]Guo Y J. Protein electrophoretic technique[M]. Beijing:Science Press,1998:54–58.
[7]罗磊,丁霄霖. 聚丙烯酰胺凝胶电泳研究硫酸铵盐析分离猪血清 IgG[J]. 食品研究与开发,2006,27(1):82–88.
[8]Siegelman H W,Kycia J H. Algal biliproteins:Handbook of phycological method[M]. Cambridge:Cambridge University Press,1978:71–79.
[9]胡一兵,胡鸿钧,李夜光,等. 从一种富含藻胆蛋白的螺旋藻中大量提取和纯化藻蓝蛋白的研究[J]. 武汉植物学研究,2002,20(4):299–302.
[10]Wang H X,Ng T B. Purification of castamollin,a novel antifungal protein from Chinese chestnunts [J]. Protein Expression and Purification,2003,32(1):44–51.
[11]Wang H X,Ng T B. Alocasin,an anti-fungal protein from rhizomes of the giant taro Alocasia macrorrhiza[J]. Protein Expression and Purification,2003,28(1):9–14.
Separation and Purification of Flavor Enhancing Peptide fromPichia Pastoris
TIAN Xue,ZHANG Bao-chi,BAI Xiao-jia,WANG Yan-ping
(Key Laboratory of Food Nutrition and Safety,Ministry of Education,College of Food Engineering and Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
The separation and purification method of 16 copies flavor enhancing peptide fromPichia Pastorisfermentation broth was studied by fractional salting out,hollow fiber ultra filtration and anion exchange resin. The results showed the best separation and purification method. The broth was first ultra filtration enriched twice by hollow fiber column,and then further purified by ion-exchange resin DEAE-52. After the purification,the average purity of 16 copies flavor enhancing peptide was 93.19% detected by SDS-PAGE.
Pichia pastoris;flavor enhancing peptide;salting-out;hollow fiber ultra filtration;ion exchange resin;separation and purification
Q503
A
1672-6510(2011)04-0014-04
2011–02–18;
2011–03–15
天津市东丽区科技创新专项资金项目(20101306);天津市科技发展计划(05YFGHHZ00200)
田 雪(1985—),女,天津人,硕士研究生;通信作者:王艳萍,教授,博士生导师,ypwang@tust.edu.cn.

