pcDNA3.1-GCNF真核表达载体构建及其对HeLa细胞凋亡的影响
陈芳,王菊,宋勇,周宗瑶
(石河子大学医学院,石河子832002)
pcDNA3.1-GCNF真核表达载体构建及其对HeLa细胞凋亡的影响
陈芳,王菊,宋勇,周宗瑶
(石河子大学医学院,石河子832002)
构建人pcDNA3.1-GCNF真核表达载体,并瞬时转染宫颈癌 HeLa细胞,观察 GCNF基因对 HeLa细胞凋亡的影响。采用PCR的方法从pMD18-T-GCNF载体中扩增全长 GCNF cDNA,将扩增产物克隆至真核表达载体pcDNA3.1(-),测序鉴定后,重组质粒pcDNA3.1-GCNF转染 HeLa细胞,RT-PCR以及间接免疫荧光鉴定转染结果,并用Annexin V-PI双染流式细胞术分析细胞凋亡情况。结果显示,克隆的重组真核表达载体经序列测定分析后,证实pcDNA3.1-GCNF重组真核表达质粒构建成功,并获得瞬时转染pcDNA3.1-GCNF的 HeLa细胞。流式细胞术检测:转染重组质粒组的细胞凋亡率(6.72%)低于转染空质粒组(9.78%)以及未转染组(9.34%),P<0.00313,转染重组质粒后细胞凋亡率降低。由此可知,pcDNA3.1-GCNF重组质粒瞬时转染子宫颈癌 HeLa细胞后,GCNF基因可以抑制 HeLa细胞凋亡。
GCNF;真核表达载体;HeLa细胞;转染
在我国子宫颈癌患病率位于妇科肿瘤第一位,而且近年来患病率也在逐年上升且有年轻化的趋势,它的恶性生物学行为与某些促进细胞增殖或抑制细胞凋亡的基因密切相关。生殖细胞核因子(germ cell nuclear factor,GCNF)是转录因子超家族的一名孤儿核受体,研究证实,GCNF是一个转录抑制因子,具有抑制OCT-4基因表达的功能。GCNF基因高表达于发育中的生殖细胞,此外在一些生殖系肿瘤细胞如畸胎瘤中也能检测到,但尚未见该基因与生殖系以外肿瘤的关系报道。
有研究表明,异位表达Oct4基因可以引起上皮细胞的异常增生,可能与肿瘤的形成有密切的关系。子宫颈癌系上皮性肿瘤,已有研究显示,在宫颈癌细胞株(HeLa细胞)中有Oct-4的表达[1],Oct-4作为转录因子受 GCNF调控,那么 GCNF是否与宫颈癌细胞有关?目前尚未见报道。
本研究拟克隆并构建了人 GCNF基因表达载体,通过转染宫颈癌 HeLa细胞,观察转染后细胞凋亡情况,欲对其生物学效应做出研究,为研究该基因在宫颈癌中的作用提供基础实验数据。
1 材料与方法
1.1 材料
1.1.1 菌株、载体
大肠杆菌DH5α由石河子大学医学院新疆地方与民族高发病教育部重点实验室保存,pMD18-TGCNF购自Openbiosystem公司,载体pcDNA3.1(-)购自上海吉凯基因化学技术有限公司。
1.1.2 主要试剂
T4 DNA ligase(美国 NEB公司),T4 DNA ligase buffer(美国NEB公司),EcoR I和 XbaⅠ酶(美国 NEB公司),Taq polymerase(SinoBio),dNTP(日本 TA KARA公司),Primer(上海吉凯基因技术有限公司合成)Trizol、二甲苯、无水乙醇、异丙醇、氯仿、二乙基焦碳酸盐(DEPC)(上海生物工程有限公司),RT-PCR试剂盒(Fermentas公司),琼脂糖(西班牙 biowest),DNA Marker(日本TA KARA公司)LipofectamineTM2000(美国 invitrogen公司),DMEM 培养基、新生牛血清、磷酸盐缓冲液(PBS)(美国Sigma公司),GCNF兔抗人多克隆抗体(美国 santacruz公司),Annexin V-PI双染法凋亡试剂盒(美国invitrogen公司)。
1.2 实验方法
1.2.1 PCR扩增目的基因片段
PCR扩增 GCNF基因片段(上、下游引物序列为 :5′-GCTCTAGAAT-GGAGCGGGACGAAC-3′;5′-CGGAATTCTCATTCCTTGCCCACACTG-3′) 的 反应体系为:ddH2O 12.4μL,5×Taq buffer 4μL,dNTP 1.6μL,上下游引物各0.4μL,pMD18-T-GCNF质粒1μL,T aq聚合酶0.2μL,共20μL。
扩增条件为:94℃2 min,94℃30 s,55℃30 s,72℃3min,72℃10 min,30 cycles,-20℃保存。进行1%琼脂糖凝胶电泳。
1.2.2 目的基因片段连接入线性化载体
目的基因和pcDNA3.1(-)载体用XbaI和Eco-RI双酶切后纯化,并对纯化产物进行连接反应。连接反应体系:目的基因组 ddH2O 10μL,10×T4 Buffer 2μL,50%PEG4000 2μL,酶切载体 DNA 1 μL,酶切纯化的 PCR产物4μL,T4DNA连接酶1 μL,共20μL。自连对照组不加 PCR产物,阳性对照组PCR产物为 GAPDH基因(与目的基因带有同样的酶切位点),其余组成与上述体系相同。该反应体系于22℃连接3 h。转化连接产物至大肠杆菌DH5α感受态细胞。
1.2.3 菌落 PCR
PCR鉴定重组阳性克隆。PCR反应体系如下(上、下游引物序列为 :5′-CTGTCTTCCAGTAGGTCTGTGGAACTGAATG-3′;5′-TTATTAGGAAA GGACAGTGGG-3′)ddH2O 12.4μL,5 ×Taq buffer 4μL,dNTP 1.6μL,上下游引物各 0.4μL,菌落 PCR模板1μL,Taq聚合酶0.2μL,共20μL。
阴性对照:使用水作为模板。自连对照:使用自连对照转化子为模板。阳性对照:使用阳性对照转化子为模板,扩增 GAPDH基因的一部分,其他组成与上述体系相同。
PCR反应条件94℃2 min,94℃30 s,60℃30 s,72℃1 min,72℃6 min,30 cycles.接种阳性转化于5 mL含50μg/mL氨苄青霉素的LB培养基中,37℃250 r/min摇床中摇菌16 h后保存为甘油菌,分装200μL送上海生工测序。
1.2.4 质粒提取及转染
用tiangen质粒抽提试剂盒抽提质粒,具体步骤按试剂盒说明书进行。用XbaI和 EcoRI对质粒进行酶切鉴定。HeLa细胞在含100 mL/L胎牛血清的H-DMEM培养基中,于37℃,50 mL/L CO2饱和湿度下培养,80%汇合时按照LipofectamineTM2000说明书进行空质粒和重组表达质粒的转染。
1.2.5 RT-PCR法鉴定转染细胞
RT-PCR法检测转染后细胞 GCNF基因mRNA的表达。于转染后48h,Trizol法提取细胞总RNA,取出1μg总 RAN逆转录成cDNA,行 PCR扩增,反应体系:(上、下游引物序列为5′-CGAACCTGTCTCATTTGTGG-3′,5′-ACCATCTGGAGGCATTTG′-3)ddH2O 12.4μL,5×Taq buffer 4μL,dNTP 1.6μL,上下游引物各0.4μL,cDNA模板1μL,T aq聚合酶0.2μL,共20μL。
反应条件为:94℃5 min,94℃40 s,55℃45 s,72℃45 s,72℃5 min 30 cycles,-20℃保存。扩增片段长度为200 bp。
1.2.6 间接细胞免疫荧光法鉴定转染细胞
转染48 h后,细胞爬片用 PBS浸洗2×5 min,10%免疫山羊血清室温封闭20 min,滴加稀释倍数为1∶200的 GCNF兔抗人多克隆一抗50μL,4℃过夜,PBS浸洗3×5 min,滴加山羊抗兔荧光二抗,室温孵育2 h,甘油封片,Carl Zeiss激光共聚焦显微镜观察并扫描成像。
1.2.7 流式细胞术检测细胞凋亡率
收集细胞,PBS洗涤2次,Annexin V-PI染色,流式细胞仪检测凋亡细胞的比例。采用SPSS13.0统计学软件进行结果分析,率的多重比较采用χ2分割法。检验水准α′=0.0125,以 P<0.0125统计学有差异。
2 结果
2.1 PCR扩增目的基因片段
以pMD18-T-GCNF质粒为模板,利用 PCR方法获取目的基因。PCR产物1%琼脂糖凝胶电泳,可见约 1450 bp DNA条带,见图1。
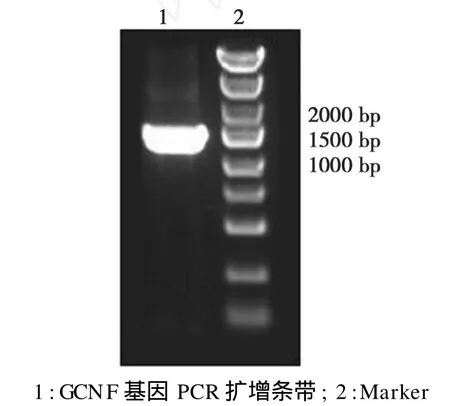
图1 GCNF克隆PCR产物电泳Fig.1 The Agarose gel electrophoresis of PCR products of GCNF
2.2 PCR阳性克隆鉴定
用位于目的基因中的正向引物和位于载体上多克隆位点下游的反向引物,以菌落上的少许菌体直接作为模板进行PCR扩增。经电泳分析发现,在筛选的8个菌落中有7个可见到1026 bp大小的阳性条带(图2),推测这7个克隆即为含有 GCNF基因插入片段的阳性克隆,且插入的片段方向正确。
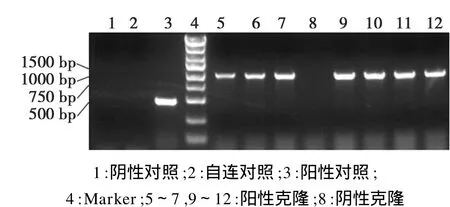
图2 pcDNA3.1-GCNF阳性克隆PCR产物Fig.2 The Agarose gel electrophoresis of PCR products of positive cloning of pcDNA3.1-GCNF
2.3 DNA测序及同源性分析
测序结果通过 Advanced BLAST210软件与GeneBank中的人 GCNF序列进行同源性分析,同源性达99.93%(有一个碱基发生了同义突变,即突变后编码的是同一个蛋白)。
2.4 RT-PCR法鉴定转染后的细胞
细胞提取总 RNA后,用逆转录RT-PCR法扩增目的基因片段,空质粒转染组和未转染组为对照。与对照组相比转染目的基因后明显可见一条明亮,清晰,大小为200 bp的目的条带,而转染空载体组和未转染组只能见一条不清晰,模糊的条带,说明GCNF基因转染入 HeLa细胞,并成功表达。结果如图3所示。
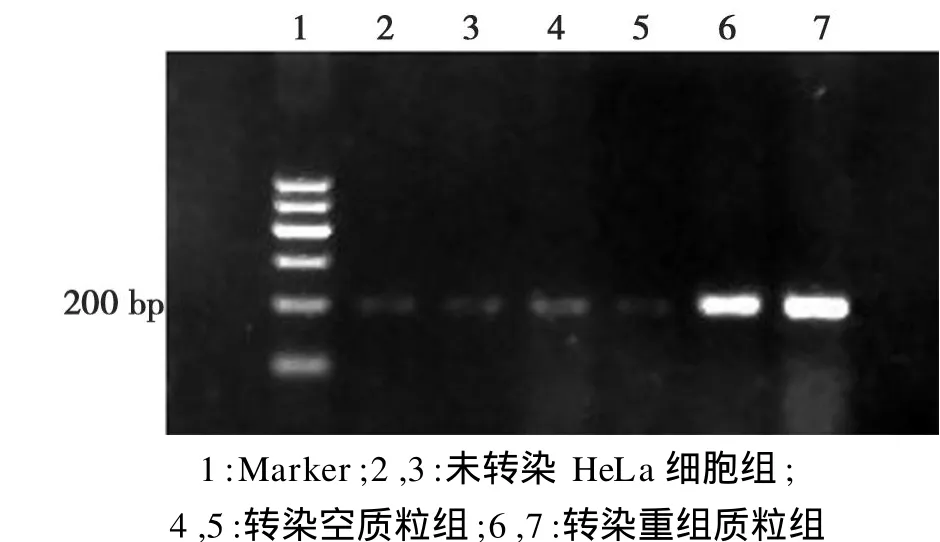
图3 转染后HeLa细胞RT-PCR琼脂糖凝胶电泳Fig.3 The Agarose gel electrophoresis of RT-PCR products of HeLa cells by transfectiong
2.5 间接免疫荧光法鉴定转染后的细胞
GCNF间接免疫荧光标记显示 GCNF阳性表达位于细胞核上,转染了 PCDNA3.1-GCNF真核表达载体的 HeLa细胞爬片上,可见大部分细胞GCNF呈较强荧光染色(图4a),而转染空载体和未转染组 GCNF呈阴性(图4b、c),用 PBS代替一抗为空白对照组(图4d)。由此可见,GCNF基因转染入 HeLa细胞。由于所用的一抗是多克隆抗体,故可见到非特异性着色。
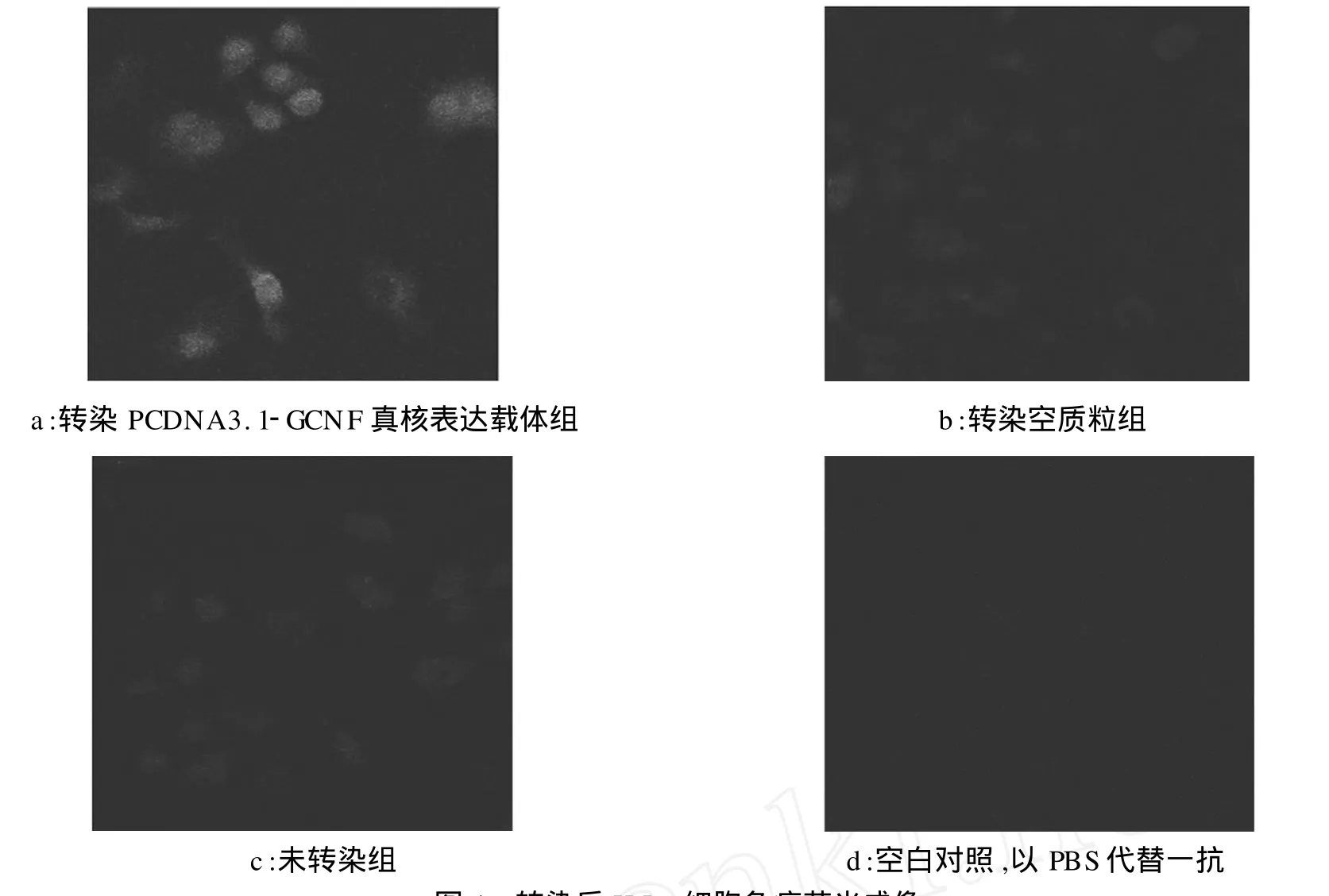
图4 转染后HeLa细胞免疫荧光成像Fig.4 Imaging of HeLa cells immunofluorescence
2.6 流式细胞仪检测细胞凋亡
由表1可知,转染 48 h后,流式细胞仪计数10000个细胞,分析细胞凋亡。转染重组质粒组的凋亡率(6.72%)低于转染空质粒组(9.78%)以及未转染组(9.34%),以检验水准α’=0.0125,P<0.00313,比较有显著差异,而转染空质粒组与未转染组无差别(P>0.0125)。由此可见,GCNF基因可以抑制HeLa细胞的凋亡。
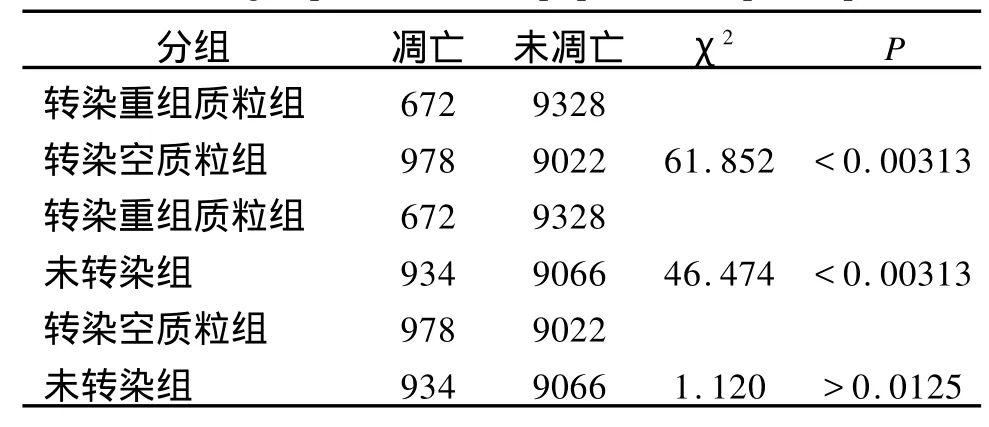
表1 三组细胞凋亡率的两两比较Tab.1 Three groups of cells in apoptosis compared pairwise
3 讨论
生殖细胞核因子(GCNF),又称RTR(retinoidreceptor-related testis-associated receptor)或 NR6AI。最早是在20世纪90年代从小鼠中克隆出来,后来陆续在人,斑马鱼和非洲爪蟾等物种中被克隆出来 。它是转录因子超家族的一名成员,由于其配体未知,故也称为孤儿核受体[2]。在人类,该基因定位于人类9号染色体的q33~q34[3]。通过序列比较,该基因在物种间的同源性很高,表明 GCNF在功能上具有很高的保守性。其功能结构与核受体超家族的成员也有很高的同源性,都包括DNA结合域(DBD)、配体结合域(LBD)以及铰链区。GCNF基因高度表达在发育中的神经系统、胎盘以及发育中的生殖细胞[4-5],它在胚胎的发育以及配子的形成过程中起重要的作用。GCNF是现知第一个对多能胚胎干细胞中表达的关键基因Oct-4有抑制作用的因子。它可以促进Oct-4基因的甲基化,使Oct-4发生基因沉默抑制其表达[6-8],从而使干细胞失去多潜能性。有关 GCNF在肿瘤方面的研究较少,Sattler等[9]研究表明,GCNF表达于小鼠的某些胚胎癌细胞中如P19细胞,PCC7-MZL细胞;Schmitz等[10]研究表明,人类的胚胎癌细胞系N T2/D1有 GCNF表达。2003年 Sowmya Srikanthan[11]的研究表明,GCNF表达于人的卵巢癌细胞系OVCAR-3,TOV-112,ES-2,PA-1;并且他的研究提示 GCNF可促进细胞的增殖。Lan等[12-13]的研究也得出了类似的结论。最近研究表明,GCNF在恶性生殖细胞肿瘤中有表达,且表达程度可能与肿瘤细胞的分化程度以及恶性程度相关[14]。GCNF基因与生殖系肿瘤的关系研究日渐被人们重视,但是 GCNF基因在生殖系肿瘤以外的肿瘤中是否起作用,尚未见报道。
有研究报道,宫颈癌 HeLa细胞中有Oct-4的表达,而Oct-4基因受 GCNF基因的调控,那么 GCNF基因是否对宫颈癌 HeLa细胞有影响,目前未见相关报道。本实验观察了 GCNF基因对宫颈癌 HeLa细胞凋亡的影响。本实验通过测序证实成功构建了pcDNA3.1-GCNF真核表达载体,并通过RT-PCR以及间接免疫荧光证实重组质粒成功转染入宫颈癌HeLa细胞。用流式细胞仪检测了转染重组质粒后细胞凋亡情况的变化,结果显示:与转染空质粒组以及未转染组相比,转染重组质粒组的细胞凋亡率有所降低,有统计学意义,而转染空质粒组与未转染组细胞凋亡率差别无统计学意义。说明 GCNF基因对体外培养的宫颈癌 HeLa细胞有抑制其凋亡的作用。细胞凋亡是细胞对各种促进凋亡因素的一种反应,调节许多重要的生理功能如免疫监视、维持内环境稳定等[15]。凋亡发生的机制是极其复杂的,细胞凋亡的启动是细胞在感受到相应的信号刺激后胞内一系列控制开关的开启或关闭,不同的外界因素启动凋亡的方式不同,所引起的信号传导也不相同,GCNF基因抑制凋亡发生的机制目前尚不明了。综上所述,本实验研究表明,GCNF基因可以抑制子宫颈癌 HeLa细胞凋亡,具体作用机制有待深入研究。
[1]Tai M H,Chang C C,L.Karl Olson,et al.Oct4 expression in adult human stem cells:evidence in support of the stem cell theory of carcinogenesis[J].Carcinogenesis,2005,26(2):495-502.
[2]Katz D,Niederberger C,Slaughter G R,et a1.Characterization of germ cell-specific expression of the orphan nuclear receptor,germ cell nuclear factor[J].Endocrinology,1997,138(10):4364-4372.
[3]Agoulnik I Y,Cho Y,Niederberger C,et a1.Cloning expression analysis and chromosomal localization of the human nuclear receptor gene GCNF[J].FEBS Letters,1998,424(1):73-78.
[4]Zhang Y L,Akmal K M,Tsuruta J K,et al.Analysis of germ cell nuclear factor transcripts and protein expression during spermatogenesis[J].Biology of Reproduction,2003,68(10):1621-1630.
[5]Morasso M I,Grinberg A,Robinson G,et al.Placental failure in mice lacking the homeobox gene Dlx3[J].Proceedings of the National Academy of Sciences,1999,96(5):162-167.
[6]Noriko Sato,Mitsumasa Kondo,Kenichi Arai.The orphan nuclear receptor GCNF recruits DNA methyltransferase for Oct-3/4 silencing[J].Biochemical and Biophysical Research Communications,2006,344(3):845-851.
[7]Gu P L,Menuet D L,Cooney A J,et al.Differential recruitment of methylated Cp G binding domains by the orphan receptor GCNF Initiates the repression and silencing of Oct4 Expression[J].Molecular and cellular Biology,2006,26(24):9471-9482.
[8]Yang H M,Do H J,Kim D K,et al.Transcriptional regulation of human Oct4 by steroidogenic factor[J].Journal of Cellular Biochemistry,2007,110(5):1198-1209.
[9]Sattler U,Samochocki M,Maelicke A,et al.The Expression level of the orphan nuclear receptor GCNF(Germ Cell Nuclear Factor)is critical for Neuronal differentiation[J].Molecular Endocrinology,2004,18(11):2714-2726.
[10]Schmitz T P,Susens U,Borgmeyer U.DNA binding,protein interaction and differential expression of the human germ cell nuclear factor[J].Biochimica et Biophysica Acta,1999,1446(3):173-180.
[11]Sowmya Srikanthan GCNF as a growth regulator in normal and neoplastic cell[D].India:Madurai Kamaraj University,2003.
[12]Lan Z J,Chung A.C-K,Xu X,et al.Expression of the orphan nuclear receptor,germ cell nuclear factor,in mouse gonads and preimplantation embryos[J].Biology of Reproduction,2003,68(1):282-289.
[13]Lan Z J,Gu P,Xu X,et al.Evolutionary tracebased peptides identify a novel asymmetric interaction that mediates oligomerization in nuclear receptors[J].Journal of Biological Chemistry,2005,280(36):4070-4081.
[14]高启云,王菊,周宗瑶,等.生殖细胞核因子及其相关因子在恶性生殖细胞肿瘤中的表达[J].石河子大学学报:自然科学版,2009,27(5):616-618.
[15]Chen Z W,Ling H,Li Z F.Role of c-FLIP in diallyl trisulfide-induced apoptosis in human gastric cancer cell line SGC-7901[J].Progress in modern biomedicine,2010,21(10):333-349.
Construction of pcDNA3.1-GCNF Eukaryotic Expression Vector and Effects of Apoptosis in HeLa Cells
CHEN Fang,WANGJu,SONG Yong,ZHOU Zongyao
(College of Medicine,Shihezi University,Shihezi 832002,China)
To construct the pcDNA3.1-GCNF eukaryotic expression vector and transient transfection into cervical cancer HeLa cells and observe the influence of GCNF genes on HeLa cells apoptosis,PCR method was used to amplify GCNFcDNA from the pMD18-T-GCNF vector,the amplification product was cloned into the pcDNA3.1(-)vector and sequencing,the recombinant plasmid pcDNA3.1-GCNF transfected into cervical cancer HeLa cells,RT-PCR and indirect immunofluorescence identified the result of transfected.Analysis apoptosis of HeLa cells by Annexin V-PI double staining flow cytometry.The pCDNA3.1-GCNF recombinant plasmid was successfully constructed and confirmed by DNA sequence.Then the pcDNA3.1-GCNF recombinant plasmid was successfully transfected into cervical carcinoma HeLa cells.Recombinant plasmid transfected group(6.72%)of cell apoptosis lower than empty vector transfected group(9.78%)and control group(9.34%),(P<0.00313).The pcDNA3.1-GCNF recombinant plasmid was transfected into HeLa cells.GCNF gene could inhibit apoptosis of HeLa cells.
GCNF gene;eukaryotic expression vector;cervical cancer HeLa cell line;transfection
R394.1
A
1007-7383(2011)02-0193-05
2010-10-25
陈芳(1984-),女,硕士生,专业方向为生殖与发育。
周宗瑶(1966-),女,教授,从事生殖与发育的研究;e-mail:zongyaozh@163.com。

