酪蛋白水解物的Plastein反应修饰及ACE抑制活性变化
徐微,赵新淮
(东北农业大学乳品科学教育部重点实验室,哈尔滨 150030)
酪蛋白水解物的Plastein反应修饰及ACE抑制活性变化
徐微,赵新淮
(东北农业大学乳品科学教育部重点实验室,哈尔滨 150030)
采用中性蛋白酶水解酪蛋白,一定条件下制备水解度为13.0%、IC50质量浓度为40.4 mg/L的酪蛋白水解物。利用中性蛋白酶对所制备出的水解物进行plastein反应修饰,以反应体系的游离氨基量的变化为评价指标,通过单一因素试验研究酶添加量、底物质量分数、反应时间和反应温度对修饰反应的影响。结果表明,适宜的反应条件为中性蛋白酶添加量3 kU/g蛋白质、底物质量分数60%、反应时间6 h、反应温度20℃。制备5个不同反应程度的修饰产物,ACE抑制活性分析结果显示,修饰产物的IC50降至14.7~31.1 mg/L,表明中性蛋白酶催化的plastein反应修饰提高酪蛋白水解物的ACE抑制活性,且ACE抑制活性的提高程度与plastein反应程度有关。
酪蛋白水解物;中性蛋白酶;plastein反应;ACE抑制活性
0 引言
血管紧张素I转换酶(ACE)抑制肽是当前的研究热点,例如已经从酪蛋白水解物中分离出的一个ACE抑制肽[1]。从食品蛋白质中获得高活性ACE抑制肽,一般需要选择水解条件[2-4],或者是从水解物中分离、纯化高活性的肽[5]。
Plastein反应是蛋白水解物在适宜的条件下经蛋白酶作用形成凝胶状物质的反应[6],反应机制涉及缩合作用、转肽作用、物理聚集[7-9],其中,转肽作用和缩合作用涉及新肽键形成,缩合作用则涉及产物中游离氨基变化(即游离氨基量减少)。酪蛋白水解物的plastein反应修饰可以改善其ACE抑制活性[10-12]。因此,本研究利用中性蛋白酶水解酪蛋白,然后再采用中性蛋白酶进行plastein反应修饰酪蛋白水解物,研究一些反应条件对plastein反应的影响,并考察修饰反应最终对酪蛋白水解物ACE抑制活性的影响。
1 实验
1.1 材料
酪蛋白(蛋白质质量分数为95.7%),中性蛋白酶,兔肺丙酮粉,FAPGG(FA-Phe-Gly-Gly),卡托普利(Captopril),其他所有试剂均为分析纯,所用水为超纯水。
1.2 设备
UV-2401PC型紫外可见分光光度计,AL204型分析天平,Kjeltec TM2300型自动凯氏定氮仪,LGJ-1型真空冷冻干燥机,HZQ-F160型全温振荡培养箱,DELTA 320型精密pH计,H-1型微型漩涡混合器,YH-4BS型远红外恒温干燥箱,DK-98-1型电热恒温水浴锅。
1.3 方法
1.3.1 酪蛋白水解物的制备
配制质量分数10%的酪蛋白溶液,用浓度为2 mol/L的NaOH调节pH值至6.5,加入中性蛋白酶于45℃下进行水解,酶添加量为2 kU(每克蛋白质中)。于0,2,4,6,8,10,12 h分别取出溶液20 mL,迅速置于沸水浴中加热15 min,冷却后于5 000 r/min离心20 min,分离出上清液。测定上清液中蛋白质质量分数和游离氨基的量,计算其水解度,同时测定上清液的ACE抑制活性。通过以上分析,确定酪蛋白水解物的适宜制备条件,放大实验,得到的上清液真空冷冻干燥后于-18℃保藏。
1.3.2 酪蛋白水解物的plastein反应修饰
用中性蛋白酶对酪蛋白水解产物进行plastein反应修饰。采用单因素实验,分别考察酶添加量、底物浓度、温度、时间对修饰反应的影响作用,以反应体系的游离氨基含量变化(底物游离氨基含量减去修饰产物游离氨基的量)为指标,选择适宜的修饰反应条件。在反应结束后,所有的应样品于沸水浴灭酶15 min,冷却后测定游离氨基的量及其ACE抑制活性(以半数抑制浓度IC50表示)。
1.3.3 相关分析
1.3.3.1 蛋白质质量分数、水解度及蛋白酶活力测定
(1)蛋白质质量分数测定采用凯氏定氮法[13]。
(2)游离氨基的量及酪蛋白水解度测定采用邻苯二甲醛(OPA)法[14,15]。
OPA试剂的配置:将2.0 g十二烷基磺酸钠(SDS)加入到30 mL浓度为0.4 mol/L的硼酸缓冲溶液(pH值为9.5),水浴加热使其溶解,冷却至室温后再加入质量浓度为80 g/L的OPA乙醇溶液1mL、β-巯基乙醇200 μL,并用硼酸缓冲溶液定容至100 mL,此溶液现配现用。
游离氨基量的测定:配置系列亮氨酸标准溶液(0,6,12,15,20,24,30 g/L),取3 mL标准溶液与同体积的OPA试剂混合并开始计时,5 min后在340 nm波长下测定吸光值。以吸光值为横坐标、亮氨酸质量浓度为纵坐标绘制标准曲线。按照标准曲线制作步骤,测定分析样品的吸光值,并根据标准曲线计算其游离氨基的量。
水解度(DH)的计算[16]如下:
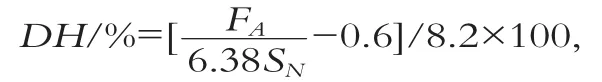
式中:FA为样品的游离氨基浓度;SN为样品的氮质量浓度;0.6为酪蛋白的游离氨基浓度;8.2为酪蛋白的肽键浓度,6.38为蛋白质换算系数。
(3)蛋白酶活力采用福林酚法测定[17]。
1.3.3.2 ACE抑制活性
以FAPGG为底物,采用非连续分光光度法测定分析样品的ACE抑制活性[18,19]。
ACE酶液:50 mg兔肺丙酮粉浸泡于5 mL预冷至4℃的硼酸缓冲溶液(pH值为8.3,浓度为100 mmol/L)中,4℃恒温震荡摇床中提取12 h后以20 000 r/min转速冷冻离心20 min,分离出上清液并于4℃保存。
FAPGG底物溶液:将FAPGG溶于浓度为100 mmol/L的硼酸缓冲溶液(pH值为8.3,含浓度为300 mmol/L的NaCl),得浓度为1.6 mmol/L的溶液。
ACE抑制活性测定:500 μL FAPGG底物溶液与100 μL超纯水或某一浓度的抑制剂(ACE抑制肽或卡托普利)混匀,37℃预热2 min,加300 μL ACE酶液并在37℃反应30 min。立即加入100 μL EDTA(浓度为100 mmol/L)终止反应,加4.0 mL超纯水稀释,平行三次。0 min样品测定需先加入EDTA再加入ACE酶液,其他相同。340 nm下分别测定反应体系在0 min和30 min时的吸光值,计算差值ΔA(ΔA=A0min-A30min)。以单位时间内吸光值变化表示ACE酶活力,抑制剂对ACE酶的抑制程度为
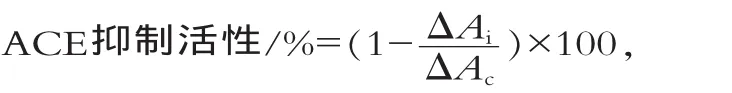
式中:ΔAc为加入超纯水时吸光值在30 min内的变化;ΔAi为加入抑制剂时吸光值在30 min内的变化。
IC50的计算:IC50定义为抑制50%ACE酶活力时抑制剂的浓度。配置不同浓度的ACE抑制剂,按以上步骤测定其ACE抑制活性。以抑制剂浓度的对数为横坐标、ACE抑制活性为纵坐标,进行回归分析;利用回归方程计算抑制剂的半抑制浓度(IC50)。
2 结果与讨论
2.1 酪蛋白水解物的制备
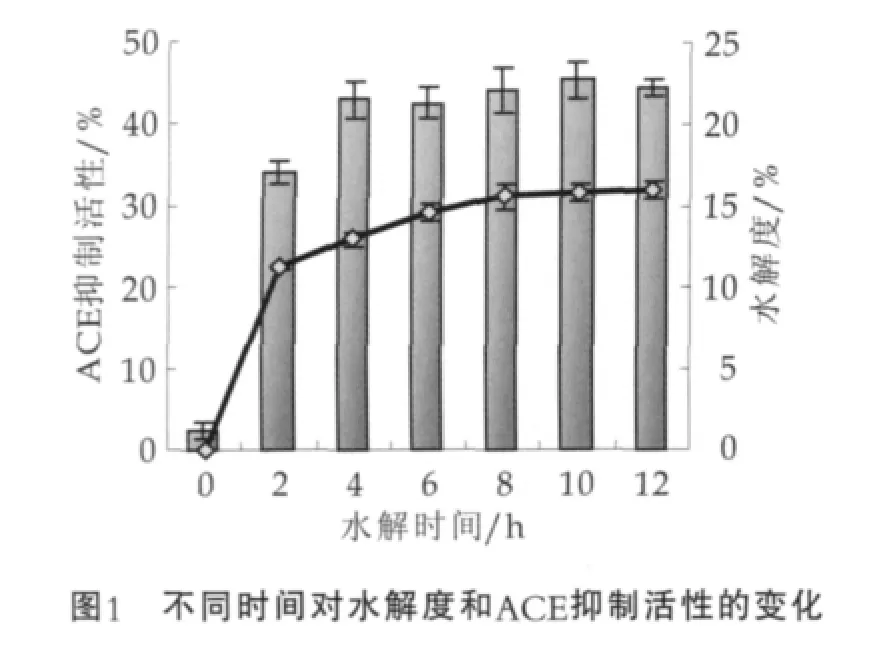
ACE抑制肽一般是由2~12个氨基酸残基组成的小肽,C末端若为脯氨酸、芳香族氨基酸(Phe,Tyr,Trp)等,则ACE抑制肽的活性一般较高[20-25]。酪蛋白含有丰富的脯氨酸和芳香族氨基酸,因此是酪蛋白水解物有较高的ACE抑制活性。利用中性蛋白酶水解酪蛋白至不同的时间,发现酪蛋白水解物的水解度及其相应ACE抑制活性的变化如图1所示。图1中,折线表示水解度;柱状表示ACE抑制活性。
由图1可以看出,酪蛋白水解产物的水解度随反应时间的延长而增大,反应的初始阶段(0~2 h),水解度变化较大,水解2 h时达到11.3%,随后水解物的水解度随反应时间缓慢增长,12 h时达到16.0%。未水解的酪蛋白(0 h)的ACE抑制活性很低(约2.4%),可能是由于酪蛋白在制备过程中被降解,也可能是污染了一些具有ACE抑制活性的小肽[26]。在酪蛋白水解的初始阶段(0~4 h),酪蛋白水解产物对ACE的抑制活性随水解度的增加而增大。当水解反应进行4 h以后,水解产物的ACE抑制活性增加不多。所以,选取水解时间为4 h的酪蛋白水解液进行以后的Plastein反应修饰,此水解物的水解度为13.0%,ACE抑制活性约为42.9%,所测定得到的IC50数值为(40.4±2.0)mg/L。
2.2 酪蛋白水解物的中性蛋白酶plastein反应修饰
在plastein反应过程中,缩合作用为其中的一个反应并导致游离氨基量减少,转肽作用不引起游离氨基量变化。因此,可以用游离氨基量的变化作为衡量反应程度的一个指标。
2.2.1 酶添加量的影响
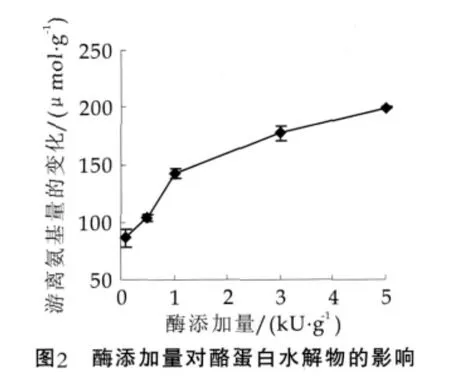
中性蛋白酶的适宜反应温度为40℃左右。在底物质量分数为40%、反应时间为6 h时,考察酶添加量对修饰反应的影响,结果如图2所示。图2中,随酶添加量的增加,反应体系中游离氨基的量变化增大,即plastein反应过程中发生缩合作用;在0.1~1 kU(每克蛋白质中)的酶添加量下,反应体系中游离氨基的量变化的增幅较大,1.0~5.0 kU/g范围内,反应体系中游离氨基的量变化的增幅趋缓。考虑到反应速率及反应成本,选择3 kU/g的酶添加量较为适宜。
2.2.2 底物质量分数的影响
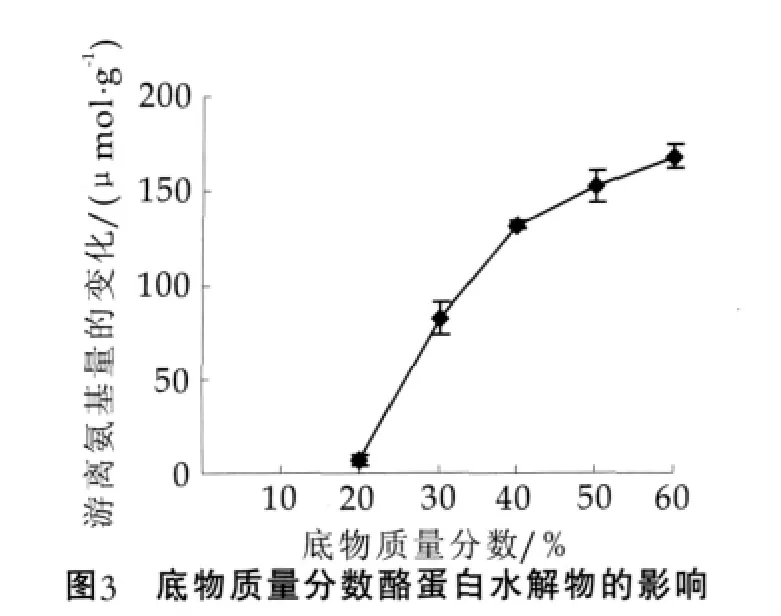
底物质量分数对plastein反应的影响非常显著;底物质量分数过低,水解反应占优势;底物质量分数过高,反应体系黏度过大,不利于反应的发生。本研究选取底物质量分数为20%,30%,40%,50%,60%,研究底物对修饰反应的影响。选择酶添加量为1 kU/g、温度为30℃、反应时间为6 h。结果如图3所示。由图3可以看出,在质量分数为20%~60%的范围内,随着底物质量分数的增加,反应体系中游离氨基浓度变化很大,反应体系中缩合作用增加。所以,底物质量分数60%为适宜。
2.2.3 反应时间的影响
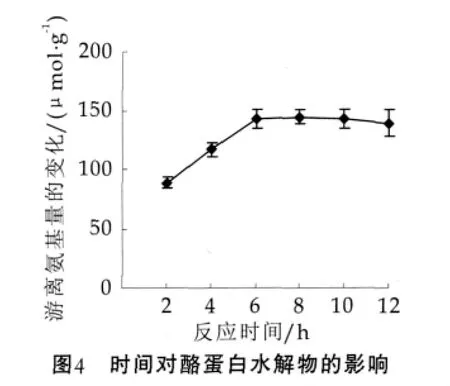
在底物质量分数为40%、酶添加量为1 kU/g、反应温度为30℃的条件下,考查反应时间对plastein反应的影响,结果如图4所示。由图4可以看出,在初始阶段(2~6 h),反应体系中游离氨基浓度变化的增加迅速,当反应时间为6 h时,反应体系中游离氨基量的变化达到142.74 μmol(每克蛋白质中),然后变化幅度减小。所以,适宜的反应时间为6 h。
2.2.4 反应温度的影响
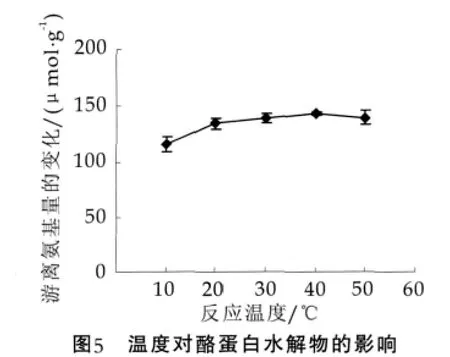
温度对plastein反应具有双重影响。热力学上,plastein反应是一个放热过程,升高温度并不能增加反应产率;而低温又不利于酶的催化作用,会导致反应速率下降。在底物质量分数为40%、酶添加量为1 kU/g蛋白质、反应时间为6 h时,反应温度(10~50℃)对plastein反应的影响如图5。在本实验所选择的温度范围内,温度对plastein反应影响不太大。在40℃时酪蛋白水解物的游离氨基的量变化最大,达到143.77 μmol/g,而在10℃时则为最低,为115.90 μmol/g。综合考虑,选择接近室温的20℃为适宜的反应温度,此时游离氨基的量变化为134.82 μmol/g,与40℃时酪蛋白水解物的游离氨基的量变化接近。
整体上看,通过单一因素试验,可以初步确定酪蛋白水解物进行plastein反应修饰时适宜反应条件为:中性蛋白酶添加量为3 kU/g、底物质量分数为60%、反应时间为6 h、反应温度为20℃。通过中心组合试验设计研究给出相似的结果(本文不给出具体的实验结果),进一步确认单因素试验所选择的反应条件是适宜的。
2.3 plastein反应修饰后ACE抑制活性
在中性蛋白酶添加量为3 kU/g、底物质量分数为60%、反应温度为20℃下,plastein反应修饰酪蛋白水解物,利用反应时间不同,分别制备出游离氨基含量变化呈现递增趋势的修饰产物5个。通过分析其ACE抑制活性,发现修饰产物的ACE活性均明显的高于原始的酪蛋白水解物,如表1所示。整体的数值结果显示,酪蛋白水解物经过plastein反应修饰后,相比原先的酪蛋白水解物(IC50为40.4 mg/L)其IC50数值范围在14.7~31.1 mg/L,即ACE抑制活性提高。同时还可以看出,随着反应体系游离氨基浓度变化的增大,修饰产物的ACE抑制活性随之提高,这再次表明plastein反应修饰处理确实能够有效地提高酪蛋白水解物的ACE抑制活性,与过去的研究结果[10-12]相同。并且也可以看出,修饰产物ACE抑制活性的提高程度,初步显示出与修饰反应的反应程度有关联性,这一点也与过去的研究结果[10,11]一致。蛋白质水解物进行plastein反应修饰时,其ACE抑制活性为何改善的相关机制,还有待于进一步研究、揭示。

表1 酪蛋白水解物plastein反应修饰后的ACE抑制活性变化
3 结论
(1)利用中性蛋白酶对酪蛋白进行水解,在中性蛋白酶添加量为2 kU/g、pH值为6.5、45℃下水解10%酪蛋白溶液4 h,制备出有较高ACE抑制活性的酪蛋白水解物,其水解度为13.0%,ACE抑制活性为42.9%、IC50为(40.4±2.0)mg/L。
(2)利用中性蛋白酶对酪蛋白水解物进行修饰,通过单一因素试验,并且比较反应体系中游离氨基量的变化,确定出适宜的反应条件为:中性蛋白酶添加量为3 kU/g、底物质量分数为60%、反应时间为6 h、反应温度为20℃。
(3)利用上述的反应条件和不同的反应时间制备出5个酪蛋白水解物的修饰产物。ACE抑制活性评价结果显示,修饰产物的IC50降低至14.7~31.1 mg/L,ACE抑制活性大幅度提高。研究结果再一次证明plastein修饰可以显著改善蛋白质水解物的ACE抑制活性,并且ACE抑制活性的提高程度与plastein反应程度存在相关性。
[1]MARUYAMA S,SUZUKI H A.Peptide Inhibitor of Angiotensin-IConvertingEnzymeintheTrypticHydrolysateofCasein[J]. Agricultural and Biological Chemistry,1982,46(5):1393-1394.
[2]OTTE J,SHALABY S M,ZAKORA M,et al.Angiotensin-IConverting Enzyme Inhibitory Activity of Milk Protein Hydrolysates: Effect of Substrate,Enzyme and Time of Hydrolysis[J].International Dairy Journal,2007,17(5):488-503.
[3]姚成虎,王志耕,梅林,等.胃蛋白酶水解珠蛋白获得ACE抑制肽的工艺优化[J].农业工程学报,2008,24(5):284-288.
[4]陈季旺,刘英,夏文水,等.大米降压肽酶法制备工艺及其性质研究[J].农业工程学报,2007,23(5):210-213.
[5]KUBA M,TANA C,TAWATA S,et al.Production of Angiotensin-I-Converting Enzyme Inhibitory Peptides from Soybean Protein with Monascus Purpureus Acid Proteinase[J].Process Biochemistry,2005,40 (6):2191-2196.
[6]HUDSON B J F.Biochemistry of Food Proteins[M].London and New York:Elsevier Applied Science,1992:271-300.
[7]YAMASHITA M,ARAI S,FUJIMAKI M.Plastein Reaction for Food Protein Improvement[J].Journal of Agricultural and Food Chemistry, 1976,24(6):1100-1104.
[8]ANDREWS A T,ALICHANIDS E.The Plastein Reaction Revisited: Evidence for a Purely Aggregation Reaction Mechanism[J].Food Chemistry,1990,35(4):243-261.
[9]GOEPFERT A,LORENZEN P C,SCHLIMME E.Peptide Synthesis during in Vitro Proteolysis-Transpeptidation or Condensation[J]. Nahrung,1999,43(3):211-212.
[10]ZHAO X H,LI Y Y.An Approach to Improve ACE Inhibitory Activity of Casein Hydrolysates with Plastein Reaction Catalyzed by Alcalase[J],European Food Research and Technology,2009,229(5): 795-805.
[11]李亚云,赵新淮.酪蛋白水解物的酶法修饰与ACE抑制活性变化[J].食品与发酵工业,2009,35(5):35-39.
[12]徐微,赵新淮.酪蛋白水解物的中性蛋白酶修饰及其ACE抑制活性[J].食品与发酵工业,2010,36(5):17-22.
[13]GB/T 5009.5-2003,食品中蛋白质的测定[S].
[14]CHURCH F C,SWAISGOOD H E,PORTER D H.,et al. SpectrophtotometricAssayUsingο-Phthaldialdehydefor Determination of Proteolysis in Milk and Milk Proteins[J].Journal of Dairy Science,1983,66(6):1219-1277.
[15]SPELLMAN D,MCEVOYE,O’CUINN G.,et al.Proteinase and Exopeptidase Hydrolysis of Whey Protein:Comparison of the TNBS, OPAandpH Stat MethodsforQuantificationofDegreeof Hydrolysis[J].International Dairy Journal,2003,13(6):447-453.
[16]赵新淮,冯志彪.蛋白质水解物水解度的测定[J].食品科学,1994, 15(11):65-67.
[17]SB/T 10317-1999,蛋白酶活力测定[S].
[18]SHALABY S M,ZAKORA M,OTTE J,et al.Performance of Two Commonly Used Angiotensin-Converting Enzyme Inhibition Assays Using FA-PGG and HHL as Substrates[J].Journal of Dairy Research, 2006,73(2):178-186.
[19]MURRAY B A,WALSH D J,FITZGERALD R J.Modification of theFuranacryloyl-L-Phenylalanyl-GlycylglycineAssayfor Determination of Angiotensin-I-Converting Enzyme Inhibitory Activity[J].Journal of Biochemical and Biophysical Methods,2004,59 (2):127-137.
[20]MURUYAMA S,MITACHI H,TANAKA H,et al.Studies on the ActiveSiteandAntihypertensiveActivityofAngiotensinIConverting Enzyme Inhibitors Derived from Casein[J].Agricultural and Biological Chemistry,1987,51(6):1581-1586.
[21]KOHMURAM,NION,KUBOK,etal.Inhibitionof Angiotensin-Converting Enzyme by Synthetic Peptides of Human β-Casein[J].Agricultural and Biological Chemistry,1989,53(8): 2107-2114.
[22]BYUN H G,KIM S K.Structure and Activity of Angiotensin I ConvertingEnzymeInhibitoryPeptidesDerivedfromAlaskan Pollack Skin[J].Journal of Biochemistry and Molecular Biology, 2002,35(2):239-243.
[23]SAITO Y,WANEZAKI K,AKITSUQU K,et al.Structure and Activity of Angiotensin I Converting Enzyme Inhibitory Peptides fromSakeandSakeLees[J].BioscienceBiotechnologyand Biochemistry,1994,58(10):1767-1771.
[24]SUETSUNA K.Purification and Identification of Angiotensin IConverting Enzyme Inhibitors from the Red alga Porphyra yezoensis [J].Journal of Marine Biotechnology,1998.6(3):163-167.
[25]CHEUNG H S,WANG F L,ONDETTI M A,et al.Binding of Peptide Substrates and Inhibition of Angiotensin-Converting Enzyme Importance of the COOH-Terminal Dipeptide Sequence[J].Journal of Biological Chemistry,1980,255(2):401-407.
[26]ROBERTMC,RAZANAMEA,MUTTERM,etal. Identification of Angiotensin-I-Converting Enzyme Inhibitory Peptides Derived from Sodium Caseinate Hydrolysates Produced by Lactobacillus helveticus NCC 2765[J].Journal of Agricultural and Food Chemistry,2004,52(23):6923-6931.
Modification of casein hydrolysates by plastein reaction and ACE inhibitory activity of the modified products
XU Wei ZHAO Xin-huai
(Key Laboratory of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbin 150030,China)
Casein was hydrolyzed by Neutrase under the fixed conditions to prepare casein hydrolysates that had the degree of hydrolysis of 13.0%and value of IC50about 40.4 μg/mL.The obtained hydrolysates then were modified by plastein reaction catalyzed by Neutrase.The effects of the addition level of Neutrase,the concentration of casein hydrolysates,reaction time and temperature on the plastein reaction of casein hydrolysates were studied by single factor experiments,with the decreased amount of free amino groups of the hydrolysates as the evaluation index.The results indicated that the suitable reaction conditions were addition level of Neutrase of 3 ku/g proteins,substrate concentration of 60%,reaction time of 6 h and reaction temperature of 20℃.Five modified casein hydrolysates were prepared with the selected reaction conditions but different reaction times.The analysis results showed that the modified hydrolysates had an improved ACE-inhibitory activity because their values of IC50ranged from 14.7 to 31.1μg/mL.Our results indicated that Neutrase-catalyzed plastein reaction could be applied to enhance the ACE-inhibitory activity of casein hydrolysates,and reaction extent of plastein reaction showed impact on the ACE-inhibitory activity of the modified product.
casein hydrolysates;Neutrase;plastein reaction;ACE inhibitory activity
Q93-33
A
1001-2230(2011)04-0008-04
2010-06-28
国家自然科学基金(30972132);国家高技术发展计划(863)(2006AA10Z324)。
徐微(1982-)女,硕士研究生,研究方向为食品科学。
赵新淮

