2种海洋寡糖对大麦种子萌发和生理特性的影响*
王婷婷,赵 丽,夏 萱,王 鹏,江晓路
(中国海洋大学食品科学与工程学院,山东青岛266003)
2种海洋寡糖对大麦种子萌发和生理特性的影响*
王婷婷,赵 丽,夏 萱,王 鹏,江晓路**
(中国海洋大学食品科学与工程学院,山东青岛266003)
本研究应用具有不同电荷性的褐藻寡糖(ADO)和壳寡糖(COS)处理大麦种子,探索在相同条件下不同浓度的海洋寡糖对大麦幼苗生长情况及生理特性的影响。生长指标包括苗长、根长、苗重及根重,以及对大麦种子淀粉酶活力和叶绿素含量的影响。试验结果表明:当ADO和COS处理浓度分别为0.5%和0.025%时,大麦的各项生长指标、种子淀粉酶活力及叶绿素含量均达到最大值,与对照组相比显著增加(P<0.05)。2种海洋寡糖均是具有独特生理活性的分子片段,分子量大小相近,但基于2种寡糖分子结构的不同,造成在对大麦的促生长方面存在差异性,为以后2种海洋寡糖的合理开发利用提供了参考。
褐藻寡糖;壳寡糖;大麦;幼苗生长;生理特性
海洋寡糖是将来源于海洋生物的多糖经过降解得到的,相对多糖而言,海洋性寡糖不仅溶解性好,而且表现出较强的生理活性[1]。寡糖一般是由3~10个单糖(Monosaccharide)通过糖苷键连接而成的化合物,又称低聚糖[2]。Albersheim[3]首次提出了寡糖素(Oligosaccharins)的概念,认为寡糖作为信号分子具有调控植物生长、发育、繁殖的功能,参与了植物的生长发育调控活动。
本研究选择经褐藻胶裂合酶降解褐藻胶后得到褐藻寡糖(Alginate-derived oligosaccharide ADO)片段,是由甘露糖醛酸和古罗糖醛酸结合而成的直链线性嵌段型高分子聚合物,并以醛酸(-COOH)或醛酸盐(-COO-)的形式存在。近年来,许多文章先后证实ADO在植物生长调节和诱导抗病领域都发挥着重要的作用,而其对于植物来说作为一种重要的信号分子在植物转导中的作用机制也有待进一步的研究[4-5]。壳寡糖(Chitosan oligosaccharide COS)是由甲壳素(几丁质)脱乙酰化的产物壳聚糖降解获得的碱性寡糖,也是天然糖中唯一大量存在的碱性氨基多糖[6-7]。COS分子上的游离氨基(-NH2)在酸性条件下可以质子化而带正电(-NH+3),形成阳离子聚合物。本试验中所使用的COS水溶性好,易于吸收,分子量小,在促进植物生长、诱导植物抗性及提高产品品质等方面具有重要作用。
ADO对豌豆和高粱种子的淀粉酶活性和根系活力等具有重要影响[8],能够促进种子的萌发,提高幼苗叶绿素的含量。COS对黄瓜种子萌发及幼苗生长方面也有很大的促进作用[6],可以促进种子幼苗及根部的生长。但关于2种寡糖在种子萌发过程和生理特性的综合性及比较性报导未见。本试验系统性的研究了在相同条件下,经不同浓度ADO和COS处理后的大麦种子在生长状况及生理指标各方面的变化趋势,进而将2种海洋寡糖的促进效果进行综合性的对比,为进一步科学合理的利用海洋资源以及在农业生产中的应用提供一定的科学理论基础。
1 材料与方法
1.1 材料
本试验中的大麦种子由青岛啤酒公司惠赠,经初步测试选取发芽率较高的大麦种子进行试验;ADO和COS由中国海洋大学食品科学与工程学院应用微生物实验室提供,ADO是褐藻胶经Vibrio sp.510-64菌株产生专一性褐藻胶裂合酶酶解制备的寡糖片段;COS是由壳聚糖经酶解后再脱去部分乙酰基的衍生物,由氨基葡聚糖聚合而成;供试土壤来自中国海洋大学。
1.1.1 ADO聚合度分析 褐藻寡糖的组分分析采用电喷雾电离质谱仪(TSQ LC/MS/MS,Finnegan Company)。电喷雾电离质谱(ESI-MS)采用阴离子模式。样品溶解于MeOH-H2O溶液中(1∶1)(10 pmol·m L-1),并用注射泵以5μL·min-1的速度注入电喷源。质量扫描范围从100~1 100 Da。毛细管温度保持在250℃,氮气用于雾化和解溶剂化气体。
试验中使用的褐藻寡糖经质谱分析后,组分如图1所示。ADO中可检测到373([x M-2H+Na]-)、571、769、9 674个离子碎片(m/z)峰,由[x M-2H+Na]-=373,可知M=176,为褐藻胶不饱和二糖。因此,该寡糖属于聚合度为2-5的ADO片段,其中以二糖和三糖含量较高,四糖、五糖含量较低。因此可见本研究中使用的ADO是以二糖和三糖为主的ADO混合物,分子量范围低于1 000。
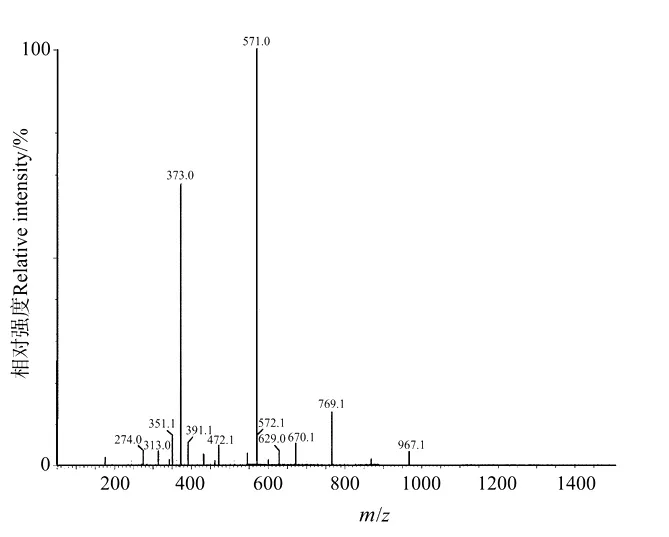
图1 测定褐藻寡糖的ESI-MSFig.1 Mass spectrum of ADO by ESI-MS
1.1.2 COS聚合度分析 COS质谱分析采用基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS)分析法(Autoflex,Bruker Daltonik,Bremen,德国)。分析器真空度1.33×10-6Pa,离子源加速电压25 k V,离子延迟提取125 ns,正离子谱测定,氮气激光(波长337 nm,脉冲宽度3 ns)。
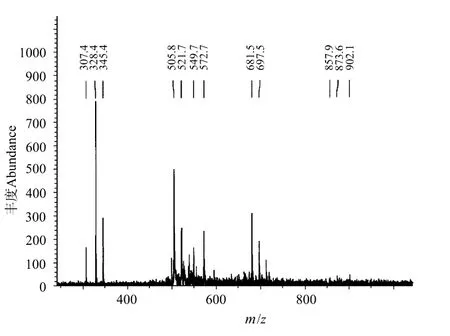
图2 测定壳寡糖的MALDI-TOF-MSFig.2 Mass spectrum of COS by MALDI-TOF-MS
如图2所示,所选用的COS聚合度较小,由图2中[x M+Na]+=345,可知M=161,是聚合度为2的壳寡糖,m/z328.4为脱1个氨基(-NH2)的壳二糖,m/z505为三糖[3M+Na]+,m/z549为[3M+Na+COCH3]+含1个乙酰基,m/z 572为[3M+2Na+COCH3]+,m/z 681为四糖[4M+Na+NH2]+。因此,此寡糖为聚合度2-5的COS片段,其中以聚合度为2和3的寡糖片段为主,四糖含量较低,并含有微量的五糖。COS与ADO分子量大小相近(<1 000)。因此,在以下试验中暂不考虑由于分子量大小的不同所引起的促生长差异性。
1.2 种子处理方法
选取籽粒饱满的大麦种子,用10%的次氯酸钠溶液消毒10 min,再用蒸馏水反复冲洗干净。将处理后的种子分别浸泡在浓度为0、0.2%、0.4%、0.5%、0.6%的ADO溶液和浓度为0、0.0125%、0.025%、0.050%、0.075%的COS溶液中进行24 h催芽,每种不同浓度的寡糖各浸泡大麦种子60粒。播种于准备好的种植槽中,每格平均播种,不超过10粒,每天加适量的水以保证植物生长过程中所需水分。处理后置于24℃培养箱中进行萌发,每组处理重复3次。
1.3 测定项目
1.3.1 生长指标测定 分别测定萌发7 d后各处理组幼苗的苗长和根长、苗重及根重,并在60℃下烘干至恒重,称取幼苗和根的干质量。
1.3.2 叶绿素含量测定[9-10]烘干后的大麦叶片分别称取0.05 g用95%乙醇研磨法提取叶绿素,以提取试剂95%乙醇为对照,分别测定叶绿素a、b在95%乙醇中最大吸收峰的波长分别为665和649 nm处的吸光度计算叶绿素浓度,并计算干重的叶绿素含量(mg·g-1),每组处理重复3次。计算公式:
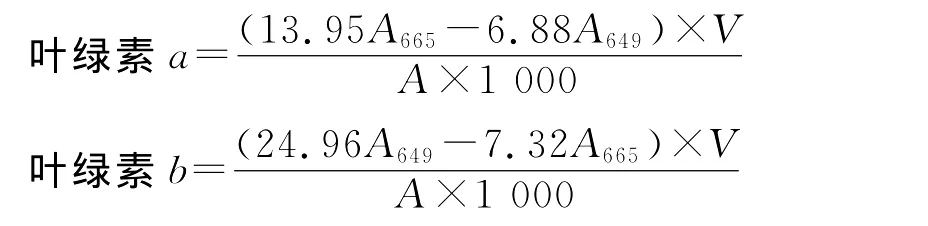
V为提取液总体积(m L);A为取样干质量(g)。
1.3.3 淀粉酶活力测定[11]取1 g经寡糖处理萌发3 d的大麦种子,加入少量石英砂和3 m L蒸馏水,在研钵中研磨,研磨后转入到离心管中,用7 m L的蒸馏水将剩余残渣全部转入到离心管中。室温下放置提取15~20 min,然后在3 000 r/min转速下离心10 min。上清液转移到50 m L容量瓶中,定容到刻度,备用,每组处理重复3次。
本研究中采用先加热钝化β淀粉酶,测定α淀粉酶活力,再与非钝化条件下的总淀粉酶活力(α+β淀粉酶)进行比较即可计算出β淀粉酶活力。淀粉酶可以将淀粉水解产生还原糖,产生的还原糖又可以使3,5-二硝基水杨酸还原,生成棕红色的3-氨基-5-硝基水杨酸。
计算公式:
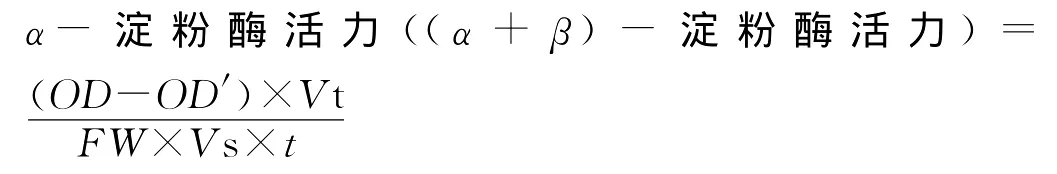
β淀粉酶活力=(总淀粉酶活力-α淀粉酶活力)OD:α-淀粉酶水解淀粉生成麦芽糖的毫克数;OD′:α-淀粉酶对照管中麦芽糖的含量;V s:显色时所用酶液体积(m L);V t:样品稀释液总体积(m L);FW:样品质量(g);t:酶作用时间(min)。
2 结果
2.1 海洋寡糖对大麦生长指标的影响
由表1所示,经不同浓度的COS和ADO处理的大麦种子幼苗生长趋势均高于对照组,上升幅度随着寡糖浓度的增加而呈现先增加后递减的趋势,各种生长指标包括苗长、根长及质量也有所提高。但不同浓度的COS和ADO对大麦各项生长指标促进程度有所不同,对照组苗长和根长分别为11.01和10.88 cm,在COS处理组中,当COS浓度为0.025%时苗长和根长分别为13.26和16.06 cm,与对照组相比增量达到20.44%和47.61%,促进效果极其显著(P<0.01)。据郭卫华[5]对黄瓜种子的研究表明:当COS浓度为100 mg/L时对幼苗的苗长和根长表现出抑制作用。在本研究中所使用COS的浓度对大麦最适的作用浓度较前面文献中报导的COS浓度略高,但随着COS浓度的继续升高,促生长效果逐渐减弱,苗长的下降趋势最为明显,当COS达到0.075%时苗长相对于对照组增量仅为3.54%,促进效果不明显(P>0.05),当继续增加COS浓度将可能会对苗长生长产生一定的抑制作用。表1表明不同浓度的ADO处理的大麦种子幼苗生长趋势均高于对照组,当ADO浓度为0.5%时苗长和根长分别为14.70和15.50 cm,与对照组相比增加量达33.47%和53.76%,促进效果均达到极其显著水平(P<0.01)(见表1)。
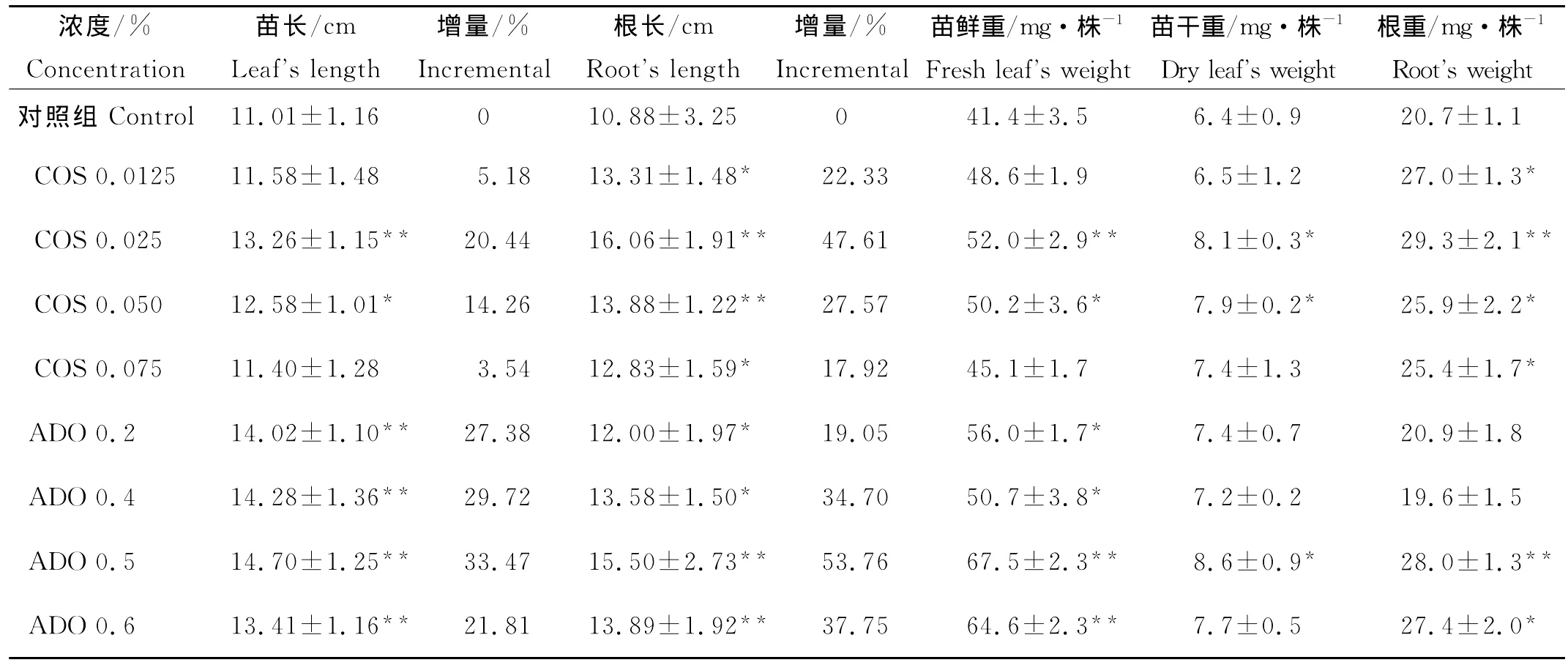
表1 2种海洋寡糖对大麦幼苗生长指标的影响Table 1 Effects of two oligosaccharides on the seedling growth indicators of barley
2.2 海洋寡糖对大麦幼苗叶绿素含量的影响
2种不同浓度的海洋寡糖COS和ADO对大麦叶绿素含量的影响如表2所示,经2种寡糖处理的大麦幼苗叶片总叶绿素含量、叶绿素a、叶绿素b含量均比对照有所提高,上升幅度随寡糖浓度的增加呈现先递增后减少的趋势。通过组内比较,当COS浓度为0.025%时,总叶绿素含量、叶绿素a、叶绿素b含量均达到最大值,与对照组相比总叶绿素含量(DW)达到9.35 mg·g-1,增量为36.05%。而当COS浓度达到0.075%时与对照组相比较总叶绿素增量为3.91%,增幅较小,促进效果不明显(P>0.01)。在ADO处理组中,其对总叶绿素促进效果较为明显,当ADO浓度为0.5%时总叶绿素含量(DW)达到10.86 mg·g-1,相对于对照组总叶绿素增量为57.85%。上述结果表明2种海洋寡糖对促进植物叶片的光合作用,提高叶片叶绿素的含量均有影响。2种寡糖进行组间对比发现:浓度为0.5%的ADO对总叶绿素含量的促进作用较0.025%的COS更为明显。光合作用与叶绿素a的含量关系较为密切,因此2种寡糖对叶绿素a含量的影响较大,而叶绿素b含量变化幅度相对较小(见表2)。
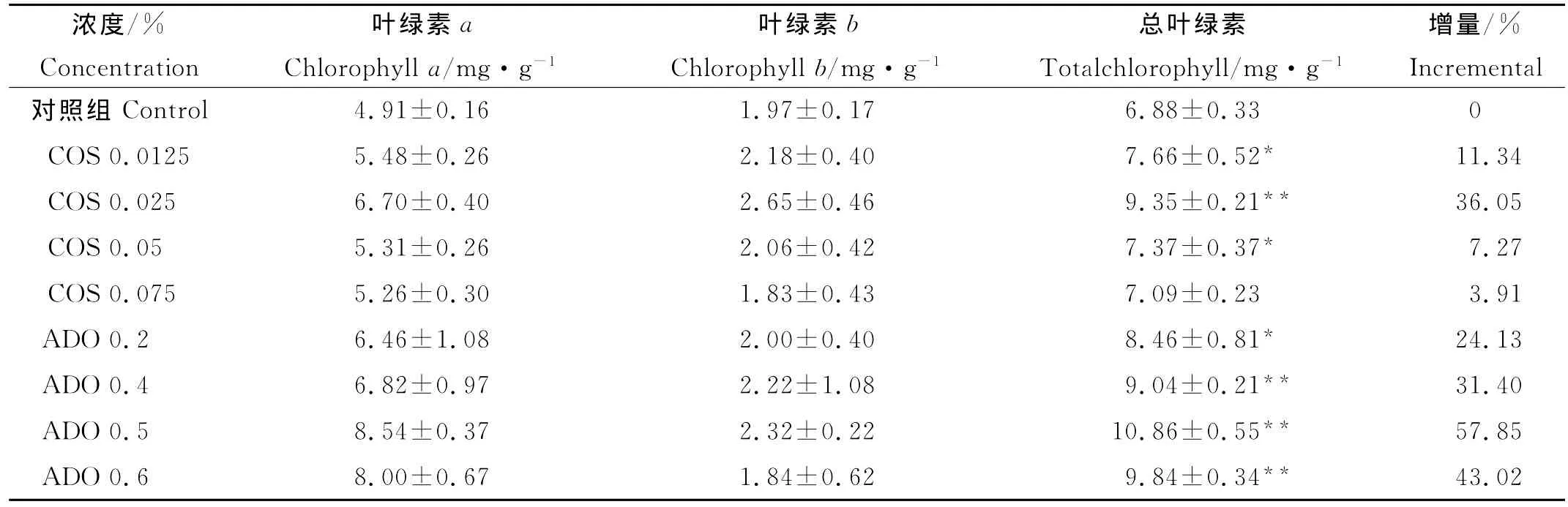
表2 2种海洋寡糖对大麦叶绿素含量的影响Table 2 Effects of two oligosaccharides on the chlorophyll content of barley
2.3 海洋寡糖对大麦淀粉酶活力的影响
由图3可以看出,不同浓度COS对大麦淀粉酶活力的影响较大,对照组总淀粉酶活力(FW)为14.458 mg·g-1·min-1,当COS浓度为0.025%时α-淀粉酶和β-淀粉酶活力较高,总淀粉酶活力(FW)达到19.580 mg·g-1·min-1,萌发中的种子β-淀粉酶活力高于α-淀粉酶活力,因此对β-淀粉酶活力的影响较为明显。随着COS浓度升高,β-淀粉酶活力呈迅速下降的趋势,而α-淀粉酶活性也处于停滞增长的状态。这表明,COS可诱导大麦种子中淀粉酶的合成,提高种子中营养物质的利用率,从而促进种子萌发和幼苗生长,与大麦叶片中叶绿素含量变化规律基本一致。由图4可以看出,不同浓度ADO对大麦种子的α-淀粉酶和β-淀粉酶活力均有不同程度的影响。经ADO处理的大麦种子,对照组中总淀粉酶活力(FW)为16.560 mg·g-1·min-1,当ADO浓度为0.5%时总淀粉酶活力(FW)为23.735 mg·g-1·min-1达到高峰。这表明ADO可诱导大麦种子中淀粉酶的合成,浓度为0.5%的ADO对大麦淀粉酶酶活力的影响较COS明显,在促生长方面具有一定的优势。
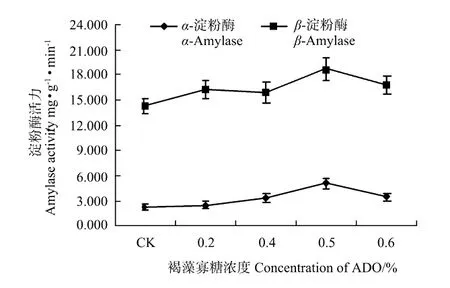
图4 褐藻寡糖对大麦淀粉酶活力的影响Fig.4 Effects of ADO on the amylases activity of barley
3 讨论

图3 壳寡糖对大麦淀粉酶活力的影响Fig.3 Effects of COS on the amylases activity of barley
本研究以大麦为材料,研究相同条件下不同浓度的2种海洋寡糖处理的大麦种子在萌发状况和酶活力方面的差异以及它们之间的可能联系,以期为进一步阐明寡糖在种子萌发中的作用及其促生长的生理机制提供依据。试验结果表明,低浓度寡糖处理可以提高大麦种子的苗长和根长,促进种子萌发,而高浓度寡糖处理对大麦种子的萌发呈明显的下降趋势,甚至会出现抑制作用。一般认为,种子萌动初期,膜保持一定的透性及完整性有利于种子的吸胀及对营养物质的吸收,寡糖大多存在于细胞膜表面,是细胞间或细胞内传递生物信息的载体,参与很多生物反应的基本过程[13]。寡糖对植物防御系统的激活作用在高等植物中普遍存在,而且植物和病原菌细胞壁中的其他结构多糖也具有类似的诱抗活性[14]。
种子萌发和幼苗阶段是作物生长的起始阶段,也是对外界因子最敏感的时期之一,因此种子幼苗的根长、苗高、单株鲜重和单株干重是评价幼苗生长状况最为直观的指标。叶绿素是植物进行光合的色素,叶绿素含量在一定程度上反映了植物光合作用的水平,是衡量植物叶片功能的一个重要指标[15]。淀粉酶是水解淀粉和糖原酶类的总称,广泛存在于动植物和微生物中。β-淀粉酶存在于休眠种子中,而α-淀粉酶是在萌发过程中诱导产生的,β-淀粉酶含量高于α-淀粉酶,随着种子萌发,α-淀粉酶的量不断增加[8]。
许多报道证明ADO和COS对植物的生长均具有促进作用[16]。郭卫华等[5]应用不同浓度的COS处理黄瓜种子和幼苗,得出COS在低浓度时能够促进黄瓜种子发芽,对黄瓜幼苗生长有促进作用,而高浓度的COS则抑制生长。卜宁[17]和胡晓珂[18]等报导ADO在一定浓度下能够促进种子幼苗的生长,增强植物的光合作用,有利于叶片叶绿素的合成速率,提高种子的酶活力和叶片抗性。本试验中,ADO是经过褐藻胶裂合酶降解褐藻胶得到的以二糖和三糖为主的ADO混合物,COS是由壳聚糖经酶解后再脱去部分乙酰基的衍生物,它们对植物的生长和生理活性的影响都得到了人们的重视。但关于ADO和COS对大麦种子萌发过程中生长情况和生理活性的综合性比较鲜有报导。上述2种海洋寡糖对大麦种子萌发和生理特性的影响研究表明:当ADO和COS的浓度分别为0.5%和0.025%时,其对大麦种子的根长、苗长和质量以及叶绿素的含量、淀粉酶活力的影响最显著。COS及ADO对根长和苗长的增量分别为对照的47.61%和20.44%、53.76%和33.47%。ADO与COS对大麦的促生长作用趋势虽然类似,但ADO对大麦的促生长效果优于COS。并且2种寡糖对根的作用效果较对苗的作用更加明显。相对于ADO而言,COS的可选促进浓度远低于ADO。在种子生长萌发过程中,由于不同种类种子的生长萌发状态、生长代谢条件及细胞膜特性等均有差异,因此经研究会表现出不同的促生长浓度。随着浓度的升高,COS对苗长的促进作用明显较小,而对苗长促生长减小的趋势较根长快,继续升高COS浓度对种子萌发及幼苗生长起到抑制作用,因此应用COS时精确掌握COS的使用浓度极为重要。
本试验中2种海洋寡糖对根长的促进作用较苗长更为明显,表明寡糖的使用在能够促进植物的光合作用的同时,更加强了种子的根系活力,有利于种子对营养物质的吸收和利用,进而提高作物的产量。经ADO(0.5%)和COS(0.025%)处理后的大麦种子淀粉酶活力及幼苗叶绿素含量也明显高于对照组,说明一定量的寡糖可以促进植物体内酶类活性的增加并有效的提高大麦幼苗的光能利用率,对增强植物幼苗的抗性,促进幼苗健壮生长具有重要的作用。
研究结果同时表明2种海洋寡糖在对植物的促生长中都起到了激素性作用,但由于2种寡糖具有自身
的生理活性,对植物的促生长表现出差异性。ADO的促生长效果优于COS,但是使用较低剂量的COS便可促进大麦的生长,ADO(0.5%)的使用浓度高于COS(0.025%)。在本文中,初步分析发现2种寡糖的主要组分具有相近的分子量范围,因此分子量对2种寡糖在促生长方面所引起的生理指标差异性影响较小。但ADO与COS对种子生长情况及生理活性的影响表明2种寡糖的分子结构、分子极性及带电荷性与寡糖活性有密切关系。这与ADO分子片段是以醛酸(-COOH)或醛酸盐(-COO-)的形式存在和COS分子的游离氨基酸(-NH2)在酸性条件下可以质子化而带正电(-NH+3)形成阳离子聚合物有密切的关系。在刘瑞志[4]和隋雪燕[12]的报道中证明不同种类的寡糖或聚糖类对植物的影响效果是存在差异的,COS在对植物的生长调节方面具有明显的激素性作用,而ADO在此方面也表现出类似的特性,由于2种寡糖在分子结构及带电荷性上的不同,因此对植物的促生长作用表现出不同的最佳促进浓度和促进效果。通过以上对2种寡糖的对比研究,在对海洋寡糖的开发利用中应针对不同的研究对象,合理选择具有不同生理活性和功能的海洋寡糖,为开拓海洋寡糖在农业生产方面的应用提供一定的科学基础和理论依据。
[1] 徐俊光,赵小明,白雪芳.两种海洋寡糖对植物病原真菌的抑制作用[J].大连水产学院学报,2007,22(2):153-155.
[2] 郭忠武,王来曦.糖化学研究进展[J].化学进展,1995,7(1):10-11.
[3] Albersheim P,Bucheli P,Doares S H.Host-pathogen interactions XXXVI.Partialpurification and characterization of heat-labile molecules secreted by the rice blast pathogen that solubilize plant cell wall fragments that kill plant cells[J].Physiological and Molecular Plant Pathology,1990,36(2):159-173.
[4] 刘瑞志.褐藻寡糖促进植物生长与抗逆效应机理研究[D].青岛:中国海洋大学,2009.
[5] Nge K L,Nwea N,Chandrkrachang S,et al.Chitosan as a growth stimulator in orchid tissue culture[J].Plant Science,2006,170:1185-1190.
[6] 郭卫华,赵小明.壳寡糖对黄瓜种子萌发和幼苗生长及光合特性的影响[J].中国农学通报,2009,25(3):164-169.
[7] 陈海燕,张彬,何勇松.壳寡糖的研究进展和应用前景[J].广东畜牧兽医科技,2007,32(2):17-20.
[8] 马纯艳,卜宁,马连菊.褐藻胶寡糖对高粱种子萌发及幼苗生理特性的影响[J].沈阳师范大学学报:自然科学版,2010,28(1):79-82.
[9] Arnon D L,Mc Swain B D.Factors influencing photosynthetic enhancement[J].Biochemical and Biophysical Research Communication,1972,49(1):68-75.
[10] 薛香,吴玉娥.小麦叶片叶绿素含量测定及其与SPAD值的关系[J].湖北农业科学,2010,49(11):2701-2702.
[11] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:169-172.
[12] 隋雪燕.壳聚糖包衣对油菜种子萌发和幼苗生长以及几个生理生化指标的影响[J].植物生理学通讯,2002,6:225-227.
[13] Fry S C,Aldington S.Oligosaccharides as signals and substrates in the plant cell wall[J].Plant Physiology,1993,103:1-5.
[14] 陈丽,陈晓艺.寡糖农药作用机理及生物来源研究进展[J].安徽农业科学,2008,36(13):5518-5519.
[15] Srivastava A,Strasser R J,Govindjee.Differential effects of dimethylbenzoquinone and dichlorobenzoquinone on chlorophyll fluorescence transient in spinach thylakoids[J].Journal of Photochemistry and Photobiology B:Biology,1995,31(3):163-169.
[16] 扈学文,许秋瑾,金相灿,等.不同分子量壳寡糖对黑麦草种子萌发和幼苗抗病酶活性影响的研究[J].中国农学通报,2007,23(2):221-225.
[17] 卜宁,马莲菊,马纯艳.褐藻胶寡糖浸种对高粱幼苗部分生理特性的影响[J].江苏农业科学,2007,2:40-42.
[18] 胡晓珂.褐藻胶裂合酶工程化研究与应用[D].青岛:中国海洋大学,2004.
Effects of Two Marine Oligosaccharides on Barley Seeds Germination and Physiological Characters
WANG Ting-Ting,ZHAO Li,XIA Xuan,WANG Peng,JIANG Xiao-Lu
(College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China)
Two marine oligosaccharides with similar molecular weight and different electric charge:Alginate-derived Oligosaccharide(ADO)and Chitosan Oligosaccharide(COS)were evaluated for the effects of different concentrations on seedling growth situation and physiological characters of barley.The growth indexes include:seedling's height,root's length,seedling's weight,root's weight and the effects on barley seed amylase activity and chlorophyll content.The barley growth indexes the seed amylase activity and chlaophyll content reached the maximum when ADO and COS were at the concentration of 0.5%and 0.025%respectively compared with the control group significantly increased(P<0.05).These results indicate that these two marine oligosaccharides have similar effect but different of the best concentration was based on their different molecule structure,providing reference for rational development of these two marine oligosaccharides.
alginate-derived oligosaccharide(ADO);chitosan oligosaccharide(COS);barley;seedlings growth;physiological activity
Q53
A
1672-5174(2011)11-061-06
国家自然科学基金项目(30901122);海洋公益性行业科研专项(201105028)资助
2011-03-16;
2011-04-24
王婷婷(1987-),女,硕士生。E-mail:smkxxwtt@163.com
**通讯作者:E-mail:jiangxl@ouc.edu.cn
责任编辑 朱宝象

