八肽胆囊收缩素对大鼠背根神经节膜电位的影响
石文艳,李丽,马克涛,李新芝,张忠双,司军强
八肽胆囊收缩素对大鼠背根神经节膜电位的影响
石文艳,李丽,马克涛,李新芝,张忠双,司军强
(石河子大学医学院/新疆地方与民族高发病教育部重点实验室,石河子832002)
八肽胆囊收缩素(CCK-8S)作为一种脑肠肽参与许多重要的生理和病理生理过程,为探讨CCK-8S在痛觉信息传递中的作用,本研究应用细胞内微电极记录技术在急性分离的大鼠背根神经节(DRG)上,观察对DRG神经元膜电位的影响。结果显示:(1)灌流CCK-8S(10-8~10-6mol/L)可以使部分 DRG神经元(25.2%,36/143)引起具有浓度依赖性的DRG神经元去极化,EC50为1.7×10-7mol/L。(2)选择性CCK-A受体拮抗剂prolu mide(10-4mol/L,n=6)基本完全阻断CCK-8S引起的去极化反应,而 CCK-B受体拮抗剂 LY225910(10-4mol/L,n=6)对CCK-8S介导的去极化则没有影响。上述结果提示CCK-8S通过CCK-A受体引起浓度依赖的DRG神经元去极化,参与痛觉信息传递或调节。
八肽胆囊收缩素;背根神经节;细胞内微电极记录技术
胆囊收缩素(cholecystokinin,CCK)是一种脑肠肽,不仅存在于消化系统,在中枢神经系统也有广泛分布。CCK主要以硫酸化的八肽胆囊收缩素(sulfated cholecystokinin octapeptide,CCK-8S)作为活性成分发挥其生物学效应。CCK-8S参与许多重要的生理和病理生理过程,如行为学、焦虑[1]、学习/记忆过程[2]、神经源性痛[3]等。根据 CCK 不同的药理作用以及分子克隆技术可将CCK受体分为两型,即CCK-A受体和CCK-B受体[4]。CCK-A受体主要分布在外周组织,如胃肠、胰腺、胆囊、幽门括约肌,亦存在于中枢神经系统的某些部位。CCK-B受体主要存在于中枢神经系统。背根神经节(dorsal r oot ganglion,DRG)作为感觉信息传入的第一级驿站,传导来自躯体皮肤及深部组织的触、压、痛、温觉及内脏感觉的神经元胞体所在部位。它是感觉冲动由外周向中枢传导的通路,在其传入终末部位通过突触前调制作用对初级感觉传入信息实现初步的加工,因而在感觉信息的传递和调制中具有重要意义。本实验应用细胞内微电极技术观察CCK-8S对Wistar大鼠DRG神经元膜电位的影响。
1 材料与方法
1.1 实验动物及药物
出生后2~3周的幼年Wistar大鼠,雌雄不拘,由新疆地方病研究所动物饲养中心提供。动物质量符合一级标准。
药物用BSS液配制,通过开关控制药物灌流标本,保持灌流速度、温度和其它成分不变。所用药物有:CCK-8S,LY 225910,prolumide由Sigma Research Biochemicals Inc.提供,其余试剂均为国产分析纯试剂。
1.2 电生理实验记录
动物在乙醚麻醉下行椎板切开术,分离L4或L5DRG及与之相连的脊神经背根,分离的离体标本立即置于充氧的平衡盐溶液(BSS)中。于体视显微镜下用游丝镊清除DRG周围的结缔组织,然后将标本用细钢针固定于记录浴槽(容积0.3 mL)底部之硅胶片上。BSS灌流速度为3~5 mL/min,灌流液温度保持在25~30℃。BSS成分为:Na Cl 140 mmol/L;KCl 5 mmol/L;CaCl22 mmol/L;Mg Cl22 mmol/L;gl ucose 5 mmol/L;Tris 5 mmol/L;将p H调至7.4。记录电极尖端直径约为0.5μm,管内充灌2 mol/L氯化钾和1 mol/L醋酸钾(KAc)混合液,微电极阻抗为15~30 MΩ。所记录的电信号经微电极放大器(MEZ28301,日本光电)放大和Powerlab数据采集处理系统。
1.3 统计方法
应用SPSS16.0统计学软件进行统计学处理,结果以¯X±S表示,采用t检验,以P<0.05为有统计学差异。
2 结果
2.1 CCK-8S对DRG神经元的膜电位的影响
预灌流CCK-8S可使部分DRG神经元(25.2%,36/143)去极化,CCK-8S在DRG神经元上引起去极化反应有浓度依赖性。3×10-8、10-7、3×10-7和10-6mol/L的 CCK-8S分别引起幅度0.9±0.16 mV(n=6)、3.5±0.08 mV(n=4)、7.8±0.19 mV(n=9)和10.9±0.34 mV(n=5)。绘制量效曲线发现CCK-8S引起DRG神经元去极化的EC50:1.7×10-7mol/L,Hill系数:1.75(图1)。

图1 CCK-8S引起DRG神经元去极化的量效关系Fig.1 Concentration-dependent depolarization induced by CCK-8S on DRG neurones
2.2 CCK-8S通过 CCK-A受体引起 DRG神经元去极化
CCK-8S引起DRG神经元去极化反应由何种受体介导,实验中预灌流选择性CCK-A受体拮抗剂prol u mide和CCK-B受体拮抗剂LY225910,分别观察其对CCK-8S引起DRG神经元去极化的影响,10-4mol/L CCK-A受体拮抗剂prolu mide基本完全阻断3×10-7mol/L的CCK-8S引起DRG神经元去极化反应(图2a),反应幅度从8.1±0.22 mV 降低到0.82±0.15 mV,见图3,(n=6,P<0.01)。而 10-4mol/L CCK-B 受 体 拮 抗 剂LY225910对CCK-8S介导的去极化没有影响(图2b),反应幅度从7.7±0.17 mV到7.6±0.31 mV,见图3,(n=6,P>0.05)。
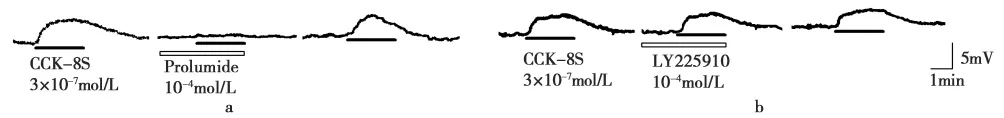
图2 CCK-A和CCK-B受体阻断剂对CCK-8S引起DRG神经元去极化的影响Fig.2 Effects of CCK-AR and CCK-BR antagonists on the depolarization CCK-8S-induced

图3 CCK-A和CCK-B受体阻断剂对CCK-8S引起DRG神经元去极化影响的柱状图Fig.3 Column graph presentation of the effects of CCK-AR and CCK-BR antagonists on the CCK-8S-induced depolarization
3 讨论
本实验在急性分离的Wistar大鼠DRG神经元上发现CCK-8S通过CCK-A受体引起浓度依赖性的去极化反应,但离子机制尚不清楚。有报道称CCK-8S可以激活小鼠大脑Orexin神经元,引起内向电流或去极化反应,CCK-A受体阻断剂lorglumide可以阻断CCK-8S对Orexin神经元的影响,与本研究结果一致。此外,非选择型阳离子通道阻断剂SKF96365能显著抑制CCK-8S引起的内向电流,预灌流无Ca2+溶液则显著增强CCK-8S介导的内向电流,提示Ca2+敏感的阳离子通道参与了CCK-8S引起的内向电流或去极化反应[5]。研究表明在黑质的神经元CCK-8S通过CCK-A受体引起去极化,此去极化反应也是由非选择性阳离子通道介导,进一步激活IP3-Ca2+-Ca M依赖的蛋白激酶PKC系统后使胞内多种底物蛋白质磷酸化,发挥生理效应[6]。也有报道称在SD大鼠的脊髓片上CCK-8S引起浓度依赖的去极化反应,此去极化反应可以被CCK-B受体阻断剂L-365260所阻断,且Na+通道阻断剂河豚毒素能够显著抑制CCK-8S引起的去极化反应,提示在SD大鼠脊髓神经元上CCK-8S引起的去极化反应由Na+通道介导[7]。为探讨CCK-8S引起大鼠DRG膜去极化离子机制及CCK-A和CCK-B在DRG分布情况,将进一步深入研究。
有实验表明,外周神经的损伤可使初级感觉神经元中内源性CCK的含量增加[8],通过初级传入终末CCK的释放,减弱内源性和外源性阿片的镇痛作用或使阿片的镇痛作用失效。此外,前期的工作发现CCK-8S结合CCK-B受体进一步激活细胞内PLC-Ca2+-PKC通路从而抑制 GABA-A 受体的功能。CCK-8S通过抑制由GABA介导的“突触前抑制”从而增强初级感觉信息的传递(包括痛觉),参与脊髓水平初级感觉信息的调制[9]。本实验发现CCK-8S通过CCK-A受体引起DRG神经元去极化,使DRG神经元膜电位距离阈电位绝对值减小,较小的伤害性刺激就可以引起DRG神经元兴奋,导致痛觉过敏或痛觉易化,从多方面参与神经病理性疼痛的调节。
[1]Andre J,Zeau B,Pohl M,et al.Involvement of cholecystokininergic systems in anxiety-induced hyperalgesia in male rats:behavioral and biochemical studies[J].J Neurosci,2005,25(35):7896-7904.
[2]Lo C M,Samuelson L C,Chambers J B,et al.Characterization of mice lacking the gene f or cholecystokinin[J].American jour nal of physiology,2008,294(3):803-810.
[3]Rehfeld J F,Friis-Hansen L,Goetze J P,et al.The biology of cholecystokinin and gastrin peptides[J].Current topics in medicinal chemistry,2007,7(12):1154-1165.
[4]Raybould H E.Mechanisms of CCK signaling from gut to brain[J].Current opinion in phar macology,2007,7(6):570-574.
[5]Tsujino N,Yamanaka A,Ichiki K,et al.Cholecystokinin activates orexin/hypocretin neurons thr ough the cholecystokinin A receptor[J].J Neurosci,2005,25(32):7459-7469.
[6]Cancela J M.Specific Ca2+signaling evoked by cholecystokinin and acetylcholine:t he roles of NAADP,c ADPR,and IP3[J].Annual review of physiology,2001(63):99-117.
[7]Oz M,Yang K H,Shippenberg TS,et al.Cholecystokinin B-type receptors mediate a G-protein-dependent depolarizing action of sulphated cholecystokinin ocatapeptide(CCK-8s)on rodent neonatal spinal ventral horn neurons[J].Journal of neurophysiology,2007,98(3):1108-1114.
[8]Hebb A L,Poulin J F,Roach S P,et al.Cholecystokinin and endogenous opioid peptides:interactive influence on pain,cognition,and emotion[J].Progress in neuro-psychophar macology & biological psychiatry,2005,29(8):1225-1238.
[9] Ma K T,Si J Q,Zhang Z Q,et al.Modulatory effect of CCK-8S on GABA-induced depolarization from rat dorsal root ganglion[J].Brain research,2006,1121(1):66-75.
The Effect of CCK-8Son the Membrane Potential of Rat Dorsal Root Ganglion
SHI Wenyan,LI Li,MA Ketao,LI Xinzhi,ZHANG Zhongshuang,SI Junqiang
(Medical College of Shihezi University/Key Laboratory of Xinjiang Endemic and Ethnic Diseases,Shihezi 832002,China)
The sulphated octapeptide fragment of cholecystokinin(CCK-8S)as a brain-gut peptide has been shown to be involved in nu merous physiological f unctions.To explore the role of CCK-8Sin trans mission of pain signal,Intracellular microelectrode recording technique was used to observe the effect of CCK-8Son the membrane potential of neuron acutely isolated in rat dorsal root ganglia(DRG).Results as follow:(1)CCK-8S(10-8~10-6mol/L)could depolarize the neur ons of DRG(25.2%,36/143)in a concentration-dependent way,and EC50was 1.7×10-7mol/L.(2)The membrane depolarization induced by CCK-8S was abolished by prolu mide(10-4mol/L),a selective antagonist of CCK-AR(n=6),but not by LY225910(10-4mol/L),a selective antagonist of CCK-BR (n=6).These results suggest that CCK-8Scauses concentration-dependent depolarization of neuron in DRG through CCK-A receptor,involved in trans mission of pain signal.
CCK-8S;DRG;intracellular micr oelectrode recording technique
R338.8
A
1007-7383(2011)04-0483-03
2011-04-22
新疆兵团青年科技创新资金项目(2010JC33),石河子大学高层次人才科研启动项目(RCZX200676)作者简介:石文艳(1977-),女,讲师,从事神经电生理学研究。
司军强(1965-),男,教授,从事神经和血管电生理学研究;e-mail:sijunqiang11@hot mail.com。

