菊苣叶片不同溶剂提取物对粘虫的生物活性
孙娈姿,呼天明,王佺珍,①,崔 健,杜金鸿
目前,中国的植物源农药研究和开发与国际上同类研究相比还有较大的差距[1]。随着人们对食品安全、环境保护和克服有害生物抗性等问题的日益重视,化学杀菌剂的使用正受到越来越严格的限制[2];而现有的各种杀虫和驱虫农药也均有一定程度的毒性和副作用,已引起了人们的关注。研究结果表明,植物体内的次生代谢产物对大多数昆虫有显著的抗生作用,而且不同寄主植物与昆虫的生长发育也有很大关系[3-5]。这些研究结果为生物农药的开发和应用提供了理论依据,目前关于不同种类植物提取物的杀虫和抑菌活性已有许多的研究报道[6-14]。基于目前状况,从天然产物中筛选出高活性物质,并以其为模板合成新型绿色农药,或直接将其开发为高效、低毒、低残留、环境友好型的天然源绿色农药制剂,亦或用纯植物天然产物驱虫剂和杀菌剂替代传统农药以减少环境污染,已是当务之急,势在必行。
菊苣(CichoriumintybusL.)为菊科(Compositae)菊苣属(CichoriumL.)多年生草本植物,原产于欧洲、西亚、中亚和北美洲,中国的西北、华北及东北等地区均有分布,是药食两用植物,具有较高的经济价值。栽培菊苣具有抗病虫害、产量高、再生能力强等特点[15-18],是具有深度开发潜力的植物物种之一。菊苣是维吾尔族和蒙古族习用药材[19],具有增强免疫能力、抗炎、降低胆固醇及降血糖等功效[20-21],国外也有关于菊苣药用功效方面的研究报道[22]。菊苣天然提取物所含的化学成分类型较多,主要有倍半萜内酯类、二萜类、倍半萜类、单萜类、黄酮类、香豆素类和甾醇类等成分[23],多变的结构类型和空间构型使该植物的提取物呈现广泛的生物活性。药理药效研究结果表明,菊苣有机溶剂提取物具有显著的细胞毒性和较强的杀虫和驱虫作用[24]。因而,利用菊苣天然产物提取物开发绿色驱虫剂,既能保护生态又无环境污染,也不存在资源短缺的问题。然而,至今未见有关菊苣叶片提取物对农业害虫防治方面的研究报道。
作者选用乙酸乙酯、乙醚和石油醚3种有机溶剂,采用冷浸和超声波提取相结合的方法提取菊苣叶片的活性成分,并以粘虫(MythimnaseparataWalker)为试虫,对菊苣叶片不同溶剂提取物的生物活性进行了测定,以期为菊苣的深度开发利用提供科学依据。
1 材料和方法
1.1 材料
菊苣新鲜叶片采自陕西杨凌西北农林科技大学牧草试验田。将叶片置于室内阴干后,用 DHG-9140A型电热恒温鼓风干燥箱(上海益恒科技仪器有限公司制造)于(40±1)℃的条件下干燥至发脆;然后用微型植物试样粉碎机粉碎,过40目筛,于密封塑料袋中保存、备用。
供试粘虫由西北农林科技大学无公害农药研究中心提供。粘虫幼虫于光照时间14 h·d-1、温度(27±1)℃、相对湿度(80±5)%的条件下用人工饲料喂养,选取同一世代、3日龄的健康幼虫供试。
1.2 方法
1.2.1 提取物制备方法 采用冷浸和超声波提取相结合的方法[2]进行提取。称取3份干粉(质量均为50 g),分别置于1000mL棕色瓶中,各加入10倍量的乙酸乙酯、乙醚或石油醚,浸泡24 h后超声波提取20m in,过滤;滤渣重复提取1次,过滤;合并滤液并用旋转蒸发仪浓缩至浸膏状,称取质量并计算得率。各提取物浸膏分别用丙酮溶解并定容至50mL(1mL丙酮溶液相当于1 g菊苣叶片干粉),即为各溶剂提取物的供试溶液,于4℃冰箱中保存、备用。
1.2.2 生物活性测定方法
1.2.2.1 毒杀活性测定方法 采用饲喂称重法[8]测定菊苣不同溶剂提取物对粘虫生长发育的影响。取不同溶剂提取物的丙酮溶液各2.5mL,对照组则取丙酮2.5m L,分别与100 g人工饲料均匀混合,配制成不同的处理饲料,置于0℃~4℃冰箱内备用。在培养皿中分别放置适量的处理饲料,每皿放入3日龄粘虫幼虫1头,然后置于温度(27±1)℃、相对湿度(80±5)%、光照时间14 h·d-1的培养箱内饲养;2 d换1次饲料,5 d后更换正常饲料饲养。每处理30头幼虫,各重复3次。详细观察记录对照组和处理组试虫的生长和存活情况;定期(培养的第1、第3、第5、第7和第9天)称量试虫的个体质量,直至试虫化蛹为止;计算并统计化蛹率和死亡率。
1.2.2.2 非选择性拒食作用测定方法 采用叶碟法进行测定[25]。将新鲜的玉米叶片剪成面积1 cm×2 cm的叶碟,分别在提取物质量浓度为0.2 g·mL-1的各供试溶液内浸泡2~3 s,对照则在丙酮中浸泡2~3 s,自然晾干后供试。在直径为9 cm的培养皿底部铺1层滤纸,加水润湿,选取大小一致、健壮并已饥饿4 h的粘虫3龄幼虫,每个培养皿中放1头;在每个培养皿内加1片叶碟,待试虫吃完后再加1片叶碟。每处理10头试虫,各设3次重复。记录试虫取食叶碟的数量,每隔24 h用方格纸测定剩余叶碟的面积,并更换新鲜叶碟,连续观察72 h,计算拒食率。
1.3 数据处理和统计
按照以下公式计算菊苣叶片不同溶剂提取物的得率以及粘虫的死亡率、校正死亡率、发育抑制率和拒食率。提取物得率 =(某溶剂提取物的浸膏质量/样品质量)×100%;死亡率 =(死亡虫数/试虫总数) ×100%;校正死亡率 =〔(处理组死亡率-对照组死亡率)/(1-对照组死亡率)〕×100%;发育抑制率 =〔(对照组试虫个体质量的增加量-处理组试虫个体质量的增加量)/对照组试虫个体质量的增加量〕×100%;拒食率 =〔(对照组平均取食叶碟面积-处理组平均取食叶碟面积)/对照组平均取食叶碟面积〕×100%。
采用 SAS及 Excel软件进行数据统计和分析,并采用Duncan’s新复极差法对数据进行显著性分析。
2 结果和分析
2.1 菊苣叶片不同溶剂提取物得率的比较
经过称量和计算,菊苣叶片乙酸乙酯、乙醚和石油醚提取物的得率分别为4.36%、1.96%和1.08%。其中,乙酸乙酯提取物的得率最高,显著高于乙醚和石油醚提取物的得率(P<0.05),但乙醚和石油醚提取物的得率差异不显著。
2.2 菊芋叶片不同溶剂提取物对粘虫幼虫生长发育的影响
2.2.1 对粘虫幼虫个体质量的影响 菊苣叶片不同溶剂提取物对粘虫幼虫个体质量的影响见表1。由表1可见,在同一饲养期内,用混合了菊苣叶片不同溶剂提取物的混合饲料饲喂的粘虫幼虫的个体质量均显著低于对照(P<0.05)。在饲养的第1天,各处理组试虫的个体质量与对照组间的差异均达到显著水平,但乙酸乙酯提取物处理组的个体质量与石油醚和乙醚提取物处理组之间的差异不显著,且乙酸乙酯提取物处理组的个体质量略高于乙醚提取物处理组;在饲养的第3至第9天,各处理组试虫的个体质量与对照组间的差异也均达到显著水平,且不同的处理组间也均有显著差异,其中,石油醚提取物处理组试虫的个体质量最高,乙醚提取物处理组次之,乙酸乙酯提取物处理组试虫的个体质量最小。据此推断,在菊苣叶片不同溶剂提取物中,石油醚提取物对粘虫幼虫个体质量的抑制作用最小,乙醚提取物的抑制作用较大,而乙酸乙酯提取物的抑制作用最大。
表1 菊苣叶片不同溶剂提取物对粘虫幼虫个体质量的影响(±SD)1)Table1 Effect of d ifferen t solven t extracts from C icho rium in tybus L.leaf on ind iv idua l weigh t of larvae of Myth im na sepa ra ta Wa lker(± SD)1)
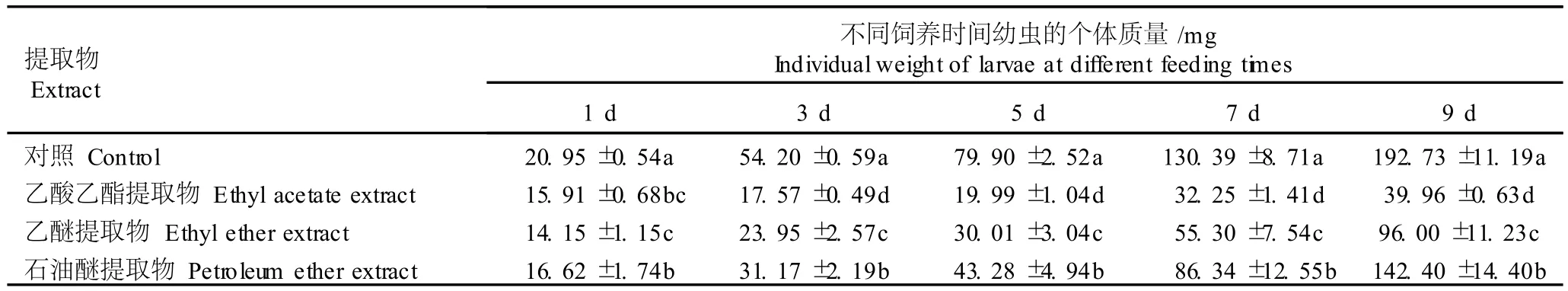
表1 菊苣叶片不同溶剂提取物对粘虫幼虫个体质量的影响(±SD)1)Table1 Effect of d ifferen t solven t extracts from C icho rium in tybus L.leaf on ind iv idua l weigh t of larvae of Myth im na sepa ra ta Wa lker(± SD)1)
1)同列中不同的小写字母表示在0.05水平上差异显著 D ifferent small letters in the same column indicate the significant difference at0.05 level.
提取物Extract不同饲养时间幼虫的个体质量/m g Individualweight of larvae at different feeding times1 d 3 d 5 d 7d 9 d对照Contro l 20.95±0.54a 54.20±0.59a 79.90±2.52a 130.39±8.71a 192.73±11.19a乙酸乙酯提取物 Ethylacetate extract 15.91±0.68bc 17.57±0.49d 19.99±1.04d 32.25±1.41d 39.96±0.63d乙醚提取物 Ethyl ether extract 14.15±1.15c 23.95±2.57c 30.01±3.04c 55.30±7.54c 96.00±11.23c石油醚提取物 Petroleum ether extract 16.62±1.74b 31.17±2.19b 43.28±4.94b 86.34±12.55b 142.40±14.40b
2.2.2 对粘虫幼虫发育的影响 菊苣叶片不同溶剂提取物对粘虫幼虫发育的影响见表2。菊苣叶片3种溶剂提取物对粘虫发育的抑制程度有一定差异,在整个实验期间石油醚提取物对试虫的发育抑制率一直显著低于乙酸乙酯和乙醚提取物。随着饲养时间的延长,菊苣叶片不同溶剂提取物处理组粘虫的发育抑制率变化略有差异。其中,乙酸乙酯提取物处理组粘虫的发育抑制率持续升高,饲养第9天发育抑制率最高,为79.27%;乙醚和石油醚提取物处理组粘虫的发育抑制率则表现为先升高后降低的趋势,均在饲养第5天达到最大值,分别为62.44%和45.83%。
菊苣叶片不同溶剂提取物对粘虫幼虫发育的抑制效应与其对幼虫个体质量的影响效应基本一致,均为乙酸乙酯提取物的抑制作用最大,乙醚提取物也具有较大的抑制作用,石油醚提取物的抑制作用最小。
2.2.3 对粘虫化蛹和存活状况的影响 菊苣叶片不同溶剂提取物对粘虫化蛹和存活状况的影响见表3。由表3可见,与对照相比,经不同溶剂提取物混合饲料饲养的粘虫的幼虫期均显著延长,在乙酸乙酯、乙醚和石油醚提取物处理组中,试虫的幼虫期分别比对照延长了4.19、3.62和11.78 d。饲喂乙酸乙酯和乙醚提取物混合饲料的试虫单蛹质量均显著大于对照,饲喂石油醚提取物混合饲料的试虫的单蛹质量与对照组间差异不显著。
由表3还可见,饲喂菊苣叶片不同溶剂提取物混合饲料的试虫的化蛹率和死亡率均受到一定程度的影响。总体上看,各处理组试虫的化蛹率低于对照组、死亡率则高于对照组,且均与对照组间有显著差异。其中,乙酸乙酯提取物的影响作用最大,饲喂乙酸乙酯提取物混合饲料的试虫化蛹率仅为50.00%、死亡率高达57.80%。经过计算,乙酸乙酯、乙醚和石油醚提取物处理组试虫的校正死亡率依次为52.05%、26.40%和20.07%。
综合分析结果显示,在供试的3种菊苣叶片提取物中,乙酸乙酯提取物对粘虫化蛹和存活状况的影响效应最大,石油醚提取物的影响效应最小。

表2 菊苣叶片不同溶剂提取物对粘虫幼虫发育的影响Table2 Effect of d ifferen t solven t extracts from C icho rium in tybus L.leaf on developm en t of Myth im na sepa ra ta Wa lker larvae
表3 菊苣叶片不同溶剂提取物对粘虫化蛹及存活状况的影响(±SD)1)Table3 Effects of d ifferen t solven t extracts from C icho rium in tybus L.leaf on sta tus of pupa tion and surv iva l of Myth im na sepa ra ta Wa lker larvae(±SD)1)

表3 菊苣叶片不同溶剂提取物对粘虫化蛹及存活状况的影响(±SD)1)Table3 Effects of d ifferen t solven t extracts from C icho rium in tybus L.leaf on sta tus of pupa tion and surv iva l of Myth im na sepa ra ta Wa lker larvae(±SD)1)
1)同列中不同的小写字母表示在0.05水平上差异显著 D ifferent small letters in the same column indicate the significant difference at0.05 level.
提取物Extrac t幼虫期/d Larval tim e单蛹质量/mg Weightper pupa化蛹率/% Pupation rate死亡率/% Mo rtality校正死亡率/% Co rrectedmortality对照Contro l 19.71±0.79c 285.15±9.24b 88.90±1.91a 12.00±3.46c -乙酸乙酯提取物Ethyl acetate extrac t 23.90±0.64b 345.89±25.05a 50.00±6.70c 57.80±8.40a 52.05乙醚提取物Ethyl ether extract 23.33±0.99b 335.99±19.80a 80.00±3.30b 35.23±1.37b 26.40石油醚提取物Petroleum ether extract 31.49±2.74a 313.95±20.57b 75.57±5.09b 29.66±4.51b 20.07
2.3 菊苣叶片不同溶剂提取物对粘虫的拒食作用
实验结果表明(表4),菊苣叶片3种溶剂提取物对粘虫3龄幼虫均有较强的拒食作用。3种溶剂提取物处理组的取食叶碟面积均小于对照组,其中,乙酸乙酯和乙醚提取物处理组在24、48和72 h的取食叶碟面积均显著小于石油醚提取物处理组和对照组,而石油醚提取物处理组在24和48 h的取食叶蝶面积显著小于对照组,但在72 h的取食叶碟面积与对照组差异不显著。
从平均拒食率看,粘虫3龄幼虫对菊苣叶片乙酸乙酯和乙醚提取物的平均拒食率均在70%以上,均高于石油醚提取物。其中,乙酸乙酯提取物处理组的平均拒食率最高,24、48和72 h的平均拒食率分别达到84.56%、84.40%和84.43%;乙酸乙酯和乙醚提取物处理组的平均拒食率在72 h内变化不大,而石油醚处理组的平均拒食率在72 h内随时间的延长明显减小,至72 h时平均拒食率仅为16.67%。
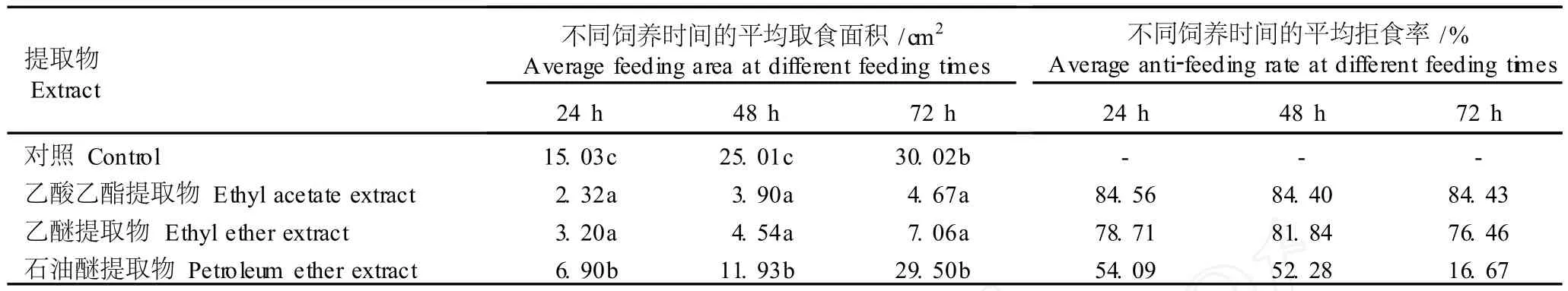
表4 菊苣叶片不同溶剂提取物对粘虫幼虫的拒食作用1)Table4 An ti-feed ing effect of d ifferen t solven t ex tracts from C icho rium in tybus L.leaf to Myth im na sepa ra ta Wa lker larvae1)
3 讨论和结论
实验结果显示,菊苣叶片乙酸乙酯、乙醚和石油醚提取物的得率依次降低,以石油醚提取物的得率最低,仅1.08%。由于乙酸乙酯、乙醚和石油醚的极性依次递减,根据相似相溶的原理,可初步推断菊苣叶片中极性化学成分较多、亲脂性成分相对较少。
随着饲养时间的延长,菊苣叶片乙酸乙酯提取物处理组试虫的发育抑制率呈持续升高的趋势,而乙醚和石油醚提取物处理组则呈先升高后降低的趋势,并在培养第5天达到最高值。这可能是由于实验的前期至中期(1~5 d)都是用混合了不同提取物的混合饲料喂养试虫,且正常状态下第5天是粘虫个体质量增加幅度较大的时期,故发育抑制率最高;而实验的中期至后期(5 d后)更换正常饲料喂养,乙醚和石油醚提取物对试虫生长发育的抑制作用减小,表现为发育抑制率的减小;而乙酸乙酯提取物处理组虽然也更换了正常饲料喂养试虫,但试虫并没有马上恢复正常生长状态,而是呈现平缓下降的过程,培养第7天至第9天,表现为乙酸乙酯提取物处理组试虫的发育抑制率持续上升。说明菊苣叶片乙醚和石油醚提取物对粘虫幼虫发育的抑制作用小于乙酸乙酯提取物,且后者对粘虫幼虫发育的抑制作用有一定的持续性。菊苣叶片乙酸乙酯、乙醚和石油醚提取物处理组粘虫的校正死亡率依次为52.05%、26.40%和20.07%;各处理组的幼虫期均较对照组延长,且化蛹率也显著小于对照组,并以乙酸乙酯提取物的影响最大;另外,乙酸乙酯和乙醚提取物处理组试虫的单蛹质量显著大于对照组,可能与幼虫期的延长(生长日数增加)有关。综合分析结果表明,在菊苣叶片的3种溶剂提取物中,乙酸乙酯提取物对粘虫生长发育的影响效果最显著;石油醚为典型非极性溶剂,其提取物大部分为脂溶性成分,生物活性相对较低。
与菊苣同科的向日葵属(HelianthusL.)植物内含有丰富的倍半萜类化合物,且此类化合物具有抑菌等生物活性[26-27],菊苣叶片中的活性成分是否属于倍半萜类化合物,以及化合物结构与活性的关系等问题,尚需进行进一步的成分分离和生物活性跟踪测定。
不同溶剂提取物对粘虫的生物活性与饲料中所含有毒成分的种类和性质及粘虫在不同发育时期的代谢能力有关[28];食物中有害物质的存在也可能会延长害虫的生命周期[29],导致害虫生理周期的紊乱;通过添加植物的不同次生化学成分或改变饲料营养成分来诱导(或激发)昆虫体内的生理生化抑制机制以调节其生长发育过程[30]。可见,植物提取物对害虫的生物活性机制较复杂,因而,关于菊苣叶片提取物对粘虫的致毒机制还需进一步深入研究和探讨。
粘虫取食经菊苣叶片乙酸乙酯、乙醚和石油醚提取物处理的饲料后,其生长发育受到不同程度的影响,从而影响其个体质量、单蛹质量、化蛹率、死亡率及拒食率,并使其幼虫期延长;菊苣叶片乙酸乙酯、乙醚和石油醚提取物虽然不能完全导致粘虫死亡,但是能有效抑制粘虫的生长发育,不同程度延长粘虫的生长时期,错开农时进而减少粘虫对作物的危害。使用菊苣叶片提取物合成的驱虫剂,由于其成分来源于植物天然产物,因此无环境污染的潜在危险。由此可见,以菊苣为原材料开发生产农用驱虫剂非常符合“绿色环保”的要求,在农业生产实践中具有较广阔的应用前景。
[1]沈建国,翟梅枝,林奇英,等.我国植物源农药研究进展[J].福建农林大学学报:自然科学版,2002,31(1):26-31.
[2]滕 云,余志义,崔文华,等.高山绣线菊提取物对几种植物真菌的抑制活性及其活性成分[J].中国农业科学,2009,42(7):2380-2385.
[3]谭维嘉,杨雪梅,郭予元.寄主植物对棉铃虫生理代谢的影响[J].植物保护学报,1993,20(3):147-153.
[4]Manners A G,PalmerWA,Dhileepan K,et al.Characterising insectp lanthost relationships facilitates understandingmu ltip le host use[J].A rthropod-Plant Interactions,2010,4(1):7-17.
[5]GrainneM.Handbook of Plantswith Pest Control Properties[M]. New York:JohnWiley and Sonx Inc.,1988.
[6]李 美,高兴祥,高宗军,等.苍耳等48种植物提取物的杀虫活性[J].植物资源与环境学报,2008,17(1):33-37.
[7]黄军海,刘国强,白红进,等.13种卫矛科植物杀虫活性研究[J].西北植物学报,2004,24(4):688-692.
[8]王建斌,马志卿,冯俊涛,等.脱氧鬼臼毒素对粘虫生殖力的影响[J].西北农林科技大学学报:自然科学版,2009,37(1):167-171.
[9]贾双双,高荣广,徐 坤.番茄砧木对南方根结线虫抗性鉴定[J].中国农业科学,2009,42(12):4301-4307.
[10]李育川,郭晓生,邵清松,等.小桐子枝叶提取物对蚜虫的毒杀活性[J].植物资源与环境学报,2009,18(2):89-93.
[11]李维蛟,李 强,胡先奇.木醋液的杀线活性及对根结线虫病的防治效果研究[J].中国农业科学,2009,42(11):4120-4126.
[12]王 燕,吴振宇,杜艳丽,等.牵牛子种子提取物对朱砂叶螨触杀活性的测定 [J].中国农业科学,2009,42(8):2793-2800.
[13]张永强,丁 伟,赵志模,等.黄花蒿提取物对朱砂叶螨生物活性的研究[J].中国农业科学,2008,41(3):720-726.
[14]齐军山,陈靠山,李 美,等.40种杂草的丙酮提取物对3种植物病原真菌的抑菌活性[J].植物资源与环境学报,2008,17(3):49-52.
[15]N ielsen BK,Tham sborg SM,Hansen H,et al.Effects of inc luding chicory in perennial ryegrass-white clover leys on p roduction and health in organic lambs[J].L ivestock Science,2009,125(1):66-73.
[16]Heim lerD,Iso laniL,V ignolini P,et al.Polyphenol content and antiradical activity ofCichoriumintybusL.from biodynam ic and conventional farm ing[J].Food Chem istry,2009,114(3):765-770.
[17]Kiær L P,Felber F,FlavellA,et al.Spontaneous gene flow and population structure in w ild and cultivated chicory,Cichorium intybusL.[J].Genetic Resources and Crop Evolution,2009,56(3):405-419.
[18]Kikuchi H,Inoue M,Saito H,et al.Industrial p roduction of difructose anhydrideⅢ(DFA Ⅲ)from crude inulin extracted from chicory roots usingArthrobactersp.H65-7 fructosyltransferase[J].Journal of Bioscience and Bioengineering,2009,107(3):262-265.
[19]维吾尔药志编委会.维吾尔药志:上册[M].修订版.乌鲁木齐:新疆科技卫生出版社,1999.
[20]Trdan S,Valiˇc N,Jerman J,et al.Efficacy of three natural chem icals to reduce the damage ofErysiphecichoracearumon chicory in two meteorologically different grow ing seasons[J]. Journal of Phytopathology,2004,152(10):567-574.
[21]Ramalakshm i K,Rao PG P,Abraham KO.Chem ical analysis of chicory[root]samp les[J].Indian C of fee,1994,58(3):22-24. [22]Perin L.Chicory inmedicine[J].Revue de Patho logie Générale et de Physiologie C linique,1964,64:209.
[23]Milala J,Grzelak K,KrolB,etal.Composition and p roperties of chicory extracts rich in fructansand polyphenols[J].Po lish Journal of Food and Nutrition Sciences,2009,59(1):35-43.
[24]Schm idtBM,Ilic N,Poulev A,etal.Toxicologicalevaluation of a chicory rootextract[J].Food and Chem ical Toxico logy,2007,45(7):1131-1139.
[25]胡绍海,胡卫军,万冰清.27%皂素烟碱可溶性浓剂防治菜青虫试验[J].农药,1997,36(6):37-39.
[26]索茂荣,杨峻山.向日葵属植物倍半萜类化学成分及其生物活性研究概况[J].中草药,2006,37(1):135-140.
[27]徐雅梅,呼天明,张存莉,等.菊苣根提取物的抑菌活性研究[J].西北植物学报,2006,26(3):615-619.
[28]李广泽,马志卿,冯俊涛,等.砂地柏提取物、鬼臼毒素和脱氧鬼臼毒素对粘虫幼虫生长发育和食物利用的影响[J].昆虫学报,2006,49(3):404-409.
[29]付昌斌,张 兴.砂地柏提取物对粘虫肠道组织的的影响[J].西北农业大学学报,1998,26(3):6-10.
[30]周 琳,马志卿,冯俊涛,等.雷公藤总生物碱对粘虫生长发育及几种代谢酶系的影响[J].昆虫学报,2008,51(11):1151-1156.

