红色荧光定量分析法评价釉质早期龋的临床研究
尹伟 冯岩 胡德渝 Roger P. Ellwood Iain A. Pretty
(1.口腔疾病研究国家重点实验室, 四川大学, 四川 成都610041;2.福建医科大学附属口腔医院 预防科, 福建 福州350002;3.Dental Health Unit, The University of Manchester, Manchester M15 6SH, UK)
定量光导荧光(quantitative light-induced fluore- scence,QLF)技术的基本原理是在单色蓝光照射下牙齿出现自发荧光现象。目前,多数关于QLF技术的研究[1-2]是基于绿色荧光进行分析,并已证实龋损区绿色荧光损失量与其组织学严重程度具有高度相关性。此外有研究[3]发现,应用蓝光照射龋坏组织时,相应区域不仅有绿色荧光减弱的现象,也伴随有红色或者桔红色荧光产生。迄今为止,关于龋损区红色荧光的研究多停留于对现象的定性描述,缺乏定量评价的资料,其临床使用价值亦尚未明确。
本研究运用QLF技术评价龋损区红色荧光的变化,以判断使用含氟牙膏促进前牙光滑面早期龋再矿化的临床效果,并通过与绿色荧光指标相比较,明确红色荧光指标反映龋损区脱矿程度的能力,探索该技术在早期龋临床诊断中的应用价值。
1 材料和方法
1.1 研究对象
选择四川省成都市双流县3所小学的96名在校学生为研究对象,其中男性49名,女性47名,年龄11~13岁,平均(12.29±1.27)岁。要求研究对象的上颌前牙唇面中至少有1个光滑面早期龋,其诊断标准为:使用无油压缩空气干燥,每颗牙干燥5 s,可以见到白垩色的局限性病变,但无牙体组织缺损,通常位于牙颈缘等菌斑聚集区;该区域通过QLF系统能观察到荧光改变。试验前由研究对象的父母或监护人签署知情同意书。
1.2 试验方法
符合条件的研究对象接受统一分发的含氟牙膏(有效成分为Na2PO3F,氟离子质量分数为0.145%)和牙刷,要求每天刷牙3次,每次1 min,包括每天在学校里由校医监督刷牙1次和在家里由父母或监护人监督刷牙2次(早晚各1次),持续时间为6个月。在此期间,研究对象不采用其他口腔卫生措施,如漱口水、口香糖等。在试验前(基线)和6个月后使用QLF系统(Inspektor Research System BV公司,荷兰)以研究对象每个已完全萌出的上颌前牙为焦点,摄取一张对应的荧光图像。因为研究对象的年龄不同,其完全萌出的牙数存在差异,所以每个研究对象获得的图像数为4~6张。由分析者使用QLF软件分析图像的红色荧光和绿色荧光状态,获得数据。
1.3 QLF检测系统和方法
QLF设备的发光系统是一盏50 W的氙弧灯,其发出的高强度蓝光(波长为370 nm)经液体光导传导照射在牙齿表面,可以激发出不同特征的荧光,经带电荷耦合装置(charge couple device,CCD)的高分辨率彩色照相机拍摄下来,通过图像采集和数字化转换后,运用软件系统进行图像分析。
1.3.1 红色荧光分析 运用Inspektor-Pro 2.0.0.37软件(Inspektor Research System BV公司,荷兰)分析龋损区红色荧光量。依据牙面荧光的差异(正常釉质呈均匀的绿色荧光,龋损区荧光量减弱或有颜色改变),由研究者在软件界面上圈定可疑的病损范围。要求圈定的范围位于牙面内,包括并适当大于荧光变化区域。范围圈定后,软件将自动显示出龋损区的红色荧光分布状态,并输出荧光面积(Ar)和平均荧光量(△R)。将上述荧光变量值导入Excel表格,计算出红色荧光总量R,R=Ar×△R。
1.3.2 绿色荧光分析 使用QLF 2.00软件(Inspektor Research System BV公司,荷兰)分析早期龋损区的绿色荧光量,获取荧光面积(Aw)、平均荧光损失量(△F)和荧光损失总量(△Q)[4]。将上述变量值输出到Excel表格。
1.4 研究者
所有研究对象的荧光图像评价均由同一名口腔医师完成。该研究者具有丰富的QLF设备操作经验,对于龋损区荧光分析的自身Kappa值达到0.78[5]。
1.5 数据整理和分析
由于△Q和R呈明显偏态分布,统计时将其进行对数转换。使用SPSS 11.5统计软件评价红色和绿色荧光对应变量(即Ar和Aw、△R和△F、lgR和lg△Q)的相关关系,计算Pearson相关系数,并采用配对t检验比较6个月后红色荧光变量和绿色荧光变量相对于基线的变化情况。
2 结果
基线时,96名研究对象的上颌前牙光滑面荧光图像共显示有367处早期釉质龋损,平均每人3.82处。该96名学生全部完成了为期6个月的临床研究。
图1为1例12岁男性研究对象的上颌前牙光滑面龋损情况。由图1可见,已完全萌出的6颗上颌恒前牙唇面共有4处早期釉质龋损,分别位于上颌中切牙和侧切牙上;红色和绿色荧光分析模拟图像代表的病损范围基本一致。在使用含氟牙膏6个月后,早期龋损范围缩小,荧光强度亦明显下降,提示病损区脱矿的程度得到了改善。
参照基线时研究对象早期龋定量分析结果,评价2种荧光分析方法的相关性,其结果见表1。由表1可见,96名研究对象的红色荧光变量与相对应的绿色荧光变量具有良好的相关性,Ar和Aw、△R和△F、lgR和lg△Q的相关系数分别为0.89、0.54、0.72,均有统计学意义(P<0.05)。
96名研究对象上颌前牙光滑面早期龋损在基线和6个月后的QLF检测指标见表2。采用配对t检验对龋损区各指标进行比较,结果表明:与基线相比,使用含氟牙膏6个月后,无论红色荧光变量还是绿色荧光变量,龋损区的荧光面积(Ar和Aw)、平均荧光量(△R和△F)和荧光总量(lgR和lg△Q)均明显降低,且与基线的差异均有统计学意义(P<0.05)。
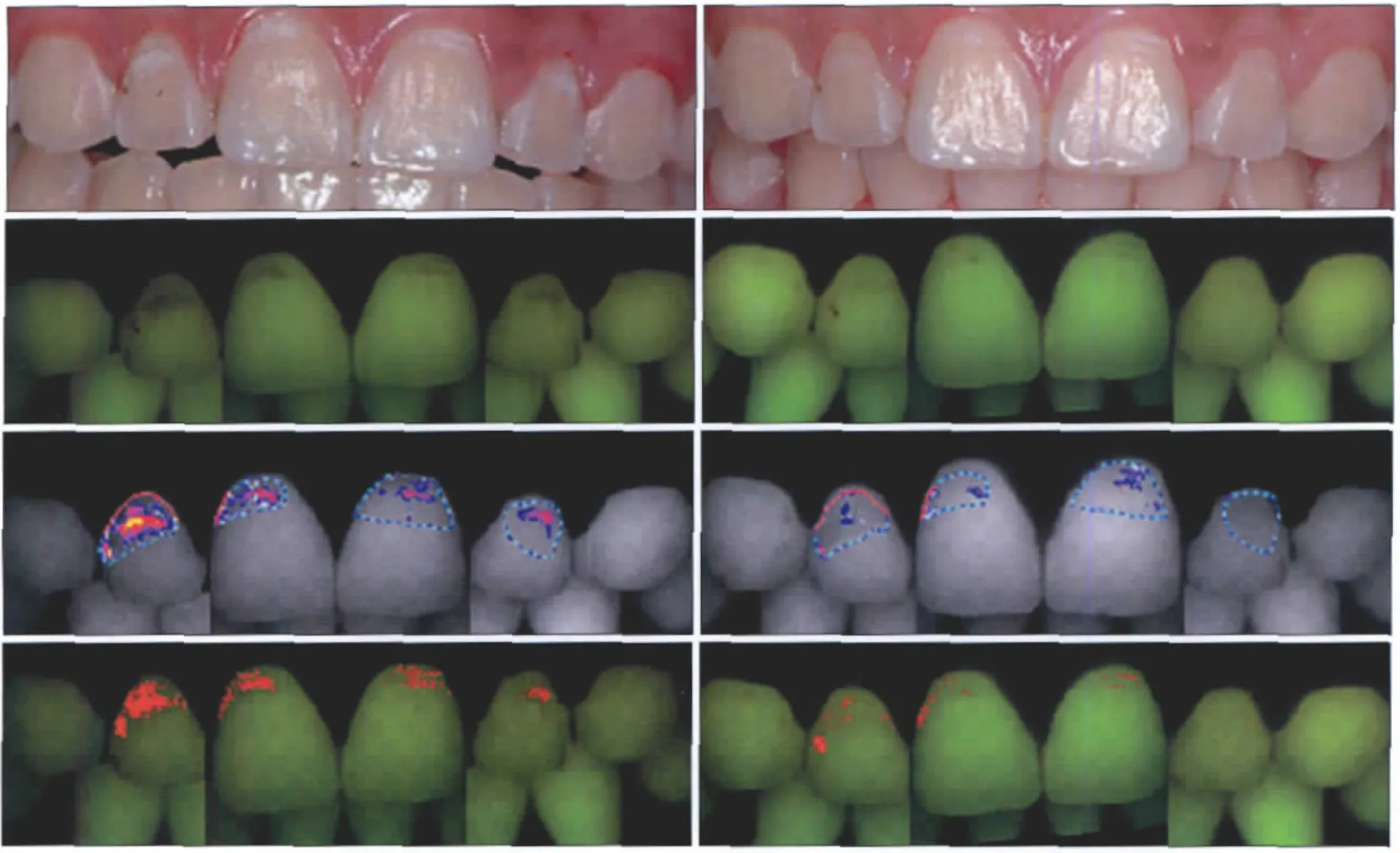
图1 上颌前牙光滑面早期龋及使用含氟牙膏6个月前后的荧光图像Fig 1 Fluorescence images of carious lesions in mandible anterior teeth before and after six months use of fluoride toothpaste
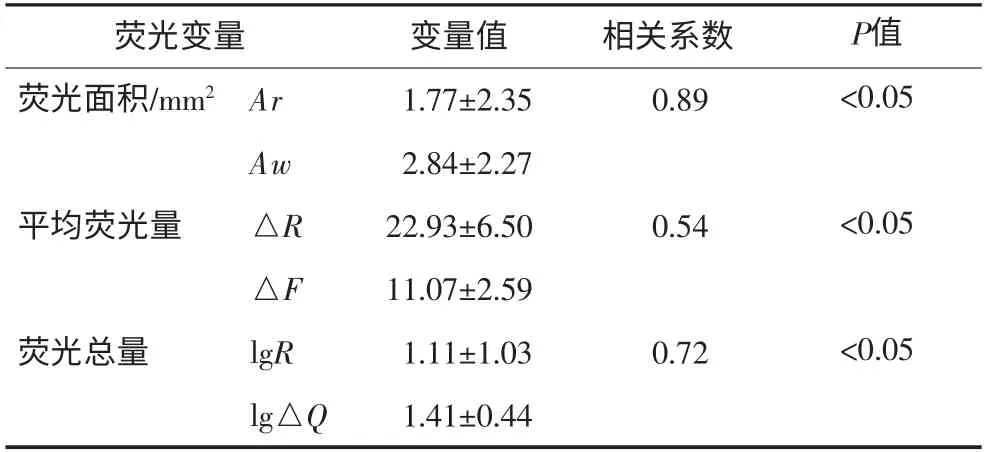
表1 光滑面早期龋红色和绿色荧光分析指标及其相关性Tab 1 Correlations between red and green fluorescence metrics of carious lesions
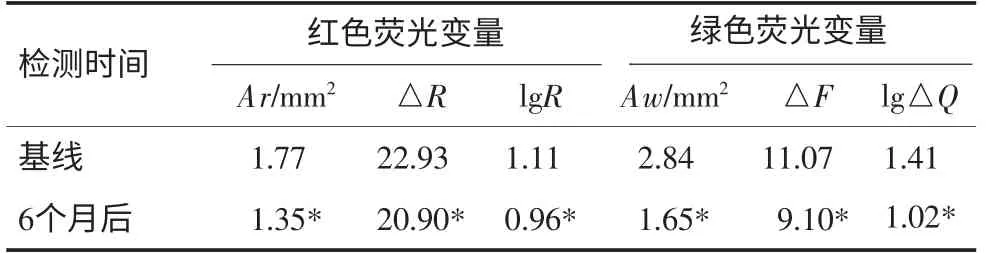
表2 使用含氟牙膏6个月后光滑面早期龋荧光指标的变化情况Tab 2 Decreasing of QLF metrics of carious lesions after six months use of fluoride toothpaste
3 讨论
目前QLF技术是适用于龋损临床检测且有发展前景的少数方法之一,已受到口腔医学领域广泛的关注和重视。该技术的基础是可见光激发牙齿组织的荧光现象,通常可观察到红色和绿色2种。目前认识较深入、应用较多的是绿色荧光,是来源于双酪氨酸基团[6]、蛋白质发色基团以及羟磷灰石晶体[7]等的自发荧光。龋损发生时,釉质微观结构改变可导致其光传导性减弱、蛋白质发色基团丢失,或者分子构成改变,从而使荧光的产生受到影响,龋损区在均匀的绿色荧光区域中显示为暗区。有学者[1,8]运用软件对龋损区的绿色荧光状态进行分析,获得的定量指标(通常是荧光损失总量)与龋损区组织学变化具有高度相关性(r为0.73~0.86)。
早在20世纪20年代,口腔医学研究者就观察到龋损区硬组织可发出红色荧光。近年的研究[9-11]提示,红色荧光主要来源于菌斑生物膜,包括细菌代谢产物如卟啉素等物质渗入龋损区脱矿组织,在激发条件下即可产生红色荧光。很多学者[12-14]在实验中运用QLF技术(波长为405 nm)观察到牙面正常菌群包括中间普雷沃菌、内氏放线菌、衣氏放线菌等显示红色或桔红色的荧光。Thomas等[14]进一步分析了单菌种红色荧光和菌斑红色荧光之间的关系,发现二者的相关性不高,提示菌斑红色荧光可能不是由单一菌种引起的。还有学者[15]在链球菌致早期龋的体外实验中观察到红色荧光现象,而单纯链球菌的培养菌悬液却没有或者极少产生红色荧光。这些研究结果表明,口腔细菌与牙体组织的相互作用可能是红色荧光产生的原因之一,推测其机制为产色基团构成改变或者红色荧光基团暴露。
尽管在光滑面龋、窝沟龋、继发龋等区域均观察到红色荧光现象,但是目前龋损区荧光学的研究仍以牙齿组织的绿色荧光为主,并且获得了不少有价值的研究成果。而对于红色荧光的研究更加关注其与口腔细菌的关系,进而应用于菌斑生态学的研究和菌斑控制效果的评价。笔者认为,将红色荧光检查纳入龋病荧光学评价中,不仅丰富了龋病早期研究的技术方法,也有利于从菌斑性病因机制的角度监测龋损的变化。
红色荧光分析软件主要包括Adobe Photoshop、QLF Patients、Inspektor-Pro 2.0.0.37等。Inspektor-Pro 2.0.0.37软件使得红色荧光的定量评价成为现实。与绿色荧光评价软件QLF 2.00一样,Inspektor-Pro 2.0.0.37以数学运算为基础,计算指标为龋损区荧光值与健康釉质荧光值之间的差异,并以其占健康釉质荧光值百分比的形式表示出来,计算公式[2]如下:。该软件分析后自动给出龋损区荧光面积、平均荧光量和荧光总量3个指标,这3个指标与绿色荧光分析定量指标存在一一对应的关系。本研究结果表明,龋损区红色荧光分析与绿色荧光分析具有高度的相关性。一方面,2种荧光图像上的病损范围相互重叠的程度较高;另一方面,2种荧光分析的对应指标的相关系数也较高。红色荧光检测和绿色荧光检测一样,也能够反映个体早期龋损的严重程度,这为临床龋损评价提供了另一种可靠的选择方法。
本组研究对象在使用含氟牙膏6个月后,可以看到龋损区红色荧光变量明显下降,结合数码照片观察和绿色荧光的定量分析结果,提示早期龋损发生了明显的再矿化。冯岩等[16]证实,绿色荧光的纵向评价能够敏感地区分不同产品的抗龋效果,具有减少样本量、缩短研究周期的明显效益。本研究则进一步表明,红色荧光分析同样能够高效、敏感地反映出氟化物防治儿童龋损的临床效果。
[1] Emami Z, al-Khateeb S, de Josselin de Jong E, et al. Mineral loss in incipient caries lesions quantified with laser fluorescence and longitudinal microradiography. A methodologic study[J]. Acta Odontol Scand, 1996, 54(1):8-13.
[2] de Josselin de Jong E, Sundström F, Westerling H, et al. A new method for in vivo quantification of changes in initial enamel caries with laser fluorescence[J]. Caries Res, 1995, 29(1):2-7.
[3] Shigetani Y, Okamoto A, Abu-Bakr N, et al. Caries diagnosis using a laser fluorescence system—observation of autofluorescence of dental caries[J]. Dent Mater J, 2003, 22(1):56-65.
[4] Tranaeus S, Shi XQ, Lindgren LE, et al. In vivo repeatability and reproducibility of the quantitative light-induced fluorescence method[J]. Caries Res, 2002, 36(1):3-9.
[5] Yin W, Feng Y, Hu D, et al. Reliability of quantitative laser fluorescence analysis of smooth surface lesions adjacent to the gingival tissues[J]. Caries Res, 2007, 41(3):186-189.
[6] Booij M, ten Bosch JJ. A fluorescent compound in bovine dental enamel matrix compared with synthetic dityrosine[J]. Arch Oral Biol, 1982, 27(5):417-421.
[7] Spitzer D, Bosch JJ. The total luminescence of bovine and human dental enamel[J]. Calcif Tissue Res, 1976, 28(2):201-208.
[8] Hafström-Björkman U, Sundström F, de Josselin de Jong E, et al.Comparison of laser fluorescence and longitudinal microradiography for quantitative assessment of in vitro enamel caries[J]. Caries Res,1992, 26(4):241-247.
[9] Coulthwaite L, Pretty IA, Smith PW, et al. The microbiological origin of fluorescence observed in plaque on dentures during QLF analysis[J]. Caries Res, 2006, 40(2):112-116.
[10] Pretty IA, Edgar WM, Smith PW, et al. Quantification of dental plaque in the research environment[J]. J Dent, 2005, 33(3):193-207.
[11] König K, Schneckenburger H, Hibst R. Time-gated in vivo autofluorescence imaging of dental caries[J]. Cell Mol Biol(Noisyle-grand), 1999, 45(2):233-239.
[12] Lennon AM, Buchalla W, Brune L, et al. The ability of selected oral microorganisms to emit red fluorescence[J]. Caries Res, 2006,40(1):2-5.
[13] van der Veen MH, Thomas RZ, Huysmans MC, et al. Red autofluorescence of dental plaque bacteria[J]. Caries Res, 2006, 40(6):542-545.
[14] Thomas RZ, van der Mei HC, van der Veen MH, et al. Bacterial composition and red fluorescence of plaque in relation to primary and secondary caries next to composite:An in situ study[J].Oral Microbiol Immunol, 2008, 23(1):7-13.
[15] Shigetani Y, Takenaka S, Okamoto A, et al. Impact of Streptococcus mutans on the generation of fluorescence from artificially induced enamel and dentin carious lesions in vitro[J]. Odontology,2008, 96(1):21-25.
[16] 冯岩, 尹伟, 胡德渝, 等. 定量光导荧光技术评价含氟牙膏抑制早期龋损效果的临床研究[J]. 华西口腔医学杂志, 2008, 26(6):607-610.
FENG Yan, YIN Wei, HU De-yu, et al. Detection and prevention of early caries after fluoride dentifrice application using quantitative light-induced fluorescence in vivo[J]. West China J Stomatol, 2008, 26(6):607-610.

