新型多孔磷酸钙复合骨髓基质干细胞组织工程实验研究
王磊 李耀俊 章燕 潘可风 黄远亮 刘昌胜 蒋欣泉
(1.上海市长宁区虹桥街道社区卫生服务中心口腔科,上海200051;2.同济大学附属东方医院口腔科,上海200120; 3.同济大学附属口腔医院口腔颌面外科,上海200072;4.华东理工大学材料科学与工程学院,上海200237; 5.上海交通大学医学院附属第九人民医院口腔生物工程实验室,上海200011)
新型多孔磷酸钙复合骨髓基质干细胞组织工程实验研究
王磊1李耀俊2章燕3潘可风3黄远亮2刘昌胜4蒋欣泉5
(1.上海市长宁区虹桥街道社区卫生服务中心口腔科,上海200051;2.同济大学附属东方医院口腔科,上海200120; 3.同济大学附属口腔医院口腔颌面外科,上海200072;4.华东理工大学材料科学与工程学院,上海200237; 5.上海交通大学医学院附属第九人民医院口腔生物工程实验室,上海200011)
目的观察新型生物材料多孔磷酸钙的生物相容性及复合骨髓基质干细胞(BMSCs)异位成骨情况。方法体外培养第2代Beagle犬BMSCs,转染绿色荧光蛋白(GFP)后与多孔磷酸钙(CPC)复合培养,获得最佳复合浓度,倒置和荧光显微镜、扫描电镜下观察BMSCs黏附和生长情况,复合体植入裸鼠皮下8周观察异位成骨。结果BMSCs转染GFP与多孔CPC复合培养1 d,细胞从材料中爬出,形态正常,7 d可见细胞伸出伪足,分泌基质;复合体可异位成骨。结论多孔CPC生物相容性好,是一种较理想的骨组织工程支架材料。
多孔磷酸钙;骨组织工程;支架材料;骨髓基质干细胞
组织工程支架材料是组织工程化骨的最基本构架。按照材料的化学特性分类,应用在组织工程支架的材料有无机材料、有机材料和复合材料等。组织工程支架材料不仅影响细胞的生物学行为和培养的效率,而且决定着移植后能否与机体适应、结合和修复,是能否应用于临床的关键因素[1]。良好的细胞支架材料可为特定细胞提供结构支撑和模板引导作用。无机生物材料的成分与骨相似,降解产物易于机体内代谢或吸收,无明显副作用。本实验通过观察新型无机生物材料自固化多孔磷酸钙(calcium phosphate cement,CPC)复合Beagle犬骨髓基质干细胞(bone marrow stromal cells,BMSCs)体外黏附、生长和体内异位成骨的情况,筛选适于种子细胞发挥生理功能的骨组织工程支架材料。
1 材料和方法
1.1 实验材料和仪器
自固化多孔磷酸钙人工骨(上海瑞邦生物材料有限公司)、重组腺病毒Adv-GFP(北京大学生命科学院)、恒温CO2培养箱(Quene System公司,德国)、IMT-1型倒置相差显微镜(Olympus公司,德国)、PHILIP XL30型扫描电镜(PHILIP公司,荷兰)。1岁普通级Beagle犬,5周龄健康Nu/Balb-c裸鼠,经上海实验动物质检站检测,由上海交通大学医学院附属第九人民医院动物中心提供和饲养。
1.2 实验方法
1.2.1 BMSCs的体外培养常规方法[2]获取Beagle犬的骨髓BMSCs,在体外进行培养和诱导至第2代,备用。
1.2.2 BMSCs与CPC复合的最佳浓度的筛选将多孔CPC颗粒分别放入96孔板中的48孔内,离体培养的第2代BMSCs制备成细胞悬液,密度分别为:每毫升2.0×105、4.0×105、6.0×105、8.0×105、10×105个后,在放置有多孔CPC的孔内滴上述细胞悬液各200 μL,每种密度接种8孔为1组,另外8孔内加入200 μL条件培养液作为空白对照。置于培养箱中培养,隔日换液。第5天分别将各孔中的多孔CPC取出,用PBS洗去未黏附的细胞,置于另一96孔板中继续培养,用0.25%胰酶-0.02%EDTA消化10 min,测定各孔A值。以每组8例样本A值的均数描记BMSCs在多孔CPC上的附着细胞增殖曲线。
1.2.3 绿色荧光蛋白(green fluorescent protein,GFP)转染BMSCs取一部分经诱导的第2代BMSCs,细胞达到80%融合时,弃掉培养液,用PBS清洗后,加入10 mL诱导培养液,每皿细胞中加入病毒液500 μL,轻轻摇动混匀后,于培养箱内(37℃、5% CO2、100%湿度)培养3 d,连续观察转染细胞的情况。
1.2.4 BMSCs与CPC的复合培养后倒置和荧光显微镜、扫描电镜观察采用胰酶消化法收集第2代BMSCs细胞,制备细胞悬液调整细胞密度至每毫升6.0×105个,将细胞悬液均匀地滴加于6孔板中消毒的多孔CPC支架上,材料饱和时,于培养箱内(37℃、5%CO2、100%湿度)培养4 h,使细胞和支架材料充分黏附,然后将DMEM成骨条件培养液2 mL缓慢注入培养皿内,充分浸没材料,分别放入培养箱内(37℃、5%CO2、100%湿度)继续培养,隔天换液,倒置和荧光显微镜下观察。于培养第1、3、5、7天分别取细胞材料复合体,用电镜固定液固定,1%的锇酸固定,于临界点干燥、喷金,黏附于载物台上,进行扫描电镜观察。
1.2.5 多孔CPC与BMSCs复合植入裸鼠皮下所有植入操作均在SPF级动物房的超净台内进行。裸鼠称重,速眠新Ⅱ(40 mg·kg-1)腹部皮下注射麻醉,共计6只裸鼠。于背部脊柱两侧,距中线1.5 cm处,分左上、左下、右上、右下4个区,分别切开皮肤4.0 mm,充分游离周围的皮下组织,分别植入CPC、CPC和BMSCs,于术后8周处死裸鼠,于手术部位取材,10%甲醛溶液固定3 d,20%甲酸溶液脱钙,隔天更换脱钙液,至标本变软,流动水冲洗标本24 h,送至病理科进行常规脱水,石蜡包埋。切片厚度约5 μm,苏木精-伊红染色,显微镜下观察形态。
2 结果
2.1 BMSCs与CPC体外复合的观察
随着接种密度的增高,BMSCs在多孔CPC上的附着数量呈上升趋势。当接种密度为每毫升6.0×105个时,细胞增殖数量达到最高,但随着接种密度的增高,细胞增殖降低,其在支架材料上的附着又逐渐下降。
2.2 BMSCs转染GFP后的观察
转染细胞贴壁生长,细胞形态均一,呈多角形,生长旺盛,24 h后即可见部分细胞发出荧光,48 h发荧光的细胞数及强度达到高峰,转染率超过80%,仍可发出绿色荧光。
2.3 多孔CPC与转染GFP的BMSCs复合培养后的观察
倒置显微镜下观察发现,第1天时可以观察到部分细胞在材料周围生长,细胞的形态与正常细胞形态无差异;第3天时可见实验组材料周缘部分区域有细胞爬出;第5天时可见材料周围细胞数量明显增加,材料边缘的细胞形态与培养皿内培养细胞达汇合时排列紧密的细胞区形态相同,细胞基质分泌旺盛,形成近似膜性的细胞层(图1)。
2.4 多孔CPC与BMSCs复合培养扫描电镜观察
多孔CPC具有多间隙立体空间结构,颗粒表面光滑,空隙大于200 μm,空隙之间相互联通(图2A)。BMSCs接种于多孔CPC上1 d后可见细胞单层附着于材料上,细胞呈扁圆形,四周有小突起;3 d后,细胞开始铺展,部分区域细胞密度较大,部分细胞相互接触;接种5 d后细胞开始呈多角形向外伸展,细胞分泌基质;7 d时,细胞完全贴附,伸出伪足(图2B)。经过观察发现,多孔CPC的结构利于细胞的黏附和增殖。
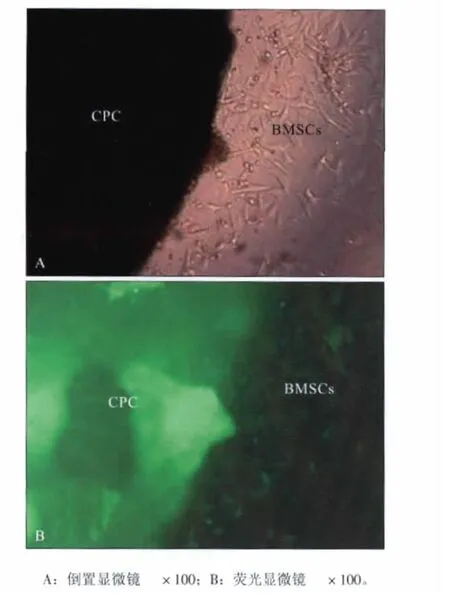
图1 BMSCs与CPC培养第1天的照片Fig 1 The micrograph of CPC with BMSCs at the 1st day

图2 多孔CPC与BMSCs复合培养第7天的形态SEM×100Fig 2 The photographs of porous CPC and CPC with BMSCs at the 7th day SEM×100
2.5 组织学观察
术后所有裸鼠活动正常,未有死亡;植入处表面皮肤完整、光滑,无感染。术后8周单纯CPC标本切片,可见大量纤维组织形成,未见骨组织(图3A);CPC和BMSCs标本切片内部可见大量呈环形的骨组织形成,中央部分材料未降解(图3B)。

图3 CPC复合BMSCs植入裸鼠皮下第12周的组织学观察(箭头示新骨)HE×10Fig 3 Histological observation of the CPC with BMSCs at the 12 th week after implanting into the nude rats HE×10
3 讨论
细胞能否与材料黏附是组织工程化骨的基础,细胞必须与材料发生适当的黏附才能进行迁移、分化和增殖。无论是在体外还是在体内,最先直接与组织细胞接触并发生作用的是材料的表面,因此细胞黏附到材料表面相当重要,且黏附特性的差异也将会影响细胞的增殖、分化等一系列反应[2]。因此,支架材料必须有良好的细胞界面和表面活性,有利于细胞的黏附,并为细胞在其表面生长、增殖、分泌基质提供良好的微环境[3-4]。
本实验中材料与细胞共同培养时,通过倒置显微镜观察Beagle犬的BMSCs细胞在生物材料环境中生长增殖情况。材料上黏附细胞生长达一定数量后,部分细胞会移行于材料边缘至培养板底。倒置显微镜观察到,细胞接种于材料后24 h材料周边有细胞爬出。倒置显微镜下能直观地观察到细胞的生长形态,说明生物材料CPC对其细胞生物学性能无明显影响。
荧光基因标记技术可以将特定的荧光基因导入活细胞,使被标记的细胞在特定条件下发出荧光,从而在体内外被特异、灵敏地识别[5]。由于材料本身不透光,无法直接观察膜性材料上黏附的细胞生长状态,本实验采用重组腺病毒Adv-GFP成功标记了BMSCs,实验显示转染较高,易于观察转染了GFP在材料表面黏附和生长的状况,表明多孔CPC具备很好的生物相容性。
细胞的黏附、渗透和营养物质的传递及代谢产物的交换与材料的化学性质、表面性能和三维结构(孔隙率、孔隙形态、大小、贯通性等)有密切关系,这与支架材料的致孔方法有关[6-8]。多孔生物材料的首要特征是其有孔道特征,制备的关键和难点是形成高孔隙率的连通孔、一定的抗压强度及保持良好的生物活性。
本实验应用新研制成的自固化多孔CPC,具有以下特点:孔径约为300~500 μm,孔隙率约为70%,利用微溶和产气剂相结合制备多孔,当CPC植入体内后,经过体液的不断渗透和清洗,微溶盐逐步被溶解,形成多孔结构。在骨组织不断长入的同时逐步形成多孔,因此,加速材料的降解,促进骨的快速愈合。
实验证实,支架材料的孔径大于200 μm,利于骨细胞的长入,孔隙率约为70%,增加了内表面面积,为细胞生长因子靶细胞的黏附、增殖提供了良好的三维空间环境,多孔型结构增加材料与新生骨接触面积,促进降解。
电镜下观察发现,CPC孔隙呈蜂窝状,均匀且贯通;细胞与材料复合后4 h,细胞铺展、黏附于材料表面,孔隙中有细胞生长,表明材料利于细胞的黏附和生长;同时,材料的孔径大小和贯通性适合细胞生长和迁移,利于细胞营养和代谢物质的输送。
本实验中,从细胞黏附后生长曲线可以看出,其黏附率随接种细胞数量的增多而提高的。但当黏附率到密度为每毫升6.0×105个时,增加细胞黏附浓度时,A值不再增加,反而有所下降。提示每毫升6.0×105个为适宜的BMSCs接种多孔CPC的密度。
异位成骨实验结果说明,单纯的多孔CPC不能成骨,骨替代材料仅作为支架,有骨引导作用,而不具有骨诱导作用。只有在体外经BMSCs在CPC支架培养基础上再植入体内,诱导成骨。本实验同样观察到为未复合BMSCs的多孔CPC不能形成骨组织,多孔CPC本身无骨的诱导作用;只有复合了BMSCs后,才能形成骨组织,同时异位成骨的组织切片说明,多孔CPC利于骨的形成。
总之,多孔CPC具有良好的生物相容性,有利于BMSCs的生长、黏附;孔隙之间相互联通,能为细胞提供良好的摄取营养、黏附和生长空间,利于骨组织的形成,是较理想的骨组织工程支架材料。
[1]闫玉华,周文娟,李世普,等.组织工程基质材料研究进展[J].国外医学生物医学工程分册,2001,24(4):149-153. YAN Yu-hua,ZHOU Wen-juan,LI Shi-pu,et al.Matrix material in tissue engineering research[J].Foreign Medical Biomedical Engineering Fascicle,2001,24(4):149-153.
[2]王磊,潘可风,黄远亮,等.不同浓度的bFGF对犬骨髓基质细胞增殖、分化作用的实验研究[J].口腔颌面外科杂志,2008,18(1):6-10. WANG Lei,PAN Ke-feng,HUANG Yuan-liang,et al.Effects of basic fibroblast growth factor on the proliferation and differentiation of dog bone marrow stromal cells[J].J Oral Maxillofac Surg,2008,18(1):6-10.
[3]Anselme K.Osteoblast adhesion on biomaterials[J].Biomaterials, 2000,21(7):667-681.
[4]Ma PX,Zhang R,Xiao G,et al.Engineering new bone tissue in vitro on highly porous poly(a-hydroxyl acids)phydroaptite composite scaffolds[J].J Biomed Mater Res,2001,54(2):284-293.
[5]Webb K,Hlady V,Tresco PA.Relationships among cell attachment,spreading,cytoskeletal organization,and migration rate for anchoragedependent cells on model surfaces[J].J Biomed Mater Res,2000,49(3):362-368.
[6]Ito Y,Tanaka N,Fujimoto Y,et al.Bone formation using novel interconnected porous calcium hydroxyapatite ceramic hybridized with cultured marrow stromal stem cells derived from green rat [J].J Biomed Mater Res A,2004,69(3):454-461.
[7]Nam YS,Park TG.Porous biodegradable polymeric scaffolds prepared by thermally phase separation[J].J Biomed Mater Res A,1999,47(1):8-17.
[8]Nam YS,Yoon JJ,Park TG.A novel fabrication method of macroporous biodegradable polymer scaffolds using gas foaming salt as a porogen additive[J].J Biomed Mater Res,2000,53(1):1-7.
(本文编辑汤亚玲)
The experimental study on porous calcium phosphate cement with bone marrow stromal cells for bone tis- sue engineering
WANG Lei1,LI Yao-jun2,ZHANG Yan3,PAN Ke-feng3,HUANG Yuan-liang2,LIU Changsheng4,JIANG Xin-quan5.
(1.Dept.of Stomatology,Hongqiao Community Health Center,Shanghai 200051,China; 2.Dept.of Stomatology,East Hospital,Tongji University,Shanghai 200120,China;3.Dept.of Oral and Maxillofacial Surgery,School of Stomatology,Tongji University,Shanghai 200072,China;4.School of Materials Science and Engineering,East China University of Science and Technology,Shanghai 200237,China;5.Laboratory of Bioengineering,The Ninth People′s Hospital,Medical College,Shanghai Jiaotong University,Shanghai 200011, China)
Objective To observe the biocompatibility of new biomaterials porous calcium phosphate(CPC)and ectopic bone formation of CPC with bone marrow stromal cells(BMSCs).M ethods The BMSCs were cultured from Beagle dog and combined with the porous CPC with the best concentration after transfect green fluorescent protein(GFP).The adhesion and growth of BMSCs on CPC were observed under inversion,fluorescence and scanning electron microscopy.The ectopic bone formation were observed at the 8th week after CPC and BMSCs were implanted subcutaneously into nude mice.Results When BMSCs with CPC were cultured at the 1st day,cells were climbing out from CPC with normal morphology.At the 7th day cells can be seen protruding pseudopods,secretion of matrix. Bone formation could be seen histomorphologically at the 8th week.Conclusion Porous CPC has good biocompatibility and is an ideal scaffold material for bone tissue engineering.
porous calcium phosphate;bone tissue engineering;scaffold material;bone marrow stromal cells
R 783.1
A
10.3969/j.issn.1000-1182.2010.03.022
1000-1182(2010)03-0315-04
2009-12-16;
2010-02-21
上海市科研计划基金资助项目(09411954800)
王磊(1966—),女,山东人,主任医师,博士
黄远亮,Tel:021-38804518-1156

