牙龈卟啉单胞菌菌毛蛋白Fim A基因在大肠杆菌中的融合表达和纯化
李昂 谢红帼 梁平 朱春晖 石建峰 饶国洲 苟建重
(1.西安交通大学附属口腔医院口腔医学研究中心;2.牙周科,陕西西安710004)
牙龈卟啉单胞菌菌毛蛋白Fim A基因在大肠杆菌中的融合表达和纯化
李昂1谢红帼2梁平2朱春晖2石建峰1饶国洲1苟建重2
(1.西安交通大学附属口腔医院口腔医学研究中心;2.牙周科,陕西西安710004)
目的克隆牙龈卟啉单胞菌菌毛蛋白FimA基因,构建原核表达载体,诱导其在大肠杆菌中融合表达,并鉴定、纯化其表达产物。方法克隆牙龈卟啉单胞菌菌毛蛋白FimA基因,构建表达载体pET15b-FimA,转化大肠杆菌BL21(DE3)pLyS感受态细胞;异丙基-β-D-硫代半乳糖苷(IPTG)诱导表达融合蛋白,以抗6×His Tag单克隆抗体为一抗,Western blot鉴定、Co2+柱亲和层析纯化融合蛋白。结果克隆的FimA基因序列及插入表达载体中的FimA序列均与GenBank数据库中的序列呈现100%同源性;IPTG诱导后Western blot鉴定4.1×104处有目的蛋白表达;Co2+柱亲和层析法获得纯化的高浓度FimA蛋白。结论本实验成功构建了牙龈卟啉单胞菌菌毛蛋白FimA基因的原核表达载体pET15b-FimA,并在大肠杆菌中获得成功表达和纯化,为进一步制备牙龈卟啉单胞菌菌毛蛋白单克隆抗体和研制开发预防牙周炎的亚单位蛋白疫苗奠定了实验基础。
牙龈卟啉单胞菌;菌毛蛋白A;融合表达
牙龈卟啉单胞菌(Porphyromonas gingivalis,P.gingivalis)是目前公认的一种牙周致病菌,其表面含有大量毒性因子,如蛋白酶、菌毛、脂多糖、血凝素等[1]。其中菌毛可介导P.gingivalis在口腔的定植黏附,诱导内皮细胞表达多种黏附分子、炎性细胞因子,促进破骨细胞的分化和成熟,导致牙槽骨的吸收,是P.gingivalis造成牙周组织侵袭性破坏的基础[2-4]。研究表明[5-6],P.gingivalis菌毛蛋白具有良好的免疫原性,在体内能诱发保护性免疫反应,抑制多种炎症相关因子的产生,抵制P.gingivalis的黏附定植和进一步地侵袭破坏能力,阻断P.gingivalis感染后牙周组织受到破坏,是一种有潜力的牙周炎疫苗候选免疫原[7]。据此,本实验旨在通过基因克隆与重组技术构建P.gingivalis菌毛蛋白FimA基因的原核表达载体,并诱导其在大肠杆菌中表达,通过纯化以获得高浓度的FimA融合蛋白,为进一步制备P. gingivalis菌毛蛋白单克隆抗体和开发研制预防牙周炎的蛋白亚单位疫苗奠定基础。
1 材料和方法
1.1 材料
P.gingivalis ATCC 381(首都医科大学附属北京口腔医院口腔医学研究所);大肠杆菌JM109和BL21(DE3)pLyS、细菌基因组DNA抽提试剂盒、离心柱型质粒小提试剂盒、琼脂糖凝胶DNA回收试剂盒(北京天根生化科技有限公司);pMD18-T vector System、pET-15b vector、Ex TaqTM DNA Polymerase、PCR试剂盒、T4 DNA Ligase、各种限制性核酸内切酶、DNA Marker、X-gal、异丙基-β-D-硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)(大连宝生物工程大连有限公司);TALON纯化试剂盒(Clontech公司,美国);硝酸纤维素膜、Anti-his antibody、Goat anti-Mouse IgG(H+L)、ECL底物发光试剂盒(Pierce公司,美国)。实验引物合成、DNA序列测定(上海生工生物工程技术公司)。
1.2 方法
1.2.1 牙龈卟啉单胞菌基因组DNA的提取接种P. gingivalis ATCC 381于改良GAM血液琼脂培养基(加入1 mg·L-1维生素K和50 g·kg-1脱纤维蛋白羊血),37℃厌养环境下培养4 d,刮取板面上的所有菌落,离心收集菌体,采用细菌基因组DNA抽提试剂盒,提取P.gingivalis基因组DNA。琼脂糖凝胶电泳及紫外分光光度仪检测含量和纯度。
1.2.2 目的基因扩增及克隆载体构建根据P.gingivalis ATCC 381 FimA基因序列(ID17794),采用电脑软件Premier 5.0设计引物。上游引物:5′-CCTCATATGGTGGTATTGAAGACCAGCA-3′,加入NdeⅠ酶切位点、启动密码子ATG,下游引物:5′-TTA CCAAGTAGCATTCTGACCAACGA-3′,含终止密码子TAA。以P.gingivalis基因组DNA为模板,进行PCR扩增。反应条件为:94℃预变性5 min,进入热循环(94℃变性30 s,55℃复性1 min,72℃延伸2 min),共30个循环,72℃20 min。琼脂糖凝胶电泳鉴定。琼脂糖凝胶DNA回收试剂盒回收PCR产物中的目的片段。用T4 DNA连接酶将目的片段亚克隆入pMD18-T,连接产物转化大肠杆菌E.coli JM109感受态细胞,采用氨苄西林琼脂平板进行蓝白筛选,挑取白色克隆扩增培养,提取质粒。根据Vector NTI 9.0软件分析结果选用HindⅢ和Bam HⅠ对重组质粒进行双酶切鉴定和测序分析,正确的重组质粒命名为pMD18T-FimA。
1.2.3 FimA原核表达载体pET15b-FimA的构建及鉴定将测序正确的重组质粒pMD18T-FimA和原核表达质粒pET-15 b分别以NdeⅠ和Bam HⅠ双酶切,用低熔点琼脂糖凝胶分别回收酶切产物中的FimA和pET-15b大片段,T4 DNA连接酶连接。连接产物转化E.coli JM109感受态细胞,挑选氨苄西林阳性克隆扩菌,提取质粒进行双酶切鉴定,正确的重组质粒命名为pET15b-FimA。
1.2.4 FimA在大肠杆菌BL21(DE3)pLyS中的表达提取pET15b-FimA质粒转化大肠杆菌BL21(DE3)pLyS感受态细胞,挑取一单克隆菌落,接种入1 mL Amp+(50 μg·mL-1)的LB液体培养基中,37℃,250 r·min-1振摇6 h。取菌液50 μL加LB 1 mL共6管,37℃剧烈振荡培养2 h。待菌液浓度达A550nm0.6~0.8时,分别加入IPTG,诱导的IPTG终浓度分别为1、2 mmol·L-1,诱导时间为1、2和3 h,同时以转化有空载体pET-15b的BL21为阴性对照。分别离心收集细菌沉淀,每管加入400 μL蛋白上样缓冲液,重悬后煮沸10 min,10 000 g离心10 min,取上清液备用。
SDS-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析:配制12%分离胶和5%浓缩胶,取上述样品,每孔30 μL,浓缩胶电压90 V,分离胶电压120 V,电泳结束后,将凝胶浸泡于考马斯亮蓝染色液中染色3 h。脱色液脱色至蛋白条带清晰,背景无色透明,观察结果。
1.2.5 Co2+柱亲和层析FimA蛋白的纯化挑取转化了质粒pET15b-FimA的BL21阳性克隆,扩增至500mL LB(Amp+)培养液中,37℃振摇4 h;加入IPTG致终浓度为2 mmol·L-1,37℃振摇3 h;收集细菌沉淀。于冰上用pH 7.0的Buffer A重悬细胞沉淀物,轻摇至半透明;4℃,10 000~12 000 g离心20 min除杂质;将上清液加入经Buffer A处理的Co2+柱亲和层析的TALON树脂中,反复冲洗柱子;加入5倍柱床体积的Buffer B洗脱,每份500 μL收集洗脱液。将洗脱液以Buffer C稀释后,置于透析袋中,在4℃搅拌条件下,梯度透析,将透析好的蛋白质用SDS-PAGE分析目的蛋白。
1.2.6 Western blot鉴定纯化的FimA蛋白将纯化的FimA融合蛋白进行12%的SDS-PAGE,切取所需条带,300 mA、65 min转印至硝酸纤维素膜。10%脱脂奶粉摇床上封闭4 h,TBST洗膜3次;加入1∶2 000稀释的抗His标签抗体为一抗,4℃过夜。洗膜后加入1∶2 000稀释的HRP标记的山羊抗鼠IgG二抗,37℃孵育1 h。ECL底物发光显色试剂盒显色,X线曝光分析结果。
2 结果
2.1 PCR扩增FimA基因
提取的P.gingivalis ATCC 381基因组DNA纯度较高,A260nm/A280nm=1.78,说明基本没有RNA及蛋白污染。DNA质量浓度为65 μg·mL-1。以获得的DNA为模板,PCR扩增目的片段,电泳显示于1 000 bp处有一特异性条带,与预期大小(1 053 bp)大小一致(图1)。
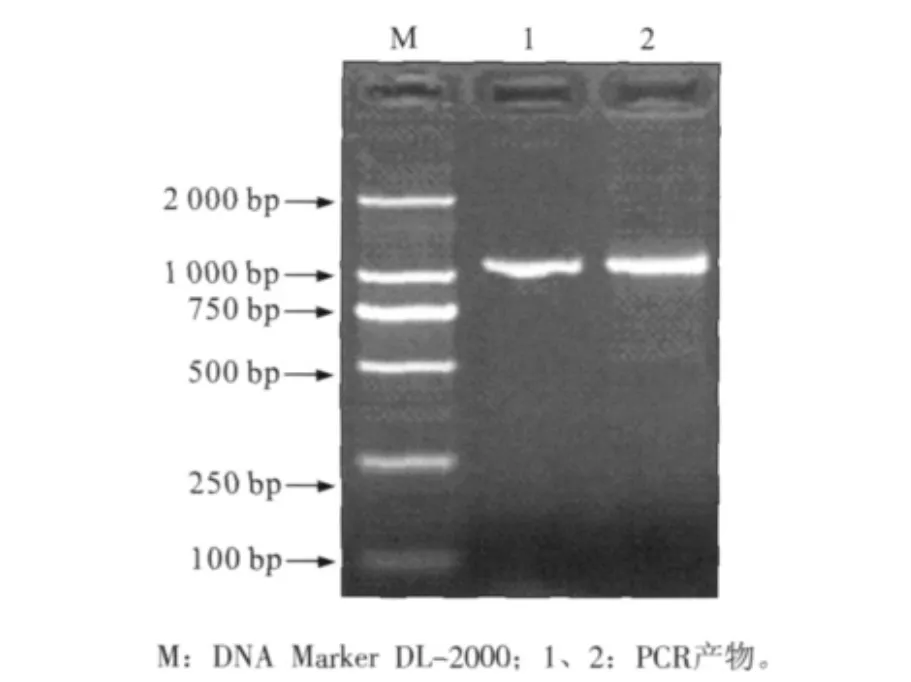
图1 FimA PCR产物电泳图Fig 1 The electrophoresis map of PCR products
2.2 重组克隆质粒pMD18T-FimA的鉴定
依据Vector NTI 9.0软件对pMD18T-FimA进行酶切位点分析的结果,选用HindⅢ/Bam HⅠ对重组质粒pMD18T-FimA进行双酶切鉴定,琼脂糖凝胶电泳结果显示,在2 000~3 500 bp之间和1 000 bp处各有一单一条带,与预期大小(2 656 bp和1 089 bp)一致(图2)。测序结果通过BLAST同源性分析同Gen Bank收录的P.gingivalis ATCC 381 FimA基因(ID17794)的编码区(206~1 290 bp)核苷酸序列完全一致,符合率100%。
2.3 原核表达载体pET15b-FimA的构建与鉴定
按照Vector NTI 9.0软件对pET15b-FimA的酶切位点分析结果,选用NdeⅠ和HindⅢ对该重组质粒进行双酶切,电泳结果显示有与预期大小一致的酶切片段。表明成功构建原核表达载体pET15b-FimA(图3)。

图2 pMD18T-FimA质粒HindⅢ/Bam HⅠ双酶切结果Fig 2 The electrophoresis map of plamid pMD18T-FimA digested with HindⅢ/Bam HⅠ

图3 pET15b-FimA质粒NdeⅠ/HindⅢ双酶切结果Fig 3 The electrophoresis map of plasmid pET15b-FimA digested with NdeⅠ/HindⅢ
2.4 pET15b-FimA在大肠杆菌BL21(DE3)pLyS中的表达分析
重组原核表达质粒pET15b-FimA转化大肠杆菌BL21(DE3)pLyS,经IPTG诱导表达后,在4.1×104处显示明显融合蛋白条带,大小与预期大小基本一致,而空质粒pET-15b在该处无特异条带(图4)。IPTG浓度及诱导时间对融合蛋白表达量影响较大。表明牙龈卟啉单胞菌菌毛蛋白FimA编码基因在大肠杆菌BL21(DE3)pLyS中获得成功表达。
2.5 Western blot鉴定纯化的FimA蛋白
FimA融合蛋白经过包涵体裂解、Co2+柱亲和层析、去除尿素等变性剂,洗脱液中得到被纯化的6× His-FimA融和蛋白。以鼠抗6×His Tag单克隆抗体为一抗,以β-actin(4.3×104)为参照进行Western blot检测,其结果显示了纯化的蛋白为His-FimA融合蛋白,并且表达量和纯度较未纯化样品有明显增加(图5)。
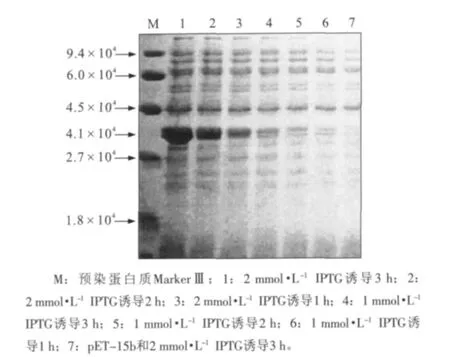
图4 FimA的IPTG诱导表达分析Fig 4 Protein expression analysis induced by IPTG
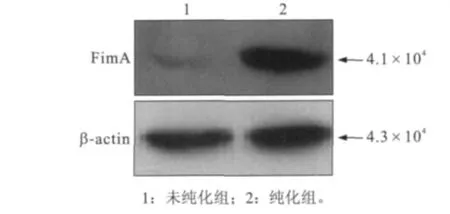
图5 纯化的FimA蛋白Western blot图谱Fig 5 The map of FimA protein was purified by Co2+-NTA
3 讨论
研制开发针对P.gingivalis菌毛抗原的牙周炎疫苗一直是牙周病辅助治疗的方向之一。2007年,姜广水等[8]构建了FimA蛋白和白细胞介素-15共表达质粒pIRES-FimA/IL15,经滴鼻免疫和肌肉注射免疫BABL/cdx鼠,证实FimA基因滴鼻免疫可以作为抗牙龈卟啉单胞菌DNA疫苗有效的黏膜免疫途径,能诱导循环和口腔局部抗体反应。目前,比较有应用前景的P.gingivalis疫苗策略主要采用纯化蛋白加佐剂的免疫形式,如Koizumi等[9]发现4.0×104外膜蛋白加霍乱毒素经鼻腔免疫,能够引起实验鼠的长效免疫反应和免疫保护性。
本研究的目的就是获取FimA的重组蛋白作为亚单位蛋白疫苗,而融合标签技术是目前获得重组蛋白的一种有效方法。其通过DNA重组在靶蛋白编码基因的3′端或5′端融合某种标签的编码基因,通过适宜的宿主来表达重组蛋白质[10]。其中多聚组氨酸,即His标签[11],其相对分子质量小,对融合蛋白质结构影响小,不需要从融合蛋白质中切除,且可通过其对金属离子如镍、钴具有高度的选择性和亲和力[12],利用抗His标签的单克隆抗体从复杂的提取物中对融合蛋白进行选择性结合、洗脱和纯化。所提取的蛋白和从菌体中直接获得的蛋白一样,可以用于动物免疫。2007年,日本学者Takahashi等[13]用P.gingivalis ATCC 33277全菌表面提纯的菌毛加重组的霍乱毒素经鼻免疫BALB/c小鼠,证实能够对P. gingivalis诱导的牙周炎发挥明显的免疫保护作用。2009年,Kim等[14]构建的CTB-FimA1(氨基酸残基1~200)和CTB-FimA2(氨基酸残基201~337)重组亚单位蛋白疫苗也在动物体内获得较好的免疫保护效果。
菌毛蛋白由相对分子质量为4.1×104的菌毛单体聚合形成,其编码基因为单拷贝基因FimA,全长1 290 bp,编码347个氨基酸。翻译后产物菌毛蛋白的功能域位于氨基酸序列的31~331aa不等,各个位点之间可相互交叉或覆盖[15]。根据FimA基因开放阅读框架核苷酸序列的差异可将P.gingivalis分为6型(Ⅰ~Ⅴ型和Ⅰb亚型),在P.gingivalis阳性的健康人中,以Ⅰ型FimA P.gingivalis为主(76.1%),在牙周炎病人中,以Ⅱ型FimA P.gingivalis为主(66.1%),而且Ⅱ型FimA P.gingivalis与重型牙周炎明显相关[16]。但不同基因型的FimA编码区均存在有不同长度的同源序列,其编码蛋白在结构和功能上也存在较大同源性,相互之间可以发生较强的交叉免疫[17]。本实验选择从P.gingivalis ATCC 381 DNA中扩增出完整的FimA基因编码区、构建其原核表达载体并获得融合蛋白的成功表达,为临床降低健康人群P.gingivalis感染率、干扰其他基因型P.gingivalis感染做出探索性研究。
本实验所用的原核表达载体pET-15b载体属于pET载体系列,与刘薇等[18]表达FimA重组蛋白使用的pBAD载体有所不同。该表达载体在E.coli BL21(DE3)pLyS宿主菌中能高水平表达外源蛋白质、且这种表达的外源蛋白质因带有钙调素结合多肽和凝血酶切点,故该蛋白产物易于纯化和产业化。本课题选用Clontech的TALON钴离子树脂进行亲和层析柱,对FimA重组蛋白进行纯化,用抗His标签的单抗对纯化的蛋白进行鉴定,结果证实,获得了浓缩纯化度很高的FimA重组蛋白。这为后续实验制备多克隆抗体,进一步探索P.gingivalis菌毛结构与功能的关系,研发牙周炎蛋白亚单位疫苗奠定了坚实的实验基础。
[1]Yoshimura F,Murakami Y,Nishikawa K,et al.Surface components of Porphyromonas gingivalis[J].J Periodont Res,2009, 44(1):1-12.
[2]Loos BG,Dyer DW.Restriction fragment length polymorphism analysis of the fimbrillin locus,FimA,of Porphyromonas gingivalis[J].J Dent Res,1992,71(5):1173-1181.
[3]Weinberg A,Belton CM,Park Y,et al.Role of fimbriae in Porphyromonas gingivalis invasion of gingival epithelial cells[J]. Infect Immun,1997,65(1):313-316.
[4]郭永华,吴亚菲,刘天佳,等.不同FimA基因型牙龈卟啉单胞菌刺激口腔上皮细胞白细胞介素-8的表达[J].华西口腔医学杂志, 2008,26(6):652-655. GUO Yong-hua,WU Ya-fei,LIU Tian-jia,et al.Different FimA genotype bacteria Porphyromonas gingivalis oral epithelial cells to stimulate the expression of interleukin-8[J].West China J Stomatol,2008,26(6):652-655.
[5]陈莉丽,吴梦婕,严杰.牙龈卟啉单胞菌临床菌株FimA基因变异性和表达频率及其重组表达产物的致炎作用[J].中华微生物学和免疫学杂志,2005,25(10):850-853. CHEN Li-li,WU Meng-jie,YAN Jie.Porphyromonas gingivalis clinical strains of bacteria FimA gene mutation and expression frequency and its recombinant product induced inflammation[J]. Chin J Microbiol Immunol,2005,25(10):850-853.
[6]Nassar H,Chou HH,Khlgatian M,et al.Role for fimbriae and lysine-specific cysteine proteinase gingipain K in expression of interleukin-8 and monocyte chemoattractant protein in Porphyromonas gingivalis—infected endothelial cells[J].Infect Immun, 2002,70(1):268-276.
[7]Fan Q,Sims T,Sojar H,et al.Fimbriae of Porphyromonas gingivalis induce opsonic antibodies that significantly enhance phagocytosis and killing by human polymorphonuclear leukocytes [J].Oral Microbiol Immunol,2001,16(3):144-152.
[8]姜广水,郭红梅,王喜军,等.牙龈卟啉单胞菌FimA蛋白和白细胞介素-15共表达质粒免疫小鼠的实验研究[J].华西口腔医学杂志,2007,25(2):177-179. JIANG Guang-shui,GUO Hong-mei,WANG Xi-jun,et al. Nasal immunization with co-expression plasmid harboring genes encoding Porphyromonas gingivalis FimA and human interleukin-15 in mice[J].West China J Stomatol,2007,25(2):177-179.
[9]Koizumi Y,Kurita-Ochiai T,Oguchi S,et al.Nasal immunization with Porphyromonas gingivalis outer membrane protein decreases P.gingivalis-induced atherosclerosis and inflammation in spontaneously hyperlipidemic mice[J].Infect Immun,2008,76(6):2777-2784.
[10]Chao H,Bautista DL,Litowski J,et al.Use of a heterodimeric coiled-coil system for biosensor application and affinity purification[J].J Chromatogr B,1998,715(1):307-329.
[11]Butt TR,Edavettal SC,Hall JP,et al.SUMO fusion technology for difficult-to-express proteins[J].Protein Expr Purif,2005,43(1):1-9.
[12]Arnau J,Lauritzen C,Petersen GE,et al.Current strategies for the use of affinity tags and tag removal for the purification of recombinant proteins[J].Protein Expr Purif,2006,48(1):1-13.
[13]Takahashi Y,Kumada H,Hamada N,et al.Induction of immune responses and prevention of alveolar bone loss by intranasal administration of mice with Porphyromonas gingivalis fimbriae and recombinant cholera toxin B subunit[J].Oral Microbiol Immunol,2007,22(6):374-380.
[14]Kim TG,Huy NX,Kim MY,et al.Immunogenicity of a cholera toxin B subunit Porphyromonas gingivalis fimbrial antigen fusion protein expressed in E.coli[J].Mol Biotechnol,2009,41(2):157-164.
[15]Fujiwara T,Morishima S,Takahashi I,et al.Molecular cloning and sequencing of the fimbrilin gene of Porphyromonas gingivalis strains and characterization of recombinant proteins[J].Biochem Biophys Res Commun,1993,197(1):241-247.
[16]Amano A,Nakagawa I,Okahashi N,et al.Variations of Porphyromonas gingivalis fimbriae in relation to microbial pathogenesis[J].J Periodontal Res,2004,39(2):136-142.
[17]赵蕾,吴亚菲,杨禾,等,成人牙周健康状况与fimA基因型牙龈卟啉单胞菌的相关性[J].华西口腔医学杂志,2007,25(3):237-241. ZHAO Lei,WU Ya-fei,YANG He,et al.The association between adult periodontal health status and fimA genotypes of Porphyromonas gingivalis strains[J].West China J Stomatol,2007, 25(3):237-241.
[18]刘薇,于飞,陈卫民.牙龈卟啉单胞菌菌毛FimA基因在大肠杆菌的融合表达[J].临床口腔医学杂志,2009,25(2):76-78. LIU Wei,YU Fei,CHEN Wei-min.Porphyromonas gingivalis fimbriae FimA gene is fusion expressed in E.coli[J].J Clin Stomatol,2009,25(2):76-78.
(本文编辑汤亚玲)
《中国口腔医学年鉴》2008年卷出版发行
由四川大学华西口腔医学院周学东教授主编,全国50余所口腔医学院校、口腔医院组成的编辑委员会编纂的《中国口腔医学年鉴》2008年卷已于2009年9月正式出版发行。本卷设回顾、论坛、博士后出站报告摘要、优秀博士学位论文摘要、文选·述评、教育、人物、口腔医学组织机构、记事、文献法规、特载和索引12个栏目,全面、客观、准确地记录了2008年度中国口腔医学在临床、教学和科研等方面的发展状况和最新研究动态及学术水平,反映了口腔医学领域重大事件与学术交流简况等。本书57万字,16开,精装,定价73.00元(邮购需另加邮挂费7.00元)。需购书者请汇款至成都市人民南路三段14号(邮政编码610041)《中国口腔医学年鉴》编辑部,联系电话:028-85503479,028-85502414;E-mail:zgkqyxnj@vip.163.com。
《中国口腔医学年鉴》编辑部
Construction of prokaryotic expression vector of FimA gene from Porphyromonas gingivalis,fusion expres-sion and purification in E.coli BL21(DE3)pLyS
LI Ang1,XIE Hong-guo2,LIANG Ping2,ZHU Chun-hui2,SHI Jian-feng1,RAO Guo-zhou1,GOU Jian-zhong2.
(1.Research Center for Stomatology,College of Stomatology,Xi′an Jiaotong University,Xi′an 710004,China;2.Dept.of Periodontology,College of Stomatology,Xi′an Jiaotong University,Xi′an 710004,China)
Objective To clone the FimA gene of fimbriae from Porphyromonas gingivalis(P.gingivalis)and to construct prokaryotic expression vector which was induced in E.coli BL21(DE3)pLyS in the form of fusion protein expression and to identify,purify the product of its expression.M ethods To clone the FimA gene of fimbriae from P.gingivalis and to construct prokaryotic expression vector pET15b-FimA vector which was transformed into the competent cells of BL21(DE3)pLyS.The expression of fusion protein was induced by isopropyl β-D-1-thiogalactopyranoside(IPTG).With anti-6×His Tag monoclonal antibody as the first antibody,the expressed fusion protein was characterized by Western blot and purified by Co2+-NTA affinity chromatography.Results Cloned FimA gene sequences and inserted into expression vector of the FimA sequences were related to the sequence in GenBank database showed 100%homology.IPTG induced and then identified by Western blot showed a fragment of 4.1×104has been expressed.Co2+-NTA affinity chromatography column was used to obtain high concentrations of FimA purified protein. Conclusion The recombinant prokaryotic expression vector of pET15b-FimA was constructed and was expressed and purified successfully in E.coli BL21(DE3)pLyS.This study laid the experimental foundation to further prepare for monoclonal antibodies of fimbriae of P.gingivalis and to develop the subunit protein vaccine of prevention of periodontitis.
Porphyromonas gingivalis;FimA;fusion expression
R 786
A
10.3969/j.issn.1000-1182.2010.03.004
1000-1182(2010)03-0241-05
2009-11-10;
2010-02-12
国家自然科学基金资助项目(30500560);陕西省自然科学基础研究计划资助项目(2006C242);西安市科技攻关计划资助项目(GG05159)
李昂(1970—),男,北京人,副研究员,博士
苟建重,Tel:029-87287539

