何首乌多糖降血脂作用的研究
翟 蓉 吕丽爽 金邦荃
(南京师范大学金陵女子学院食品科学系,江苏 南京 210097)
何首乌多糖降血脂作用的研究
翟 蓉 吕丽爽 金邦荃
(南京师范大学金陵女子学院食品科学系,江苏 南京 210097)
采用水提何首乌多糖和碱提何首乌多糖对高脂模型小鼠进行试验,研究何首乌多糖对高脂模型小鼠总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)和脂蛋白脂酶(LPL)、肝脂酶(HL)以及总脂酶(LA)的影响。结果表明,何首乌多糖剂量组小鼠的TC、TG和AI均不同程度低于高脂模型组(P<0.05),而 HDL-C、LPL、HL和LA显著高于高脂模型组(P<0.05),表明何首乌多糖确具有显著的降血脂作用。
何首乌多糖;降血脂;作用
全球每年约有1 200万人死于心脑血管疾病和脑中风,高脂血症引起动脉粥样硬化是造成冠心病、高血压和血管疾病的主要原因。中国人群血脂异常比例较高,中国18岁及以上成人血脂异常总患病率达18.6%,即血脂异常患者己达1.6亿;而且血脂异常的发病率正趋向年轻化,中年人与老年人患病率相近[1-2]。这主要是由于中国人的饮食习惯造成的,如高脂饮食、高糖饮食及酗酒等,已经严重威胁了中国人民的健康。因此研究和开发有效抑制高脂血症的药物和保健食品是目前医学领域所面临的一项重要课题。
何首乌是中国的传统中药。《本草纲目》记载:此物性温味苦涩,苦补肾,温补肝,涩能收敛精气[3]。目前已有近百种植物多糖被分离应用,多糖作为一种新型的,无毒副作用的天然活性成分已成为医药界研究开发的热点[4]。近年来文献[5-7]报道了何首乌粗多糖在抗氧化、增强免疫力、抗老年痴呆等方面的生物活性。而何首乌多糖降血脂的作用,尚未有报道。本试验通过饲喂高脂饮食建立小鼠高血脂症模型,观察了何首乌多糖对高脂血症的调节作用,为何首乌多糖进一步应用提供参考依据。
1 材料和方法
1.1 材料与主要试剂
1.1.1 材料
灌服液的配置:水提何首乌多糖(W-PMP),纯度为85.2%,白色粉末;纯度为69.7%,浅棕色粉末,均为本实验室自制。使用时分别将其溶于蒸馏水中,按50mg/(kg·d)和200mg/(kg·d)体重比例配制成溶液。
1.1.2 试验动物
ICR健康清洁级雄性小鼠:4周龄,体重为18~22g,共60只,南京医科大学实验动物中心。
1.1.3 主要试剂
血清总胆固醇(TC)测定试剂盒、血清甘油三酯(TG)测定试剂盒、高密度脂蛋白(HDL-C)测定试剂盒:温州东欧津玛声望科技有限公司;
总脂酶测定试剂盒:南京建成生物工程研究所;
胆固醇:中国惠兴生化试剂有限公司;
牛胆盐:北京奥博星生物技术有限责任公司;
猪油、蛋黄:市售。
1.2 试验仪器
电子天平:YP2001N,上海精密科学仪器有限公司;
紫外可见分光光度计:Spectrumlab 54,上海棱光技术有限公司;
台式高速离心机:EBA 21,德国赫提驰(Hettich)公司;数显恒温水浴锅:HH-6,金坛市富华仪器有限公司。
1.3 试验方法
1.3.1 日粮组成 基础饲料由南京医科大学实验动物中心提供,符合国家动物饲养标准,其主要营养成分见表1。高脂饲料由实验室自行配置,配方见表2。

表1 基础饲料的主要营养成分Table 1 Composition of the basal diet

表2 试验饲料配方Table 2 Composition of the experimental diet
1.3.2 试验小鼠分组 将试验小鼠用普通饲料预饲养1周后,称量小鼠体重,按体重随机分为6组(空白对照组、高脂模型组、W-PMP低、高剂量组和A-PMP低、高剂量组),每组10只。试验期间,对照组饲喂基础饲料,自由饮水,其余5组均饲喂高脂饲料,剂量组同时灌胃何首乌多糖溶液。每天记录进食量,每周称重1次,连续28d后禁食16h,断尾取血,离心(3 000r/min,10min)分离血清,待测。
1.3.3 血清和肝脏样品制备
(1)血清样品:小鼠剪尾取血,收集血液于3 000r/min下离心10min分离血清,于-20℃保存待测。
(2)肝脏样品:宰杀后取出肝脏,生理盐水清洗并用保鲜袋包裹,于-80℃冰箱保存待测。
1.4 试验参数
1.4.1 血清中TG、TC和 HDL-C含量的测定 按试剂盒说明书方法测定。
1.4.2 肝脏中LPL、HL、LA含量的测定 称取肝脏1g,按1∶9(m∶V)加入生理盐水冰浴匀浆后,于2 500r/min离心10min,取上清液(即10%匀浆)按试剂盒方法测定。
1.4.3 动脉硬化指数按式(1)[8]计算,内脏体重比按式(2)~(4)计算:

1.4.4 试验数据处理 采用SPSS13.0软件进行数据处理和统计分析,结果以均数±标准差表示。
2 结果与分析
2.1 多糖对高脂饮食小鼠体重的影响
由表3可知,随着试验时间的延长,各组小鼠正常生长,体重均有所增加。高脂模型组的小鼠体重较空白对照组有显著性差异,平均增长了52.2%,表明试验造模成功。通过方差分析表明:对照高脂模型组,各何首乌多糖剂量组体重均有所下降,W-PMP低剂量组和 W-PMP高剂量组量效关系存在显著性差异,其中W-PMP高剂量组小鼠的体重基本达到正常水平,量效关系变化不显著;A-PMP低剂量组和A-PMP高剂量组量效关系存在显著性差异,其中A-PMP高剂量组与W-PMP剂量组相比无显著差异性。
表3 何首乌多糖对高脂饮食小鼠体重的影响†Table 3 Effects of PMP on body weight of mice with hyperlipemia(,n=10)
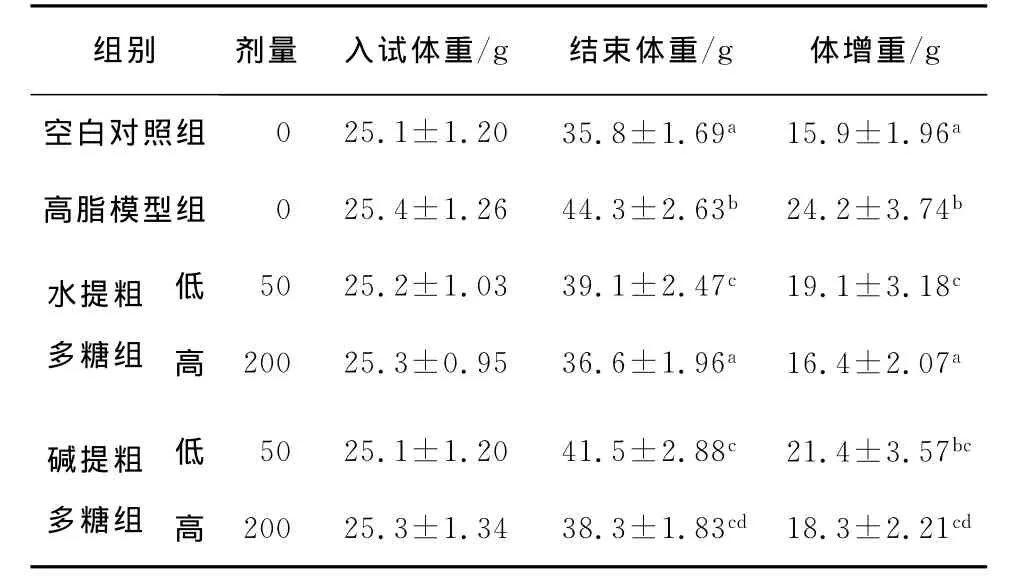
表3 何首乌多糖对高脂饮食小鼠体重的影响†Table 3 Effects of PMP on body weight of mice with hyperlipemia(,n=10)
† 同一列标有不同字母的表示差异显著(P<0.05)。
组别 剂量 入试体重/g 结束体重/g 体增重/g空白对照组高脂模型组0 25.1±1.20 35.8±1.69a15.9±1.96 a水提粗多糖组0 25.4±1.26 44.3±2.63b 24.2±3.74b 50 25.2±1.03 39.1±2.47c 19.1±3.18c 200 25.3±0.95 36.6±1.96a16.4±2.07a碱提粗多糖组低高低高50 25.1±1.20 41.5±2.88c 21.4±3.57bc 200 25.3±1.34 38.3±1.83cd 18.3±2.21 cd
2.2 多糖对高脂饮食小鼠摄食量的影响
通过控制小鼠饮食,观察每天饲料的剩余量,计算每只小鼠的日摄食量。由图1可知,与空白对照组相比,高脂饮食组的小鼠摄食量均有下降,其中高脂模型组有显著下降;水提低、高剂量组无显著变化;碱提低剂量组有明显降低,碱提高剂量组无显著变化。
2.3 多糖对高脂饮食小鼠脂代谢的影响
由表4可知,高脂模型组的TC、TG与空白对照组相比,均有显著性升高,HDL-C显著降低,说明经过连续4周的高脂饲料的饲喂可使小鼠的血脂水平明显升高,高脂饮食小鼠模型建立成功。
与高脂模型组相比,各何首乌多糖剂量组的TC、TG和AI含量均有不同程度的下降,HDL-C有一定程度的升高。

图1 何首乌多糖对高脂饮食小鼠摄食量的影响Figure 1 Effects of PMP on RDA of mice with hyperlipemia
W-PMP剂量组与高脂模型组相比,TC含量显著性降低,其中 W-PMP高剂量组TC含量接近于正常水平;APMP剂量组与高脂模型组相比,TC含量显著性降低;其中A-PMP高剂量组与W-PMP低、高剂量组相比,显著性差异不明显。W-PMP剂量组与高脂模型组相比,TG含量显著性降低,且两组均接近于正常水平,量效关系差异不显著APMP剂量组与高脂模型相比,高剂量组的TG含量显著性降低;且A-PMP高剂量组与 W-PMP低、高剂量组相比,显著性差异不明显。W-PMP剂量组与高脂模型相比,HDL-C含量显著性升高,但W-PMP低、高剂量组之间差别不显著,表明量效关系差异不明显;A-PMP剂量组与高脂模型相比,高剂量组的HDL-C含量显著性升高;且A-PMP低、高剂量组之间差别显著,表明量效关系显著;A-PMP高剂量组与 WPMP高剂量组相比,差异性不显著。W-PMP剂量组与高脂模型组相比,AI指数显著性降低,其中 W-PMP低剂量组的AI接近于正常水平;A-PMP剂量组与高脂模型组相比,AI指数显著性降低,其中A-PMP低、高剂量组与W-PMP高剂量组相比,有显著性差异。
表4 何首乌多糖对高脂饮食小鼠TC、TG、HDL-C、AI的影响†Table 4 Effects of PMP on serum TC 、 TG、HDL-C、AI of mice with hyperlipemia(,n=10)
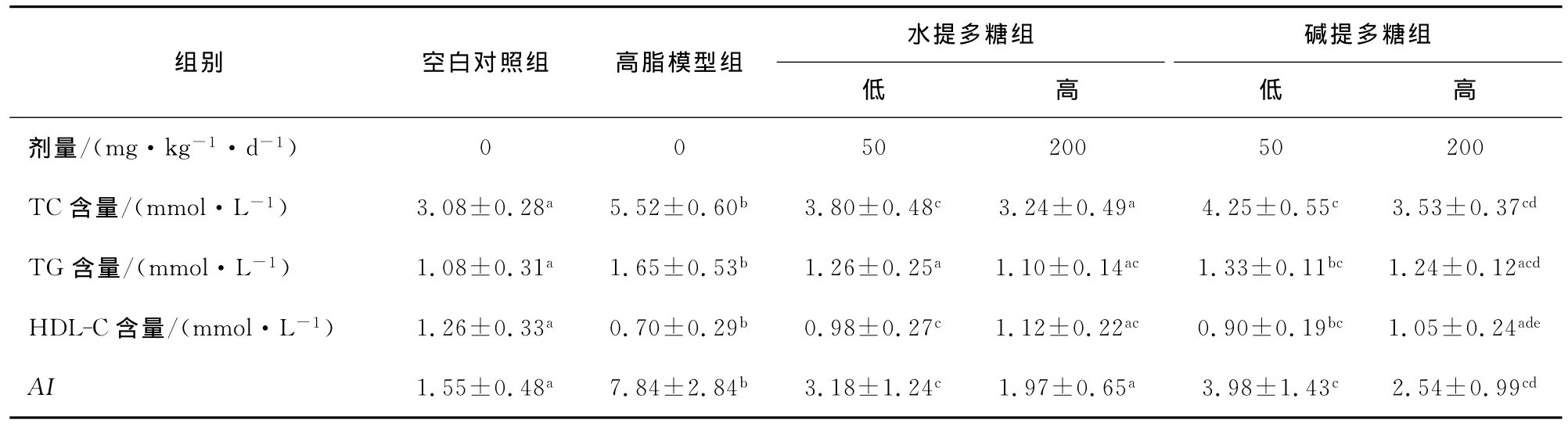
表4 何首乌多糖对高脂饮食小鼠TC、TG、HDL-C、AI的影响†Table 4 Effects of PMP on serum TC 、 TG、HDL-C、AI of mice with hyperlipemia(,n=10)
† 同一列标有不同字母的表示差异显著(P<0.05)。
水提多糖组 碱提多糖组组别 空白对照组 高脂模型组低高低高0 0 50 200 50 200 TC含量/(mmol·L-1) 3.08±0.28a 5.52±0.60b 3.80±0.48c 3.24±0.49a 4.25±0.55c 3.53±0.37cd TG含量/(mmol·L-1) 1.08±0.31a 1.65±0.53b 1.26±0.25a 1.10±0.14ac 1.33±0.11bc 1.24±0.12acd HDL-C含量/(mmol·L-1) 1.26±0.33a 0.70±0.29b 0.98±0.27c 1.12±0.22ac 0.90±0.19bc 1.05±0.24ade AI 1.55±0.48a 7.84±2.84b 3.18±1.24c 1.97±0.65a 3.98±1.43c 2.54±0.99剂量/(mg·kg-1·d-1)cd
2.4 多糖对高脂饮食小鼠肝脏中LPL、HL和LA的影响
由表5可知,与空白对照组相比,高脂模型组的LPL、HL和LA含量均有显著性升高。对照高脂模型组,各何首乌多糖给药组的LPL含量均有不同程度的升高,W-PMP低剂量组与高剂量组之间差别不显著,表明量效关系变化不明显;A-PMP低剂量组与高剂量组之间差别显著,量效关系存在显著性差异。各何首乌多糖给药组的HL和LA含量较高脂模型组也均有不同程度的升高,其中 W-PMP低、高剂量组之间差别显著,量效关系存在显著性差异;A-PMP低剂量组与高剂量组之间差别变化不显著,表明量效关系差异不明显。W-PMP高剂量组与A-PMP低、高剂量组之间差异显著。
表5 何首乌多糖对高脂饮食小鼠肝脏中LPL、HL和LA含量的影响†Table 5 Effects of PMP on Liver LPL、HL、LA of mice with hyperlipemia(,n=10)

表5 何首乌多糖对高脂饮食小鼠肝脏中LPL、HL和LA含量的影响†Table 5 Effects of PMP on Liver LPL、HL、LA of mice with hyperlipemia(,n=10)
† 同一列标有不同字母的表示差异显著(P<0.05)。
水提多糖组 碱提多糖组组别 空白对照组 高脂模型组低高低高0 0 50 200 50 200 LPL/(U·mg-1·prot-1) 0.733±0.028a0.843±0.151b 1.105±0.181c 1.244±0.296c 0.985±0.124c 1.061±0.190cde HL/(U·mg-1·prot-1) 0.729±0.028a0.848±0.159b 1.120±0.167c 1.301±0.177d 0.982±0.124e 1.112±0.213ce LA/(U·mg-1·prot-1) 1.463±0.054a1.691±0.301b 2.225±0.182c 2.545±0.323d 1.967±0.247e 2.173±0.207剂量/(mg·kg-1·d-1)ce
2.5 多糖对高脂饮食小鼠脏器指数的影响
长期的高脂饲料可导致受试小鼠脏器脂质累积及病变等变化,可通过脏器指数反映[9]。由表6可知,与空白对照组相比,高脂模型组的心脏指数、肝脏指数和肾脏指数均有所增加,而肝脏指数增大,表明有肝损伤。对照高脂模型组,各何首乌多糖给药组的肝脏指数均有所下降,且各剂量之间存在显著性差异,其中A-PMP高剂量组与 W-PMP高剂量组差异变化不显著。W-PMP低、高剂量组的心脏指数和肾脏指数变化差异显著,且存在量效关系;W-PMP高剂量组与A-PMP低、高剂量组相比,变化差异不显著。
表6 何首乌多糖对高脂血症小鼠脏器指数的影响Table 6 Effects of PMP on viscera weight of mice with hyperlipemia(,n=10)

表6 何首乌多糖对高脂血症小鼠脏器指数的影响Table 6 Effects of PMP on viscera weight of mice with hyperlipemia(,n=10)
† 同一列标有不同字母的表示差异显著(P<0.05)。
水提多糖组 碱提多糖组组别 空白对照组 高脂模型组低高低高剂量/(mg·kg-1·d-1)0 0 50 200 50 200肝脏/体重(×100) 4.35±0.042a6.66±0.886b 5.18±0.7548a 4.63±0.143c 5.55±0.121c 5.06±0.740acde心脏/体重(×100) 0.35±0.003a0.60±0.018b 0.50±0.015c 0.40±0.030d 0.55±0.029e 0.44±0.031d肾脏/体重(×100) 1.23±0.215a1.58±0.178b 1.34±0.168a 1.24±0.185ac 1.43±0.199acd 1.30±0.124acde
3 讨论
血清TC、TG含量高是高脂血症的主要指标,HDL-C能够转运动脉壁胆固醇到肝脏分解为胆酸,是有效的抗动脉硬化(AS)因子。近年来研究[10]表明:HDL-C对动脉血管壁有直接的保护作用,能使动脉粥样硬化病变消退,HDL-C的含量越低,冠心病发病的机率越高。本试验结果表明:高脂模型组小鼠的血清TC和TG均显著高于正常组,HDL-C显著低于正常组,说明高血脂症小鼠模型组造模成功。而在高脂饲喂过程中分别灌胃W-PMP和A-PMP,均可以显著降低小鼠血清TC和TG水平,显著升高血清HDL-C水平。其中W-PMP高剂量组与空白对照组相比,各项指标相当接近,说明高剂量的 W-PMP较A-PMP具有更好的降血脂效果,对高脂血症的发生有一定的预防作用。
AS引起的心血管疾病已严重危害人类的健康,其发病率和死亡率居各种疾病之首。动脉粥样硬化是多危险因素所致的慢性疾病,其中血脂水平升高和高胆固醇血症己经被确认为动脉粥样硬化发生和发展的重要因素,降低血脂尤其是胆固醇水平可减少动脉粥样硬化危险性[11]。本试验结果表明:灌胃W-PMP和A-PMP均可使高脂饮食小鼠的AI有不同程度的降低,且W-PMP较A-PMP高剂量组的AI指数已接近正常水平,说明200mg/(kg·d)的 W-PMP对冠心病和动脉粥样硬化有一定的预防作用。
LPL在许多组织中产生,主要分布在脂肪和心肌等组织的毛细血管内皮细胞表面并在肝素作用下释放进入血液,LPL是分解血清乳糜微粒(CM)、极低密度脂蛋白(VLDL)中甘油三脂(TG)的脂解酶,可将CM和VLDL中的TG水解为甘油和游离脂肪酸(FFA)[12]。HL则主要在肝细胞中合成,具有两种生物学功能,血浆中的HL水解各种脂蛋白中的TG和PL,肝细胞中的HL还能作为配体促进肝细胞摄取高密度脂蛋白(HDL)中的胆固醇或LDL残粒以及含载脂蛋白β脂蛋白,这种功能可影响血浆中脂蛋白的浓度[13]。LA是LPL与HL酶活性的总和,同时具有甘油三脂脂肪酶、甘油一脂脂肪酶及磷脂酶的活性。通过这些脂解酶类的作用可分解出游离脂肪酸,再进一步由β-氧化作用分解[14-16]。本试验结果表明:W-PMP和A-PMP均能显著升高小鼠肝脏脂酶的含量,其中以W-PMP高剂量组的效果尤为显著。何首乌多糖能显著降低高脂血症小鼠肝脏脂肪含量作用可能与提高LA、LPL、HL的含量有关,提高LA、LPL、HL含量可能加速肝脏脂肪分解成游离脂肪酸,从而限制脂肪在肝脏内积累。而高脂模型组和何首乌多糖低、高剂量组肝脏LA、LPL、HL含量均比空白对照组高,可能是由于食物中脂类物质增多,肝脏LA、LPL、HL含量随之增高所致。综上所述,何首乌多糖可提高肝脏脂酶含量,进而增加肝脏脂质分解,对脂肪肝有一定的预防以及改善肝脂肪积累等作用。
4 结论
(1)何首乌多糖能显著降低经高脂饲料饲喂后小鼠的体重,增幅比分别为:26.7%、47.6%、13.1%、32.2%,其中以200mg/(kg·d)的 W-PMP增幅比最为显著。且何首乌多糖对高脂饮食小鼠的摄食量无显著影响。表明小鼠体重的降低与摄食量无明显关系。
(2)对照模型组,各何首乌多糖给药组的TC、TG均有所降低,HDL-C以及LA、LPL和HL均有所提高;其中灌胃200mg/(kg·d)的 W-PMP的试验小鼠的各项指标均接近于正常水平,说明200mg/(kg·d)的水提何首乌多糖有良好的降血脂作用。
(3)何首乌多糖能显著降低各给药组小鼠的肝脏体重比、心脏体重比和肾脏体重比,其中以200mg/(kg·d)的W-PMP组的降低程度较为显著,并且对小鼠的心、肝、肾等器官无明显的副作用。说明高剂量的水提何首乌多糖作为一种新型的降血脂药物原料具有良好的优越性。
1 赵文华,张坚,由悦,等.中国18岁及以上人群血脂异常流行特点研究[J].中华预防医学杂志,2005,39(5):306~310.
2 赵冬.中国人群的血脂流行病学研究[J].临床荟萃,2006,21(8):533~538.
3 李时珍.本草纲目[M].北京:人民卫生出版社,1972:1 288~1 289.
4 Franz G.Polysaccharides in pharmacology,Current application and future concepts[J].Plant Medica,1998(55):493.
5 高丽君,崔建华,王建华,等.何首乌多糖的提取及活性研究[J].福建中医药,2006,37(4):50~52.
6 许爱霞,张振明,葛斌,等.何首乌多糖对氧自由基及抗氧化酶活性的作用研究[J].中国药师,2005,8(11):900~902.
7 苗明三,方晓艳.制何首乌多糖对衰老模型小鼠抗氧化作用的研究[J].中药药理与临床,2002,18(5):23~24.
8 丁苏.微波合成低聚木糖及其抗氧化与降血脂作用研究[D].无锡:江南大学,2008.
9 Passalllonti S,Vanzo A,Vhtovsek U,et al.Hepatic uptake of grape anthocyanins and the role of bilitranslocase[J].Food Research International,2005(38):953~960.
10 Q iong Luo,Yizhong Cai.Hypoglycemic and hypolipidemic effects and antioxidant activity of fruit extracts from Lycium barbarum[J].Life Science,2004(76):137~149.
11 郭素芬,包海花,李志强,等.甘薯的抗家兔主动脉粥样硬化形成作用[J].中国动脉硬化杂志,2004,12(l):23~27.
12 李佳楠,陈东辉,罗霞,等.温胆肠对高脂血症大鼠及小鼠体内脂质代谢调节机理研究[J].江汉大学学报,2004,32(2):62~66.
13 张晓刚.肝脂酶与脂蛋白代谢[J].国外医学:临床生物化学与检验学分册,2002,23(1):48~49.
14 单安山,徐奇友.动物脂肪代谢与调控[J].东北农业大学学报,2004,35(2):129~134.
15 杜荣,秦健,王俊东.动物脂质代谢调控的关键及其研究进展[J].动物科学与动物医学,2002,19(10):16~19.
16 张晓刚,陈运贞,雷寒,等.试验性兔脂肪肝肝脂酶活性变化及茶多酚的作用[J].中华肝脏病杂志,2003,11(2):77~80.
Hypolipidemic effect of the polysaccharide from polygonum multiflorum
ZHAI Rong LV Li-shuangJIN Bang-quan
(Department of Food Science,Ginling College,Nanjing Normal University,Nanjing,Jiangsu210097,China)
Polygonum multiflorumpolysaccharide was extracted by water and alkaline respectively,and the study of PMP on the serum total cholesterol(TC),triglycerids(TG),high density lipoproteincholesterol(HDL-C)and the weight of body,heart,liver and kidney and lipoprotein lipase(LPL),hepatic lipase(HL),and total lipase(LA)were investigated in artificially-induced hyperlipemial ICR mice.The results showed the mean values of serum TC,TG and AI concentrations decreased significantly (P<0.05)while HDL-C,LPL,HL and LA concentration increased significantly (P<0.05)which meant PMP had significant effects of hypolipidemic effect in experimental hyperlipemial mice.
polygonum multiflorumpolysaccharide;hyperlipemia;effect
10.3969 /j.issn.1003-5788.2010.05.025
翟蓉(1986-),女,南京师范大学在读研究生。E-mail:lishuanglv@yahoo.com.cn
吕丽爽
2010-06-01

