渤海湾西岸牡蛎壳体形态、生长速率与生长环境的关系
范昌福,裴艳东,王宏,李延河
(1. 中国地质科学院矿产资源研究所,北京 100037;2. 中国地质调查局天津地调中心,天津 300170)
渤海湾西岸牡蛎壳体形态、生长速率与生长环境的关系
范昌福1,2,裴艳东2,王宏2,李延河1
(1. 中国地质科学院矿产资源研究所,北京 100037;2. 中国地质调查局天津地调中心,天津 300170)
牡蛎壳体的尺寸、生长年龄和生长速率是其生命历史中一些最基本的生态信息,与礁体综合生长环境有关;通过对礁体中的壳体形态和壳体生长速率的对比研究,可以恢复礁体生长时期的综合环境。通过对取自黄港水库、大吴庄和岭头三个埋藏牡蛎礁体中保存完好的牡蛎壳体的形态统计分析,并对其中部分适合贝壳年轮研究的壳体进行生长年龄和死亡季节的分析研究;恢复了壳体记录的礁体生长环境,并探讨礁体生长环境对壳体形态的影响和塑造。结果表明,黄港水库礁体中的壳体具有最快的壳高生长速率和最短的生长寿命,礁体生长在距离河口较近的位置,礁体生长环境较动荡;大吴庄礁体中的壳体具有宽大肥厚的壳体外形和最快的壳重增长速率,礁体生长在潮间带或浅海区等稍远离河口的位置,生长环境相对稳定;岭头礁体中的壳体细窄扁平,壳重和壳高生长速率均最慢,礁体生长在如海湾或潟湖等相对封闭的环境中。
壳体形态;贝壳年轮;生长速率;礁体环境;牡蛎礁
牡蛎是世界性广布类型,生长在半咸水或浅海水中;遍布于中国海区的潮间带和浅海区[1,2]。20世纪 50年代就对中国近海牡蛎进行过系统的分类研究[1],直到 90年代仍有新种发现[3]。长重牡蛎(Crassostrea gigas; Thunberg, 1793)广布于中国从鸭绿江口至广东沿海等地,大量繁殖在低潮线一米以下的深度;一般在咸淡水中生活的个体较大,在正常咸度海水中生长的个体较小;体型较大,壳坚厚、呈长条形或卵圆形[1]。牡蛎有左右二壳,通常左壳较大,借此附着于外物之上,并且随附着物的形状、性质不同或因各地区环境不同而引起形态上的变化[4,5]。
渤海湾西北岸沿岸平原分布着众多的埋藏牡蛎礁体,不同礁体中的牡蛎壳体形态有明显的区别,有些礁体中的壳体细窄,而有些礁体中的壳体较宽厚;同时,不同礁体中的沉积物颗粒和粘土含量也有明显的差别[6]。初步的研究结果表明,组成礁体的壳体形态与礁体的沉积环境有关,当沉积物较细、粘土含量较高时发育细窄的壳体;当沉积物较粗、粘土含量较低时发育宽厚的壳体[6]。此外,礁体生长时的泥质沉积物沉积速率、食物来源和生长环境(如水温与盐度)等差异都能影响到壳体的形态和生长速率[7-9]。因此,通过对礁体中的壳体形态和壳体生长速率的对比研究,可以恢复礁体生长时的综合环境。
生物体的寿命、生长速率和成体的尺寸大小是其生命历史过程中一些最基本的生态信息。这些生命信息是探索其进化过程的重要依据[10]。随着软体动物的生长,贝壳逐渐长大;与此同时,它们生存的独特环境,也都详细地刻在了贝壳上。贝壳的大小、形态和结构能使我们了解到壳体骨骼的构造方式以及生物是如何根据周围环境而进行调整的[11]。
渤海湾地区的牡蛎壳体,其韧带部位剖面内记录了清晰的晚秋至早春低温季节形成的灰色半透明缓慢生长层,并在韧带槽表面有对应的凹沟;在每两个冬季低温灰色半透明生长层之间,还记录了初夏季节因产卵而导致的另一灰色半透明生长层,这一生长层在壳体韧带槽表面对应于外凸层中部浅而窄的小凹沟[12]。因此,通过对牡蛎壳体的贝壳年轮研究,不仅可以获得贝壳生长年龄、壳体生长速率,还可判断壳体的死亡季节[12]。
本文选择了大吴庄、黄港水库和岭头三个埋藏牡蛎礁体(图1),据牡蛎壳体的14C测年结果,大吴庄礁体的形成年代为7 200–5 600 cal BP[13],黄港水库礁体的形成年代为2 450– 2 300 cal BP[14];另据岭头礁体在渤海湾地区的空间分布位置和邻区礁体的年代结果,推测其形成年代约为5 800–4 000 cal BP[15]。对其中保存完好的牡蛎壳体的形态(壳重、壳高、壳长和壳宽)进行了测量和统计分析,另对其中部分适合于进行贝壳年轮研究的壳体进行生长年龄和死亡季节的判断与识别;根据壳体形态特征与壳体生长速率,恢复壳体记录的礁体生长环境,并探讨礁体生长环境对壳体形态的影响和塑造。

图 1 大吴庄、黄港水库和岭头礁体分布位置图(据文献[6,14])Fig. 1 Distribution of Huanggang, Dawuzhuang and Lingtou oyster reefs
组成这三个礁体的牡蛎壳体形态和泥质沉积物组成之间有明显的区别。壳体形态方面,大吴庄礁体中的壳体较宽厚,岭头礁体中的壳体较细窄[6],而黄港水库礁体中的壳体尺寸硕大[14]。泥质沉积物方面(表1),大吴庄礁体中的泥质沉积物颗粒粗、粘土含量低,沉积物粒度频率分布曲线呈双峰;而岭头礁体中的泥质沉积物颗粒细、粘土含量高[6],沉积物粒度频率分布曲线呈单峰;黄港水库礁体中的泥质沉积物颗粒介于大吴庄礁体和岭头礁体之间、沉积物分选差[14],沉积物粒度频率分布曲线呈双峰。

表 1 大吴庄、黄港和岭头礁体中的沉积物平均特征[6,14]Tab. 1 Average characters of sediment grain size in Dawuzhuang,Huanggang and Lingtou oyster reefs
1 材料与方法
分别在开挖出的黄港水库、大吴庄和岭头埋藏牡蛎礁体中随机挑选了130对、58对和117对双壳闭合且未破损的长重牡蛎壳体。壳体样品的清洗方法同文献[6],将样品在阳光下晒干后浸入水中,并逐个刷洗壳体的表面,同时尽可能去除粘合在壳体上的其它生物壳体,用清水冲洗后将洗净的成对牡蛎壳体自然风干。对洗净干燥后的样品逐个编号,并依次称取壳体的重量,量取壳体的壳高、壳长、壳体厚度及部分壳体的左壳韧带高[6]。
由于只有那些保存完好,且左壳韧带部位、闭壳肌痕和生长缘呈同一条直线分布的牡蛎壳体(图2),才适合于沿纵剖面切开后计数壳体的生长年龄[16]。在完成上述壳体形态参数测量工作后,分别在大吴庄、黄港水库和岭头礁体样本中随机挑选了10对、11对和7对适宜于进行贝壳年轮研究的壳体样品进行壳体生长年轮的计数和壳体生长速率的计算。通过对牡蛎壳体切割剖面内记录的冬季低温和初夏季节产卵形成的灰色半透明生长层的识别和计数,获得牡蛎壳体的生长年龄[12]。

图 2 牡蛎壳体的壳高、壳长和壳宽(据文献[7,16])Fig. 2 Diagram showing method of measuring the height, length, and width of oyster valves
2 结 果
2.1 各礁体中的壳体形态
壳重和壳高的关系式常被用来表示牡蛎生长快慢的指数[8]。此前,我们对大吴庄和岭头礁体中的壳体重量(W)与壳高(H)拟合关系式分别为[6]:

本次,对取自黄港水库礁体中的130对牡蛎壳体的壳重和壳高关系拟合结果为:W黄港=0.214H1.550(n=130)。
从图3中可以看出,壳体重量随高度增加的速率逐渐变大;且随着壳高的增加,大吴庄礁体中的壳重增长速率最快,岭头礁体中的壳重增长速率最慢,黄港水库礁体中的壳体壳重增长速率介于二者之间。三个礁体中,黄港水库礁体中壳体之间的壳重随壳高增长速率的相关性最差,相关系数仅为0.27;大吴庄礁体中的壳体壳高与壳重的相关性最好,相关系数达0.65。

图 3 大吴庄、黄港和岭头礁体中的壳体重量与壳高关系图[6]Fig. 3 Relationship between the height and the weight of oyster shells sampled from Dawuzhuang, Huanggang and Lingtou oyster reefs
在三个礁体中,大吴庄礁体中的壳体平均壳重最大,平均值为1 753.4 g,大于黄港水库礁体中的壳体平均重量(1 502.5 g)和岭头礁体中的壳体平均重量(996.9 g)。然而大吴庄礁体中的壳体平均高度却最小,平均值仅为232 mm,小于岭头和黄港水库礁体中的壳体平均壳高(300.8 mm);大吴庄礁体中的壳体壳长最长,平均值为133.8 mm,大于黄港水库和岭头礁体中的壳体。因此,大吴庄礁体中的壳体具有最大的壳长/壳高比(0.58),壳体最接近于椭圆形。而且,大吴庄礁体中的壳体具有最大的平均壳宽(表2)。因此,壳体的外形表现为宽大肥厚,壳体较为结实。
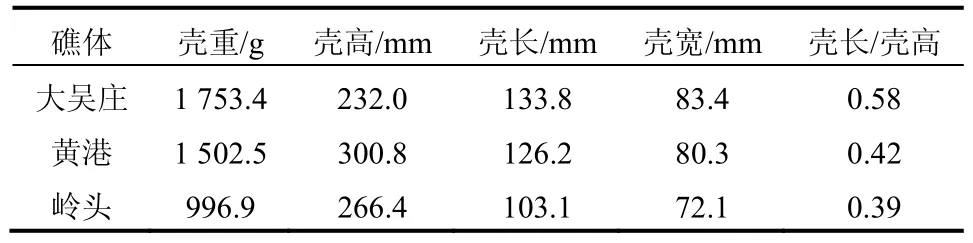
表 2 大吴庄、黄港和岭头礁体中的壳体平均形态参数Tab. 2 Average form parameters of oyster shells in Dawuzhuang,Huanggang and Lingtou reefs
岭头礁体中的壳体平均壳重、壳长和壳宽均最小,然而其平均壳高却大于大吴庄礁体中的壳体(表 2);因此,岭头礁体中的壳长/壳高比平均值最小,壳体细长;另外,由于岭头礁体中的壳体平均宽度也最小,因此岭头礁体中的壳体不仅细窄而且扁平,壳体较为单薄。
黄港水库礁体中的壳体平均壳高最大,壳高平均值达300.8 mm。虽然黄港水库礁体中的平均壳高比大吴庄礁体中的壳体大70 mm,但其壳重平均值却比大吴庄礁体中的壳体小 250 g。黄港水库礁体中的壳体平均壳长/壳高比值小于大吴庄礁体中的壳体,而大于岭头礁体中的壳体。黄港水库礁体中的壳体形态介于大吴庄礁体中壳体的“宽大肥厚”和岭头礁体中壳体的“细窄扁平”之间(图4)。
2.2 各礁体中的壳体平均生长速率
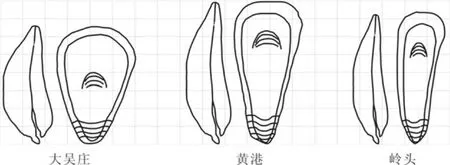
图 4 大吴庄、黄港和岭头礁体中的壳体形态示意图Fig. 4 Diagram of the form of oyster valve in Dawuzhuang,Huanggang and Lingtou oyster reefs
就三个礁体中被挑选出进行贝壳年轮研究的壳体平均值而言,黄港水库礁体中的壳体壳高平均值最大,壳高平均生长速率也最大,而壳体平均生长年龄却最小(表3);岭头礁体中的壳体壳高平均值最小,而壳体平均生长年龄却最大,因而壳高平均生长速率也最小;大吴庄礁体中的壳体壳高平均值和壳高平均生长速率介于黄港水库和岭头礁体之间,壳体平均生长年龄也介于二者之间。三个礁体内的壳体平均壳高与壳体平均生长年龄呈反相关关系,礁体中的壳体平均壳高越大,壳体平均生长年龄越小;而平均壳高越小,壳体平均生长年龄越大(图5)。说明,就整个礁体中的壳体平均值而言,黄港水库礁体中 10个壳体的平均壳高最大,平均生长年龄最小,壳体生长速率最快。岭头礁体中7个壳体的平均壳高值最小,平均生长年龄最大,壳体平均生长速率最慢。三个礁体中,黄港水库礁体中的壳体壳高最大,壳高生长速率最快;岭头礁体中的壳体壳高最小,壳高生长速率最慢;大吴庄礁体中的壳体壳高和生长速率介于二者之间。

表 3 大吴庄、黄港和岭头礁体中进行贝壳年轮研究的壳体平均参数Tab. 3 Average parameters of oyster shells selected for sclerochronological study in Dawuzhuang, Huanggang and Lingtou reefs
三个礁体中的壳体韧带高度平均值与壳体高度之间存在相同的变化趋势,黄港水库礁体中的壳体平均韧带高最大,平均生长速率最快;岭头礁体中的壳体平均韧带高度最小,平均生长速率最慢;大吴庄礁体中的壳体平均值介于两者之间。
礁体之间的壳体重量平均值与平均壳重增长速率呈相同的变化趋势(图5)。虽然黄港水库礁体中的壳高平均值(317.8 mm)大于大吴庄礁体中的壳高平均值(312.5 mm),但黄港水库礁体中的壳体重量平均值(1 262 g)却小于大吴庄礁体的壳重平均值(1 516 g);黄港水库礁体中的壳重平均值仍大于岭头礁体中的壳重平均值(1 067 g)。从壳体的平均壳长与壳高比值来看,大吴庄礁体中的平均壳长与壳高的比值大于黄港水库礁体中的壳体平均值,即大吴庄礁体中的壳体呈扁平状、壳体较宽,而黄港水库礁体中的壳体相对细窄。在壳体密度大体相同的情况下[6],大吴庄礁体中的平均壳体重量随单位壳高的增长速率大于黄港水库礁体,而黄港水库礁体中的壳体大于岭头礁体中的壳体(图5)。
各礁体之间,具有较大尺寸壳体的礁体,壳体生长年龄较小,壳高平均生长速率较快;具有较小尺寸壳体的礁体,壳体的生长年龄较大,壳高平均生长速率较慢。即在各礁体之间,较大尺寸的壳体是因为生长速率快造成的,而不是因为寿命长的缘故。

图 5 大吴庄、黄港和岭头礁体中进行贝壳年轮研究的壳体平均形态参数和平均生长速率Fig. 5 Average shell form parameters and growth rates of these sclerochronologically studied oyster shells in Dawuzhuang,Huanggang and Lingtou oyster reefs
2.3 各礁体内的壳体特征
从大吴庄礁体中随机挑选出的 10个壳体的贝壳年轮研究结果表明,有2个壳体死亡于冬季至早春低温季节,占20%;其余8个壳体均死亡于盛夏高温季节,占 80%。黄港水库礁体中挑选出的 11个壳体有2个死亡于冬季至早春低温季节,占18%;其余9个死亡于盛夏高温季节,占82%。岭头礁体中挑选出的7个壳体中有4个死亡于冬季至早春低温季节,占57%;其余3个死亡于盛夏高温季节,占43%。岭头礁体中的壳体在低温季节死亡的比例(57%)高于大吴庄(20%)和黄港水库(18%)礁体中的壳体;黄港水库和大吴庄礁体中的绝大部分壳体死亡于高温季节。死亡于冬季至早春低温季节的牡蛎个体,在其壳体韧带部位的最外侧为晚秋至早春低温季节形成的灰色半透明生长层[12];而死于盛夏季节的牡蛎个体,在其壳体韧带部位的最外侧为快速分泌的白色松软生长层,在此之前,壳体则经历了最后一个春季产卵形成的灰色半透明生长层[12]。
虽然在各礁体之间,壳体的平均形态参数之间有着规律性的变化关系(图5),但在各礁体内部,同一礁体内的壳体与壳体之间并不存在这种规律性的变化关系(图6)。在各礁体内部,随着壳高的减小,壳体的年龄、壳重和壳体韧带高均未表现出规律性的变化趋势。
3 讨 论
牡蛎在正常生长的过程中,均保持直立原地生长,因此,可以将壳体的壳高、壳长和壳宽划分为垂向上的壳高生长和水平方向上的壳长和壳宽生长。随着壳体的生长,垂向上的壳高不断地向上增长,壳高的增长速率受外界生长环境和自身生长年龄的影响;而壳长和壳宽会在壳体生命过程中的某一段时间内达到最大,这一时刻可能出现在壳体结束生长时,也可能出现在壳体生长的过程中,但无论哪种情况,水平方向上的壳体增长同样受外界生长环境和自身生长年龄的影响。在牡蛎分泌的壳体密度相似的情况下,垂向和水平方向的增长速率决定了壳体重量的增长速率,并最终影响壳体的重量。我们曾对大吴庄和岭头礁体中的壳体密度进行过计算,结果表明虽然两个礁体中的壳体形态有显著的差别,但两个礁体中的壳体密度却非常接近[6]。
大吴庄礁体中的壳体具有水平方向上(壳长和壳宽两方面)的优势,随着单位壳高的增长,壳重增加的速率最快,壳体的平均重量也最大。大吴庄礁体中的壳体壳高与壳重的相关性最好,相关系数达0.65,表明大吴庄礁体中的壳体形态较均一,礁体在整个建礁过程中,生长环境相对稳定。因此推测礁体可能建造在稍远离河口的潮间带或浅海区位置,水体盐度较高。大吴庄礁体中的泥质沉积物硅藻组合分析结果也表明,在礁体建造初期,受海水影响作用显著;随着礁体不断向上建造,海水作用逐渐减弱[17]。在盐度较高环境下生长的牡蛎,其壳体生长所需的溶解钙和碳酸盐离子充足[11,18],且牡蛎个体可能因过多的淡水输入造成的水体盐度较低而被迫停止生长的时间短[18],礁体中的牡蛎个体具备了快速生长的外部环境。另外,在较高盐度水体中生长的生物,受众多捕食生物和钻孔生物,以及较强的海水溶蚀作用的影响,生物个体被迫分泌较厚的壳体予以抵御[18]。再则,礁体生长在稍远离河口的位置,因河流携带的大量泥沙较少运抵于此,礁体生长区的泥沙堆积速率相对较低,牡蛎个体可以自由地生长而不会被掩埋。为了争夺更多的空间和繁育后代的机会,牡蛎个体则会尽可能地在水平方向上扩张[7,11]。在上述综合环境条件的影响下,形成了具有最大壳重生长速率和宽大肥厚外形的牡蛎壳体。

图 6 大吴庄、黄港和岭头礁体中的壳体壳高、壳重和韧带高生长速率Fig. 6 Oyster shell heights, weights, hinge heights and their respective growth rates in Dawuzhuang, Huanggang and Lingtou reefs
黄港水库礁体中的壳体高度最大,壳体生长寿命最短,壳高生长速率最快,说明黄港水库礁体的生长环境为一较动荡的水体,因为在变动幅度较大的水体环境下生长的生物壳体具有生长速率快、壳体寿命短的特征[10]。另外,黄港水库礁体中的壳体之间的壳重随壳高增长速率的相关性最差,相关系数仅为0.27,说明黄港水库礁体中的壳体形态差别较大,影响壳体形态的生长环境波动较大,也表明了礁体生长在一相对开放的环境中。此外,根据对黄港水库牡蛎礁体的综合环境分析表明,该礁体生长于河口环境下[14],随着季节性淡水输入量的不断变化,礁体的生长环境波动较大。
一方面,在河口区生长的生物个体,因河流携带的大量有机质为浮游生物的繁盛提供保障,从而为在此生长的虑食生物生长提供大量的食物来源;而且,黄港水库礁体中有数量众多的伴生生物—梯蛤(Trapezium liratum)壳体[14],也可说明礁体生长过程中有充足的食物来源[18],充足的食物来源为礁体中的壳体快速生长提供了前提条件[9]。另一方面,在这种半咸水环境下生长的生物个体,因不能获得壳体增长所需的充裕溶解钙和碳酸盐离子[11,18],致使生物壳体无法达到最佳的生长状态。并且,在河口环境下生长的牡蛎礁体,因河流携带的泥沙搬运至此后大量卸载,从而导致礁体生长区的泥沙沉积物堆积速率相对较高,迫使生物个体将并不充裕的造壳物质大部分用于垂向上的壳高生长,以免这些固着生长的生物被快速的泥沙堆积掩埋窒息而死。
黄港水库礁体中的壳体具有垂向上的壳高生长优势,但壳高优势仍不足以抵抗大吴庄礁体中的壳体所具有的壳长和壳宽两方面的优势;而且黄港水库礁体中的壳体平均生长年龄较小、寿命短,因而在平均壳体重量上,黄港水库礁体中的壳体平均重量依然小于大吴庄礁体中的壳体平均重量。由于生物个体在幼年阶段的生长速率较快,随着年龄的增长,其生长速率逐渐减缓[7,11,19],当壳体的生长速率低于其生长区泥沙堆积速率时,壳体被掩埋而被迫停止生长。在上述综合环境的塑造下,形成了黄港水库礁体中平均生长寿命短、壳高生长速率较快的牡蛎壳体。
岭头礁体中的壳体尺寸最小、生长寿命最长,壳高生长速率最慢,说明岭头礁体的生长环境为一相对平稳的水体,因为在变幅较小的水体环境中生长的生物壳体具有生长速率慢、壳体寿命长的特征[10]。岭头礁体中的泥质沉积物硅藻组合结果显示,硅藻种相对单一,浅海与浮游种含量大,礁体建礁过程中主要受海洋作用影响[20]。另外,岭头礁体中的沉积物粒度频率分布曲线呈单峰,而大吴庄和黄港水库礁体中的沉积物粒度频率分布曲线呈双峰,且与岭头礁体邻近的桐城礁体(图 1)中的沉积物粒度频率分布曲线也呈双峰(待发表资料),说明岭头礁体在生长过程中仅受单一的水动力作用,礁体不可能与大吴庄和黄港水库礁体一样生长于开放的河口海岸环境下。由于其硅藻组合显示礁体主要受海洋作用的影响[20],因此,岭头礁体可能生长在一相对封闭的小海湾或潟湖环境中,礁体的生长环境稳定。
由于岭头礁体的生长环境相对封闭,外源沉积物的输入量相对较少,礁体生长区泥沙沉积速率较低,沉积物的堆积不会对壳高的增长形成压力,因而壳体可以自由地缓慢生长。另外,已有的研究结果表明,在适宜于牡蛎生长的盐度范围内,水体盐度较高时,壳体的生长速率则相对较低[21-23];岭头礁体中的硅藻组合特征表明,礁体受海洋作用影响较强,水体盐度相对较高[20],因而牡蛎在维持正常生长的情况下,壳体生长速率相对缓慢。岭头礁体中的壳体生长速率缓慢还可能与礁体中的沉积物颗粒较细、粘土含量高有关[6],在这种沉积环境下生长的生物,用于壳体生长的一部分能量被用于清除外套膜表面的细颗粒沉积物,从而减缓了壳体的自身生长[9,24]。
在各礁体内部,由于礁体的建礁时间较长,达数百甚至上千年,在这一漫长的过程中,礁体生长环境在不断地波动或变化,随机选自礁体不同部位(不同时间、不同生长环境下生长的)的壳体,受变化的礁体生长环境影响,塑造了具有不同形态特征的壳体,壳体与壳体之间的相关性较差[6]。
在本文分析的三个礁体内的 28个壳体中,有20个壳体死亡于夏季,仅有8个壳体死亡于春季,而死亡于春季的壳体中有 50% 的壳体来自岭头礁体。调查显示,有 80% 的牡蛎死亡于夏季[25],这不仅由于夏季水温、盐度、水质和病原体等客观方面的原因造成的[26,27];主观方面,因为夏季配子发生时期要消耗大量的无氮营养物质,迫使蛋白质过渡消耗,致使生物体质脆弱,不能抵御高温环境变化压力而死亡[26];此外,还与牡蛎产卵时新陈代谢失调有关[28,29]。
然而,在分析的岭头礁体内的壳体中,有一半以上的壳体死亡于晚秋至早春低温季节。造成牡蛎在冬季大量死亡的原因有很多,如异常低温和冬季淡水输入减少而造成的水体盐度增高等。在较高盐度环境下,被捕食和非捕食性死亡的比例均较高[30],尤其在一年中盐度最高的晚秋至早春季节,牡蛎被动或主动死亡的可能性增大。
4 结 论
a) 牡蛎壳体的形态特征和生长速率与礁体的环境密切相关。
b) 大吴庄礁体中的壳体具有宽大肥厚的外形,岭头礁体中的壳体则表现为细窄扁平,黄港水库礁体中的壳体外形介于二者之间。
c) 黄港水库、大吴庄和岭头礁体中,壳体平均尺寸(壳高)大的黄港水库礁体中的壳体,具有较短的生长寿命,壳高的优势是由于壳高生长速率快造成的;岭头礁体中的壳体平均壳高最小,平均生长寿命最长,平均壳高和壳重生长速率最慢;大吴庄礁体中的平均壳重生长速率最快。
d) 礁体中的壳体所具有的壳体外形和壳体生长速率,显示了黄港水库礁体生长在距离河口较近的位置,受淡水输入的直接影响,礁体生长环境动荡且开放;大吴庄礁体生长在潮间带或浅海区等离河口稍远的位置,礁体生长环境相对稳定;岭头礁体生长在海湾或潟湖等相对封闭的环境中,礁体生长环境相对最为稳定。
e) 大多数牡蛎壳体死亡于盛夏高温季节,这与其生理特征和外界环境的变化有关。但岭头礁体中大部分壳体死亡于冬季至早春低温季节,可能与礁体生长水体的盐度较高有关。
致谢:中国地质调查局天津地调中心耿岩、盛晶瑾、王福、田立柱和商志文参加了野外样品的采集和贝轮研究样品的前处理工作,一并致谢。
[1] 张玺, 楼子庚. 中国牡蛎的研究 [J]. 动物学报, 1956, 8(1):65-93.
[2] 李孝绪, 齐钟彦. 中国牡蛎的比较解剖学及系统分类和演化的研究 [J]. 海洋科学集刊, 1994, 35: 143-178.
[3] 徐风山, 黄修明. 中国近海牡蛎超科的新记录 [J]. 海洋科学集刊, 1993, 34: 175-179.
[4] 张玺, 楼子庚. 牡蛎 [J]. 生物学通报, 1956, 2: 27-32.
[5] 周德荫, 洪君超, 吴振兴, 等. 褶牡蛎、长牡蛎形态的年龄变异及海域变异 [J]. 浙江水产学院学报, 1983, 2(1): 21-28.
[6] 范昌福, 裴艳东, 王宏, 等. 渤海湾西北岸埋藏牡蛎礁体中的壳体形态与沉积环境 [J]. 第四纪研究, 2007, 27(5): 806-813.
[7] Kennedy V S, Newell R I E, Eble A F. The Eastern oyster:Crassostrea virginica[M]. College Park: Maryland Sea Grant College, University of Maryland. 1996: 1-734.
[8] Sarà G, Mazzola A. Effects of trophic and environmental conditions on the growth ofCrassostrea gigasin culture [J]. Aquaculture,1996, 153 (1-2): 81-91.
[9] Elfwinga T, Blidberga E, Sisonb M, et al. A comparison between sites of growth, physiological performance and stress responses in transplantedTridacna gigas[J]. Aquaculture, 2003, 219: 815-828.
[10] Hoffman E N, Geary D H. Longevity and Growth Rate of Ancient and Modern Dreissenid Mussels in An Environmental Context [D].2008 Joint Annual Meeting: GSA, ASA, CSSA, SSSA, GCACS,Celebrating the International Year of Planet Earth, October 5-9 2008, Houston Texas, George R. Brown Convention Center.
[11] Vermeij G J. A natural history of shells [M]. Princeton, Princeton University Press. 1993: 1-216.
[12] 范昌福, 王宏, 裴艳东, 等. 牡蛎壳体的同位素贝壳年轮研究[J]. 地球科学进展, 2010, 25(2): 163-173.
[13] 范昌福, 李建芬, 王宏, 等. 渤海湾西北岸大吴庄牡蛎礁14C测年与缓变型地质环境变化 [J]. 地质调查与研究, 2005, 28(2):124-129.
[14] 范昌福, 王宏, 裴艳东, 等. 渤海湾西北岸滨海湖埋藏牡蛎礁古生态环境 [J]. 海洋地质与第四纪地质, 2008, 28(1): 33-41.
[15] 王宏, 范昌福, 李建芬, 等. 渤海湾西北岸全新世牡蛎礁研究概述 [J]. 地质通报, 2006, 25(3): 315-331.
[16] Harding J M, Mann R. Age and growth of wild Suminoe(Crassostrea ariakensis, Fugita 1913) and Pacific (C. gigas,Thunberg 1793) oyster from Laizhou Bay, China [J]. Journal of Shellfish Research, 2006, 25(1): 73-82.
[17] 李东玲, 范昌福, 黄玥, 等. 渤海湾西北岸中全新世埋藏牡蛎礁的硅藻记录及古环境意义 [J]. 海洋通报, 2009, 28(3): 22-28.
[18] Kirby M X. Paleoecological differences between Tertiary and QuaternaryCrassostreaoysters, as revealed by stable isotope sclerochronology [J]. PALAIOS, 2000, 15: 132-141.
[19] Dettman D L, Flessa K W, Roopnarine P D, et al. The use of oxygen isotope variation in shells of estuarine mollusks as a quantitative record of seasonal and annual Colorado River discharge [J].Geochimica et Cosmochimica Acta, 2004, 68(6): 1253-1263.
[20] 商志文, 范昌福, 李东玲, 等. 硅藻组合指示的两个牡蛎礁体生长环境的差异 [J]. 海洋地质与第四纪地质, 2010, 待刊.
[21] Menzel R W, Hulings N C, Hathaway R R. Oyster abundance in Apalachicola Bay, Florida, in relation to biotic associations influenced by salinity and other factors [J]. Gulf Research Reports,1996, 2: 73-96.
[22] Carbotte S M, Bell R E, Ryan W B F, et al. Environmental change and oyster colonization within the Hudson River estuary linked to Holocene climate [J]. Geo-Marine Letter, 2004, 24: 212-224.
[23] Pekar S F, Mchugh C M G, Christie-Blick N, et al. Estuarine processes and their stratigraphic record: paleosalinity and sedimentation changes in the Hudson Estuary (North America) [J].Marine Geology, 2004, 209: 113-129.
[24] Pratt D M, Campbell D A. Environmental factors affecting growth inVenus mercenaria[J]. Limnology and Oceanography, 1956, 1:2-17.
[25] Soletchnik P, Ropert M, Mazurié J, et al. Relationships between oyster mortality patterns and environmental data from monitoring databases along the coasts of France [J]. Aquaculture, 2007,271(1-4): 384-400.
[26] 毛玉泽, 周毅, 杨红生, 等. 长牡蛎(Crassostrea gigas)代谢率的季节变化及其与夏季死亡关系的探讨 [J]. 海洋与湖沼, 2005,36(5): 445-451.
[27] Malham S K, Cotter E, O'Keeffe S, et al. Summer mortality of the Pacific oyster,Crassostrea gigas, in the Irish Sea: The influence of temperature and nutrients on health and Survival [J]. Aquaculture,2009, 287(1-2): 128-138.
[28] 陈瑞海. 牡蛎死亡及控制 [J]. 福建水产. 1987, 1: 83-85.
[29] 王鉴, 王志松, 张胜利, 等. 太平洋牡蛎生理活动的季节变化[J]. 水产科学, 2000, 19(2): 17-19.
[30] Gunter G. Mortality of oysters and abundance of certain associates as related to salinity [J]. Ecology, 1955, 36(4): 601-605.
Relationship among the form, growth rate and living environment of oyster shells in west coast of Bohai Bay
FAN Chang-fu1,2, PEI Yan-dong2, WANG Hong2, LI Yan-he1
(1. Institute of Mineral Resources, Chinese Academy of Geological Sciences, Beijing 100037, China;
2. Tianjin Centre, China Geological Survey, Tianjin 300170, China)
The longevity, growth rate, and adult size of oyster are fundamental components to the oyster life history and have relationship with its living environment. Therefore, we can reconstruct palaeo-environment of oyster reef with the study of shell form and growth rate. In this study, shell form of Height, Weight, Length and Width, shell age,death season and growth rate of oyster shells, which sampled from Huanggang (HG), Dawuzhuang (DW) and Lingtou(LT) reefs were analyzed, in order to reveal palaeo-environments recorded by these three reefs. Further, the relationship between the reef environment and shell form, growth rate and longevity was also discussed. Results show that oyster shells sampled from HG reef are characterized by the largest size of shell height but shortest growth age, and therefore,they have the highest growth rate of shell height; oyster shells sampled from DW reef are characterized with the highest shell weight growth rate and shell valves are round and thick; oyster shells sampled from LT reef are characterized with the slowest shell weight and shell height growth rates and shell valves are thin and slim. Shells sampled from different reefs reveal that HG reef was living near to a river mouth and its living environment was not stable; DW reef was living relatively far from river mouth of intertidal zone or shallow sea environmental conditions,which was apparently stabler than HG reef; LT reef was living at close and stable environmental conditions as lagoon or small bay.
shell form; sclerochronology; growth rate; paleo-environment; oyster reef
Q915.817+.4
A
1001-6932(2010)05-0526-08
2010-03-19;
2010-06-14
国家自然科学基金项目(40872106和40742011)、公益性科研院所基本科研业务费项目(K0919)和“中国泥质海岸带对全球变化响应的研究与趋势预测”课题(1212010911069)共同资助
范昌福 (1979-),男,博士后,从事海岸带地质环境研究。电子邮箱:fancf@cags.ac.cn;changfu79@yahoo.com

