影响文心兰叶片体胚诱导的条件研究
潘銮银,宋红改,蒋 晶,乔桂荣,李海营,王 扬,林永生,卓仁英
(1.云南农业大学 植物保护学院,云南 昆明 650201;2.中国林业科学研究院 亚热带林业研究所,浙江 富阳311400;3.三峡大学 生物技术研究中心/天然产物研究与利用湖北省重点实验室,湖北 宜昌 443002;4.福建省莆田市江口农业服务中心,福建 莆田 351115)
文心兰 Oncidium flexuosum,又名舞女兰、瘤瓣兰,为兰科 Orchidaceae瘤瓣兰属 Oncidium植物,原产美国、墨西哥、圭亚那和秘鲁。文心兰具圆锥花序,花黄色,花茎轻盈下垂,花朵奇异可爱,形似飞翔的金蝶,极富动感,是世界重要的盆花和切花种类之一[1-2]。文心兰的组织培养技术已比较成熟。通过外植体诱导类原球茎(protocorm-like bodies,PLBs)及丛生芽并快速增殖可获得大量幼苗[3]。文心兰无菌苗的根尖、叶表面、叶切口和茎的切口在离体培养时会生成透明状的组织块,然后长成黄白色的的愈合组织,或直接长出愈合组织,愈合组织发育成体胚,再形成圆球状的类原球茎,通过控制培养条件,在文心兰外植体伤口上可不经愈合组织而直接形成体胚[4-6]。文心兰‘南茜’Oncidium flexuosum‘Gower Ramsey’离体叶片在添加噻苯隆(thidiazuron,TDZ)的改良 1/2 MS(Murashige and Skoog)培养基上可诱导出直接体胚,这些体胚能形成类原球茎,进而发育成正常的植株[4,7]。培养基的成分和植物生长调节剂以及品种差异对文心兰离体叶片诱导体胚有很大影响[8-9],离体叶片的叶尖、叶面、叶背、叶缘和叶切口均能形成体胚,最易形成体胚的部位是叶尖[7],叶尖和叶切口的体胚诱导率分别达到57.5%和30.0%[10]。文心兰无论属内杂交还是属间杂交,其亲和力都较差、授粉结实机率低,通过杂交培育新品种难度大、周期长[11]。日渐成熟的转基因技术为兰花育种开辟了新途径。使用根癌农杆菌Agrobacterium tumetaciens介导的转化方法可将DOHI与DOMADSI的反义基因转入到兰花中[12],Liau等[13]尝试了以文心兰原球茎为受体利用根癌农杆菌介导转基因,但迄今未见通过转基因获得兰花新品种的成功报道。对根癌农杆菌介导转化成功的事例的统计结果表明,以叶片位外植体进行转化的成功率远高于其他外植体类型,同时体胚转基因成功的例子也日益增多[14-15]。文心兰离体叶片的切口能形成体胚并容易获得再生植株,可以作为根癌农杆菌转化的受体材料,因此,建立高效稳定的叶片体胚再生体系是兰花转基因育种的重要环节。本文报告了文心兰‘百万金币’Oncidium flexuosum‘Million Dollar’离体叶片叶位、叶片大小(叶龄)、不同植物生长调节物质组合处理对叶片切口体胚诱导的影响。
1 材料与方法
1.1 供试材料
文心兰‘百万金币’类原球茎(无菌组培材料)转入培养基[MS基本培养基添加磷酸二氢钠170.00 mg·L-1,吲哚丁酸(IBA)1.00 mg·L-1,谷胺酰胺 500.00 mg·L-1,活性碳 1 000.00 mg·L-1,蔗糖 30 000.00 mg·L-1,琼脂 7 000.00 mg·L-1],pH 5.5,培养温度为 24~26 ℃,光照时间 16 h·d-1,光照强度为1 200~1 600 lx。60 d换1次培养基,选取不同大小的幼苗叶片供实验用。
1.2 培养基与培养条件
体胚诱导培养的基本培养基为1/2 MS培养基[14](其中微量元素和有机添加物为全量,铁盐减半),其他添加物为磷酸二氢钠 170.00 mg·L-1,谷胺酰胺 1 000.00 mg·L-1,蛋白胨 1 000.00 mg·L-1,噻苯隆(TDZ)0.50 mg·L-1,聚乙烯聚吡咯烷酮(PVPP)250.00 mg·L-1,蔗糖 20 000.00 mg·L-1,固化剂(gelrite)2 800.00 mg·L-1,pH 5.2,121℃灭菌15 min。培养容器为直径90 mm培养皿,培养温度24~26℃,暗培养。
1.3 方法
1.3.1 叶片处理 根据实验要求选取幼苗,将叶片从基部剪下,再在叶片中间剪一长度约为2/3叶宽的口子,近轴面朝上置于培养基上,放入叶片8片·皿-1,暗培养60 d后统计长出体胚的叶片数和体胚发生部位。10个(10皿)重复·处理-1。
1.3.2 幼苗带根对体胚诱导的影响 分别选取15~35 mm长带根和无根幼苗,剪取10~30 mm长的叶片进行体胚诱导培养。
1.3.3 叶位对体胚诱导的影响 选取叶片长度为15~30 mm的带根幼苗,以近茎顶端的叶为第1叶,分别剪取第1叶和第2叶进行体胚诱导培养。
1.3.4 叶片长度对体胚诱导的影响 分别选取5~10,10~30,15~25,30~50,50~70 mm长的叶片分组进行体胚诱导培养。
1.3.5 植物生长调节剂对体胚诱导的影响 共设以下9个处理:噻苯隆(TDZ)(0.10,0.25,0.50,1.00,2.00 mg·L-1),6-苄氨基腺嘌呤(6-BA)(1.00,3.00 mg·L-1),细胞激动素(KT)(1.00,3.00 mg·L-1),选取 10~30 mm长的叶片进行体胚诱导培养。
1.3.6 数据处理 叶片体胚总诱导率=形成体胚(任何位置)的叶片数/接种叶片总数;叶片部位(叶基部切口、叶中切口、叶尖、叶面和叶缘)体胚诱导率=部位形成体胚的叶片数/接种叶片总数。数据结果统计分析采用SAS 9.13。
2 结果与分析
2.1 幼苗带根对诱导体胚的影响
从图1中数据可看出,无根苗的体胚总诱导率仅为25.36%,而有根苗则高达90.27%以上,无根苗叶尖、叶面、叶缘、叶基部切口、叶中切口的体胚诱导率分别为20.48%,0,0,4.71%和0.64%,带根健壮苗的相对应部位体胚诱导率分别为71.62%,36.82%,48.60%,74.56%和66.91%,2种类型的叶片体胚总诱导率在差异3.5倍以上(图1),可见,完整的健壮的带根幼苗是诱导体胚的适宜材料。带根幼苗叶基部切口和中切口体胚诱导率远高于无根幼苗叶片,这一点对于建立离体叶片体胚再生体系具有重要价值。
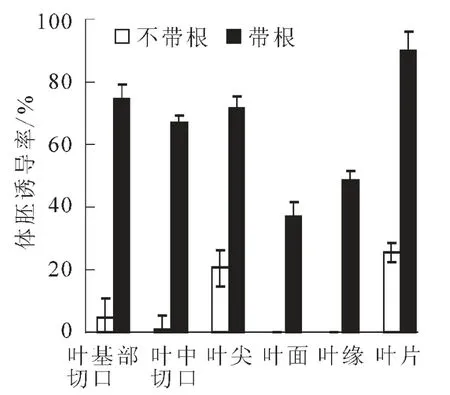
图1 不同植株类型叶片对文心兰体胚诱导的影响Figure 1 Effects of leaf of free-rooted breeding and breeding with root on somatic embryogenesis from Oncidium flexuosum‘Million Dollar’
2.2 叶位对体胚诱导的影响
本实验所选用的幼苗大多具2~4片叶,由于第3叶第4叶片偏小,不适宜本实验,所以仅选用第1叶第2叶。图2中的数据表明第1叶和第2叶体胚总诱导率基本接近,分别为64.24%和68.19%,叶片各部位产生的体胚比率差异也不大,叶尖、叶面、叶缘、叶基部切口、叶中口第1叶第2叶分别为41.83%,16.90%,16.90%,33.65%,32.41%和 43.04%,15.33%,12.87%,8.86%,36.07%,叶基部切口和叶中切口体胚诱导率也保持在较高水平(图2),其原因可能是在试管培养条件下,文心兰原球茎分化形成芽时,第1叶和第2叶形成的时间很接近,叶基的位置也相近,叶片大小相差不多,其生理特性也比较接近。
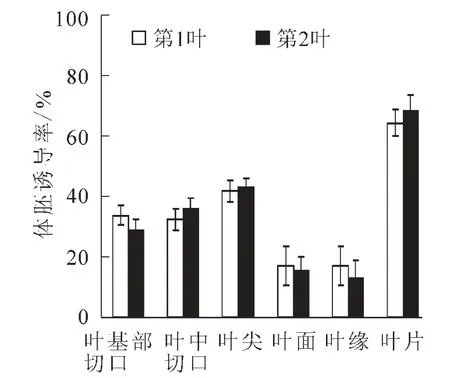
图2 不同叶片位置对文心兰体胚诱导的影响Figure 2 Effects of leaf position on somatic embryogenesis from Oncidium flexuosum‘Million Dollar’
2.3 叶片长度(叶龄)对体胚诱导的影响
文心兰试管苗中的幼叶处于最初的生长阶段,其叶片的长短,与生长时间呈正相关,可以认为,叶片的长短代表了叶龄。实验表明叶片长度对体胚诱导率有显著影响(图3),小于1 cm长的叶片体胚诱导率较低,其总诱导率仅为19.42%,体胚发生位置主要在叶尖和叶基切口,叶中切口、叶面和叶缘很少有体胚发生(低于1%)。随着叶片长度(叶龄)的逐渐增加,无论是叶尖、叶面和叶缘部位,还是切口部位体胚诱导率迅速增加。叶片长度10~30 mm时,体胚总诱导率迅速增加至61.00%,叶基切口、叶中切口、叶尖的体胚诱导率分别增加为33.29%,23.07%和44.83%。当叶片长度为15~25 mm时,呈现体胚诱导率的高峰,体胚总诱导率达84.20%,叶基切口体胚总诱导率达41.99%,叶中切口体胚诱导率达25.36%,叶尖体胚诱导率达60.51%。当叶片长度超过30 mm时,体胚诱导率迅速下降,叶片为30~50 mm时的体胚总诱导率仅为8.28%;而当叶片长度为50~70 mm时,叶片体胚诱导率仅为1.72%。实验结果表明,选择适宜的叶片长度(叶龄),对于维持较高的体胚诱导率至关重要,如果要从叶基部切口和叶中切口获得较多有效体胚,从20~25 mm长的带根幼苗剪取15~20 mm长的叶片是最适外植体。
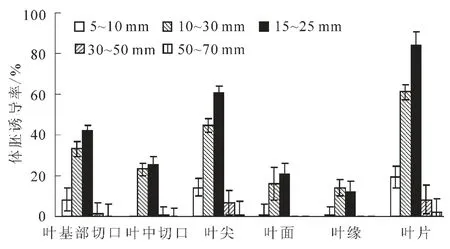
图3 不同叶片长度对文心兰体胚诱导的影响Figure 3 Effects of leaf length on somatic embryogenesis from Oncidium flexuosum‘Million Dollar’
2.4 植物生长调节物质对体胚诱导的影响
细胞激动素(KT)是影响文心兰叶片体胚诱导的关键因素[8,16],噻苯隆、6-BA和KT均具有强烈促进细胞分裂的作用,对文心兰幼叶体胚诱导具有强烈的促进效果(图4)。噻苯隆质量浓度为0.25 mg·L-1和0.50 mg·L-1,时,叶片的总诱导率分别为66.90%和65.96%,随着噻苯隆的质量浓度增加至1.00 mg·L-1或2.00 mg·L-1,体胚总诱导率开始下降,分别为58.09%和39.69%。6-BA质量浓度为 1.00 mg·L-1和3.00 mg·L-1时,文心兰叶片总诱导率均在40.00%以上,比添加噻苯隆的诱导效果要差。KT质量浓度为 1.00 mg·L-1和 3.00 mg·L-1时,文心兰叶片体胚总诱导率分别为 34.72%和 25.40%,约为添加噻苯隆处理的一半,比添加6-BA的效果要差。在大多数激素处理条件下,叶尖体胚发生的频率明显高于其他部位。噻苯隆质量浓度在0.25~1.00 mg·L-1范围时,叶尖体胚的诱导率达40.00%以上,叶基切口体胚诱导率为30.00%~45.00%,叶中切口体胚诱导率为13.00%~23.00%,叶片切口总诱导率超过了叶尖体胚诱导率。实验发现当噻苯隆质量浓度为0.50 mg·L-1时,叶片切口的总诱导率达68.75%,远超过叶尖体胚诱导率43.61%。而本实验的目标是尽可能多地从叶片基部切口和叶中切口诱导形成体胚,因此在培养基中添加0.50 mg·L-1噻苯隆是比较合适的选择。

图4 不同激素组合对文心兰叶片体胚诱导的影响Figure 4 Effects of plant growth regulators on somatic embryogenesis from Oncidium flexuosum‘Million Dollar’
3 讨论
Chen 等[5,6,9-10]和 Su 等[8]的报道和本研究的大量实验都表明,采用目前的培养体系,文心兰叶片的叶尖、叶面、叶缘、叶中切口和叶基部切口均能形成体胚,这些体胚能迅速增殖并形成原球茎,与其他外植体获得的原球茎没有差异,最终能成为正常植株。植物生长调节物质对于文心兰离体叶片体胚诱导起着重要作用。Chen等[16]使用生长素类(2,4-D,吲哚乙酸IAA,吲哚丁酸IBA,萘乙酸NAA)和细胞激动素类(异戊烯基腺嘌呤2iP,6-苄氨基腺嘌呤6-BA,细胞激动素KT,噻苯隆TDZ,玉米素ZT)诱导文心兰离体叶片形成体胚,发现生长素类不能诱导体胚发生,而细胞激动素类均能诱导体胚发生,其中噻苯隆和KT的质量浓度为3.00 mg·L-1时效果较好。在本实验中,噻苯隆诱导体胚的效果好于6-BA和KT,且最适质量浓度也较低,可能是由于供试文心兰品种的不同及对叶片长度(叶龄)限定的原因。离体叶片体胚发生率最高的部位是叶尖[7],这可能与叶尖细胞的生理特性有关。由于提高叶片切口有效体胚的诱导率对根癌农杆菌介导转基因具有重要意义,通过选择适宜的外植体材料、培养基配方、植物生长调节物质组合和质量浓度以及合适的培养条件,能较大幅度提高文心兰叶片切口体胚的诱导率,同时适度增加伤口的面积也是增加切口体胚诱导率的一个途径。本实验尝试在文心兰叶片上增加一个中切口,取得了较好的效果,中切口体胚诱导率可达20.00%以上,近次于叶尖和叶基部切口。但增加切口加重叶片的受伤程度,要控制在一定程度,否则反而会降低体胚诱导率。本实验所采用的叶片材料均来自文心兰类原球茎发育、芽分化、生长而形成的幼苗,供试幼苗带2~4片叶,第1叶和第2叶的叶柄位置紧靠着,叶芽的萌发时间相近,叶片尺寸差异不大,性状相似,诱导体胚的效果也非常接近。Chen 等[4]在 1/2 MS 培养基中添加噻苯隆 1.00 mg·L-1和 3.00 mg·L-1,文心兰南茜叶片长度为50~70 mm时,其体胚诱导率分别为10.00%~35.00%,而同样条件下20~40 mm长叶片体胚诱导率为分别为15.00%~25.00%,20~70 mm范围内叶片体胚诱导率变化不大。在相似的条件下,文心兰‘百万金币’叶片长度对体胚诱导率的影响非常大,15~25 mm长叶片体胚诱导率达80.00%,大于30 mm长的叶片体胚诱导率迅速下降至10.00%以下。除了培养基和培养条件等影响因素外,文心兰不同栽培品种和不同类型的生物学特性差异可能也是不同长度叶片(不同年龄)体胚诱导率较大差异的主要原因。就一般规律而言,文心兰离体叶片的特性和状态对体胚诱导率的影响是比较大的[8]。针对不同品种的文心兰,需要通过具体实验比较才能获得较高的体胚诱导率。
此外,文心兰叶片的褐化尤其是从叶片的切口处出现的褐化是严重影响体胚诱导率的关键因素之一。褐化通常是在叶片离体培养10 d左右在基部切口和叶片中切口边缘出现,颜色由淡褐色逐渐加深至深褐色或黑色,叶片一旦出现褐化,基本上无法诱导形成体胚。文心兰离体叶片培养过程中出现的褐化与文心兰组织培养中出现的褐化现象相类似[8],是由植物细胞中酚类化合物被氧化产生褐色的酚醌类化合物。本实验在培养基中添加250.00 mg·L-1PVPP,降低培养基中铁离子的浓度,对减少文心兰离体叶片的褐化率和减轻褐化程度有较好效果。
致谢:感谢中国林业科学研究院亚热带林业研究所欧阳彤副研究员提供文心兰‘百万金币’无菌试管苗实验材料。潘銮银、蒋晶、宋红改等对本文贡献相同,为并列第一作者。
[1]刘晓荣,王碧青,朱根发.文心兰研究进展[J].亚热带植物科学,2007,36(3):85-96.LIU Xiaorong,WANG Biqing,ZHU Genfa.Research advances of Oncidium[J].Subtrop Plant Sci,2007,36(3):85-96.
[2]孔海燕.世界花卉业发展现状[J].中国花卉园艺,2008(19):15-17.KONG Haiyan.The development status of world flowers[J].China Flower Horticult,2008(19):15-17.
[3]崔广荣,刘云兵,张俊长,等.文心兰组织培养的研究[J].园艺学报,2004,31(2):253-255.CUI Guangrong,LIU Yunbing,ZHANG Junchang,et al.Studies on tissue culture of Oncidium[J].Acta Horticult Sin,2004,31(2):253-255.
[4]CHEN J T,CHANG C,CHANG W C.Direct somatic embryogenesis on leaf explants of Oncidium‘Gower Ramsey’and subsequent plant regeneration[J].Plant Cell Rep,1999,19:143-149.
[5]CHEN J T,CHANG W C.Plant regeneration via embryo and shoot bud formation from flower-stalk explants of Oncidium sweet sugar[J].Plant Cell Tissue Organ Cult,2000,62:95-100.
[6]CHEN J T,CHANG W C.Efficient plant regeneration through somatic embryogenesis from callus cultures of Oncidium(Orchidaceae)[J].Plant Sci,2000,160:87-93.
[7]CHEN J T,CHANG W C.Effects of tissue culture conditions and explant characteristics on direct somatic embryogenesis in Oncidium‘Gower Ramsey’[J].Plant Cell,2002,69:41-44.
[8]SU Y J,CHEN J T,CHANG W C.Efficient and repetitive production of leaf-derived somatic embryos of Oncidium[J].Biologia Plantarum,2006,50(1):107-110.
[9]CHEN JT,CHANG W C.Direct somatic embryogenesis and plant regeneration from leaf explants of Phalaenopsis amabilis[J].Biologia Plantarum,2006,50(2):169-173.
[10]CHEN J T,CHANG W C.TIBA affects the induction of direct somatic embryogenesis from leaf explants of Oncidium[J].Plant Cell Tissue Organ Cult,2004,79:315-320.
[11]邱金香.文心兰杂交授粉时机及果荚培育[J].台湾花卉园艺,2002(4):44-48.QIU Jinxiang.Cross pollinating time and fruit pods breeding of Oncidium[J].Taiwan Flower Ind,2002(4):44-48.
[12]YU H,GOH C J.Identification of three orchid MADS-box genes of the AP1/AGL9 subfamily during foral translation[J].Plant Physiolog,2000,23:1325-1336.
[13]LIAU C H,YOU S J,PRASAD V,et al.Agrobacterium tumefaciens-mediated transformation of an Oncidium orchid[J].Plant Cell Rep,2003,21(10):993-998.
[14]贾士荣,曹东孙.转基因植物[J].植物学通报,1992,9(2):3-15.JIA Shirong,CAO Dongsun.Transgenic plants[J].Chin Bull Bot,1962,9(2):3-15.
[15]MURASHIGE T,SKOOG F.A revised medium for rapid growth and bioassays with tobacco tissue cultures[J].Physiol Plant,1962,15:495-497.
[16]CHEN J T,CHANG W C.Effects of auxins and cytokininson direct somatic embryogenesis from leaf explants of Oncidium‘Gower Ramsey’[J].Plant Growth Regul,2001,34:229-232.

