钝化NF-κB的活化对酒精性肝损伤大鼠CYP3A的影响
康晓琳,薛永志,许秀举,刘和莉
长期过量饮酒导致的酒精及其代谢产物对肝脏的毒性作用、氧化应激、脂质过氧化、细胞因子和免疫反应等多种因素有关的肝细胞损伤,已经成为继病毒性肝炎后导致肝损害的第二大病因[1]。CYP3A是CYP450氧化代谢酶超家族中含量最多的亚型,参与该酶系中50%以上外源性药物、毒物或致癌物等氧化代谢[2-3],但在酒精性肝损伤过程中是否参与其中,不同实验室得出截然不同的结果,并且其确切机制尚未明确[4-5]。NF-κB 在炎症及免疫反应中被高度诱导,并且对氧化应激敏感,在肝脏炎症、纤维化及肝细胞再生、脂质过氧化等病理生理过程中起着重要作用[6-7]。Wahl等[8]发现柳氮磺胺吡啶(salazosulfapyridine,SASP)可以通过抑制 IκB的磷酸化从而发挥抑制NF-κB的作用,因此可以阻止NF-κB向核内移位,减少下游细胞因子的表达。本研究以白酒灌胃法制备大鼠酒精性肝损伤模型[9],观察 CYP3A 的代谢活性、NF-κB 蛋白表达有何变化,采用SASP抑制NF-κB,观察对CYP3A氧化代谢活力和肝功能的影响,深入探讨NF-κB在酒精性肝损伤中的作用及其作用环节,为酒精性肝脏疾病药物治疗提供新的靶点和思路。
1 材料与方法
1.1 实验动物和主要试剂 清洁级♂Wistar大鼠48只,体质量(200±20)g,动物许可证号:SCXK(蒙)2002-0001,购自内蒙古大学实验动物中心。柳氮磺胺吡啶(salazosulfapyridine,SASP),上海信谊嘉华药业有限公司,批号:H31020557;56度红星二锅头由北京红星股份有限公司生产;咪哒唑仑(midazolam,MDZ)注射剂,徐州恩华集团药业有限责任公司生产,10 mg/2 ml/支,批号:20080604;兔抗大鼠NF-κB p65多克隆抗体,即用型SABC免疫组化试剂盒,DAB显色剂均购于武汉博士德生物工程有限公司;其它药品均为分析纯。
1.2 主要仪器 高效液相色谱仪,Thermo Finnigon公司生产;RH-200智能热板仪,成都泰盟科技有限公司生产;sartorius分析天平,北京塞多利斯仪器有限公司;CX41RF奥林帕斯显微镜;形态分析系统,江苏省捷达科技发展有限公司。
1.3 动物分组及建模方法 Wistar大鼠48只,经1周的喂养适应后,随机分为3组,第1组(Control,n=16)经灌胃给予NS 2 ml/次,1天2次,至20 d;第2组(Ethanol,n=16)给予56度红星二锅头,10 mg·kg-1,1天 2次灌胃,至 20 d;第 3组(Ethanol+SASP,n=16)将 SASP(0.75 mg·kg-1)溶于白酒(10 mg·kg-1)中,1 天2 次灌胃,至20 d 末,于当晚禁食,d 21先将所有大鼠称重,再将3组大鼠每组中的8只经腹腔注射给予CYP3A探针MDZ(10 mg·kg-1),并于给药后15、30、45、60、120 min 各时间点经眼内眦静脉丛采血0.5ml,置肝素化试管中,3 500 r·min-110 min,分离血浆,置 -20℃冰箱冷冻,按文献[10]采用HPLC法进行咪哒唑仑血药浓度经时变化的测定。再断尾取血4 ml,3 500 r·min-1离心10 min,抽取血清2 ml,置 -20℃冰箱冷冻,待测血清中ALT、AST水平。另外每组其余8只大鼠经腹腔注射给予CYP3A的探针药物MDZ(0.5 mg·kg-1),并于给药40 min后,将大鼠置于50℃热板上,同时计时,记录大鼠第1次舔后足的时间,作为反应时间,并记录大鼠5 min内舔后足的次数。随后将大鼠颈椎脱臼处死,迅速剖取肝脏,称重,将肝组织浸泡于事先配好的甲醛酒精(甲醛 ∶酒精=1∶9)固定液中,做石蜡包埋切片,常规HE染色及免疫组织化学测定。
1.4 肝组织NF-κB免疫组化染色 肝组织石蜡切片NF-κB免疫组化染色方法按试剂盒说明书进行,一抗稀释倍数为1∶100。每张切片选择染色良好区域,随机观察10个高倍视野。NF-κBp65以细胞染成棕黄色为阳性,采用形态分析系统统计每个视野中阳性细胞数、灰度、平均吸光度(average absorbance,AA)和积分吸光度 (integrated absorbance,IA)。细胞阳性率以每高倍镜下阳性细胞数(细胞数/高倍镜视野)来表示。
2 结果
2.1 各组大鼠的一般状态及肝脏病理学、生化指标的改变 经过20 d酒精刺激,Ethanol组大鼠表现为体重增加量明显减少(P<0.01),肝重系数增大(P<0.01);而Ethanol+SASP组大鼠体重增加量是Ethanol组的1.2倍,肝重系数大于Control组,小于比Ethanol组。光镜下可见,Ethanol组肝小叶界限不清,肝细胞出现空泡变性,同时散在淋巴细胞及单核细胞。Ethanol+SASP组肝小叶结构清晰,但肝窦轻度狭窄。肝细胞内无明显空泡及疏松,部分肝细胞呈轻度浊肿。Ethanol组大鼠血清AST、ALT均较对照组升高,以ALT升高为明显。Ethanol+SASP组血清ALT和AST较Ethanol组有所降低(Tab 1)。
Tab 1 Rat body weight gain,liver weight/body weight,serum ALT and AST levels in all groups(±s,n=8)
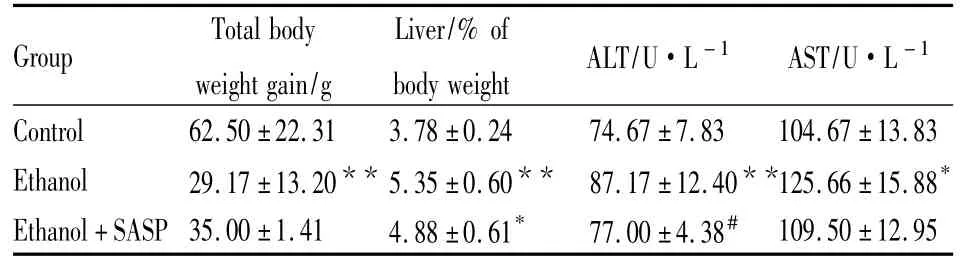
Tab 1 Rat body weight gain,liver weight/body weight,serum ALT and AST levels in all groups(±s,n=8)
*P<0.05,**P<0.01 vs control;#P<0.05 vs ethanol
Group Total body weight gain/g Liver/%of body weight ALT/U·L-1 AST/U·L -1 Control 62.50 ±22.31 3.78 ±0.24 74.67 ±7.83 104.67 ±13.83 Ethanol 29.17±13.20** 5.35±0.60** 87.17±12.40**125.66 ±15.88*Ethanol+SASP 35.00 ±1.41 4.88 ±0.61* 77.00 ±4.38#109.50 ±12.95

Fig 1 Pathological features in liver(HE×400)A:Control group;B:Ethanol group;C:Ethanol+SASP group
2.2 各组大鼠CYP3A代谢活力的变化 3组大鼠经腹腔给予经CYP3A代谢的探针药物咪哒唑仑(10 mg·kg-1),经HPLC测得大鼠血浆中咪哒唑仑血药浓度的经时变化如Tab 2、3所示,Ethanol组在给药后各时间点血浆中咪哒唑仑血药浓度均明显低于Control组(P <0.01),、AUC 、Cmax均减小(P <0.01),Ethanol+SASP 组抑制 NF-κB 后,血浆中咪哒唑仑血药浓度明显高于Ethanol组(P<0.05),AUC、Cmax明显增大(P<0.01)。从Tab 4可以看出Ethanol组与Control组相比,在给予咪哒唑仑40 min后,大鼠的反应时间明显缩短(P<0.01),5 min内舔足次数也明显增多(P<0.01),而Ethanol+SASP组大鼠反应时间与Ethanol组相比有明显延长(P<0.05),而舔足次数明显减少(P<0.01)。
2.3 各组大鼠NF-κB变化 光镜下,大鼠肝组织NF-κBp65的阳性细胞呈明显的棕黄色或深棕色,分布于细胞质和细胞核,表达强度不一,以中央静脉周围表达多(Fig 2)。与Control组相比,Ethanol组肝细胞的NF-κBp65细胞阳性率明显增高(P<0.01),灰度明显降低(P<0.01),AA降低(P<0.01),IA增高(P<0.01)。而Ethanol+SASP组与Ethanol组相比大鼠肝组织中的NF-κBp65细胞阳性率降低(P<0.01),灰度明显回升(P<0.01),IA值明显减小(P<0.01),而AA值差异未见显著性,见Tab 5。
3 讨论
白酒灌胃20 d成功复制了大鼠急性酒精性肝损伤模型,表现为大鼠肝重增加,功能受损,肝细胞出现轻度脂肪样变。白酒灌胃法与酒精灌胃法相比更与人类的酒精性肝损伤接近,并有大量文献支持[11]。目前,关于酒精性肝损伤过程中CYP3A代谢活力是否增强不同实验室得出不同的结果,有报道[4],中度酒精性肝损伤CYP3A活力无变化,但是减少咪哒唑仑口服生物利用度,可能是肠内CYP3A诱导的结果。还有报道[5],中度酒精性肝损伤与CYP3A活力密切相关,明显增加其代谢活力,但CYP3A上调机制尚未明确,可能与核受体转录因子的调节有关。研究认为[12],当血液和肝组织乙醇浓度较低时,大部分乙醇由乙醇脱氢酶氧化代谢,但大量饮酒而使肝组织乙醇浓度超过0.01 mol·L-1时,细胞色素P450混合功能氧化酶系统被激活。本研究结果表明,酒精损伤可导致CYP3A代谢能力增强,肝脏NF-κB的蛋白表达明显增加。本研究结果与文献[5,11]报道一致。
Tab 2 Plasma MDZ levels in all groups( ± s,n=8)

Tab 2 Plasma MDZ levels in all groups( ± s,n=8)
**P<0.01 vs control;#P<0.05 vs ethanol
Time/min 15 30 45 60 120 Control/mg·L -1 4.14 ±0.70 2.58 ±0.46 1.49 ±0.11 1.17 ±0.17 0.39 ±0.15 Ethanol/mg·L-1 1.92 ±0.19** 0.68 ±0.13** 0.39 ±0.23** 0.25 ±0.07** 0.01 ±0.02**Ethanol+SASP/mg·L-1 2.91 ±0.18# 1.54 ±0.41# 0.78 ±0.16# 0.47 ±0.11# 0.19 ±0.09#
Tab 3 Plasma MDZ pharmacokinetic Levels in all groups(±s,n=8)
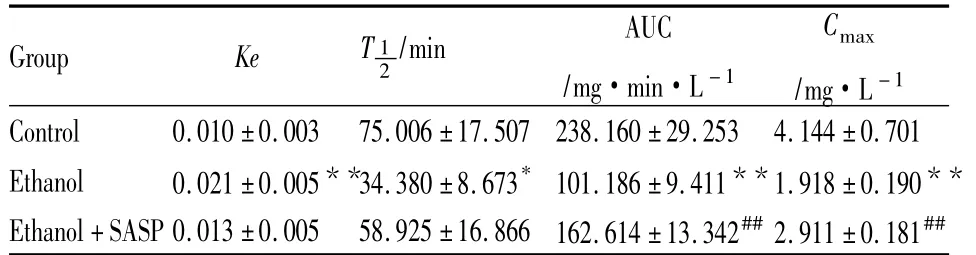
Tab 3 Plasma MDZ pharmacokinetic Levels in all groups(±s,n=8)
*P<0.05,**P<0.01 vs control;##P<0.01 vs ethanol
T 1/min AUCCmax Group Ke 2/mg·min·L -1/mg·L -1 Control 0.010 ±0.003 75.006 ±17.507 238.160 ±29.253 4.144 ±0.701 Ethanol 0.021 ±0.005**34.380±8.673*101.186±9.411**1.918±0.190**Ethanol+SASP 0.013 ±0.005 58.925 ±16.866 162.614 ±13.342##2.911 ±0.181##
Tab 4Sedation of MDZ in all groups(±s,n=8)
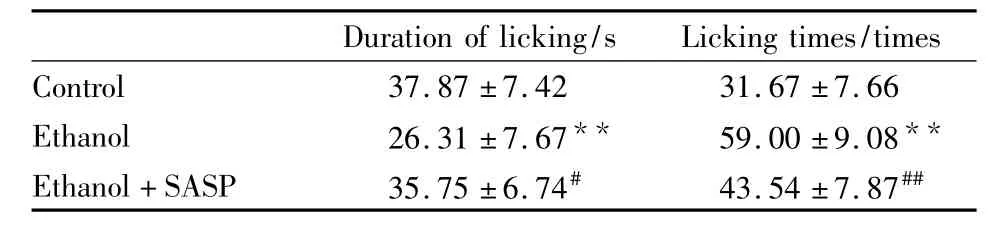
Tab 4Sedation of MDZ in all groups(±s,n=8)
**P<0.01 vs control;#P<0.05,##P<0.01 vs ethanol
Duration of licking/s Licking times/times Control 37.87 ±7.42 31.67 ±7.66 Ethanol 26.31 ±7.67** 59.00 ±9.08**Ethanol+SASP 35.75 ±6.74# 43.54 ±7.87##

Fig 2 Immunohistochemistry of NF-κB p65 expression in rat liver(SP×400)A:Control group;B:Ethanol group;C:Ethanol+SASP group
Tab 5 Number of NF-κB p65 positive cells/high-power field in all groups(±s,n=4)
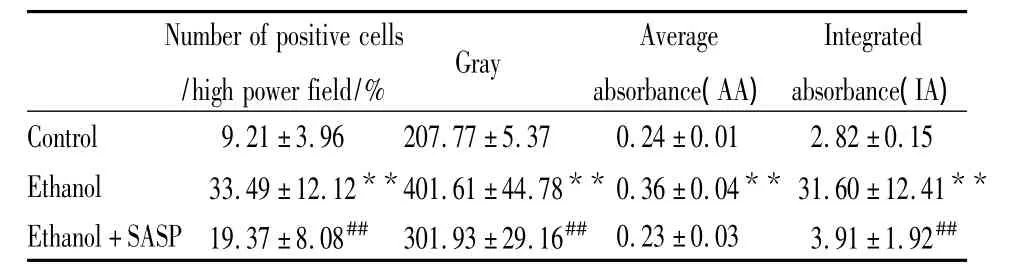
Tab 5 Number of NF-κB p65 positive cells/high-power field in all groups(±s,n=4)
**P<0.01 vs control;##P<0.01 vs ethanol
Number of positive cells/high power field/% Gray Average absorbance(AA)Integrated absorbance(IA)Control 9.21 ±3.96 207.77 ±5.37 0.24 ±0.01 2.82 ±0.15 Ethanol 33.49±12.12**401.61±44.78** 0.36±0.04** 31.60 ±12.41**Ethanol+SASP 19.37±8.08## 301.93±29.16## 0.23±0.03 3.91 ±1.92##
应用SASP钝化NF-κB的活化,大鼠肝脏NF-κB的蛋白表达减少,CYP3A的代谢活力下调,同时肝脏脂肪变性程度减轻,且血清AST、ALT含量明显下降。酒精肝损伤后,能使肠粘膜屏障受损,肠道通透性增加,并且肝脏巨噬细胞的吞噬能力下降,致使机体内毒素如脂多糖(LPS)等的水平上升,导致内毒素血症。内毒素可以通过结合枯否细胞上CD14受体来激活NF-κB,活性氧(ROS)可能是所有刺激物激活NF-κB共同机制和LPS诱导细胞信号系统的核心,ROS增殖能减少巯基来增加细胞被氧化比例,调节NF-κB激活,NF-κB可以增加氧化信号通路的敏感性,导致基因产物的增多[13-14]。抑制NF-κB的活化对酒精性肝损伤具有一定保护作用,一方面是由于在NF-κB的活化受到抑制后,其调控的下游炎性细胞因子转录减少,从而减轻肝脏的炎症损伤;另一方面,抑制NF-κB可以扭转CYP3A代谢活力的上调,减少活性氧族的产生,减少肝细胞的脂质过氧化,同时减少了ROS作为第二信使对NF-κB的活化,形成一种良性循环。有关酒精性肝损伤过程中CYP3A代谢活力的调控是否经由NF-κB转录调控,可否通过转录调控代谢酶活力干预损伤过程有待进一步深入研究。
[1]Bruha R,Dvorak K,Dousa M,et al.Alcoholic liver disease[J].Praque Med Rep,2009,110(3):181 -90.
[2]邵敬伟,董海燕,王 涛,郭养浩.中药莪术激活PXR及对大鼠肝细胞色素 P450 3A的影响[J].中国药理学通报,2008,24(4):504-9.
[2]Shao J W,Dong H Y,Wang T,Guo Y H.Traditionla Chinese medicine Rhizoma curcumae activates PXR and affects cytochrome P450 3A in the rat liver[J].Chin Pharmacol Bull,2008,24(4):504 -9.
[3]谷 元,司端运,刘昌孝.CYP3A4酶介导的人类药物代谢性别差异[J].中国药理学通报,2009,25(9):1121 -4.
[3]Gu Y,Si D Y,Liu C X.Gender related differences of cytochrome P450 3A4 activ ity[J].Chin Pharmacol Bull,2009,25(9):1121-4.
[4]Liangpunsakul S,Kolwankar D,Pinto A,et al.Activity of CYP2E1 and CYP3A enzymes in adults with moderate alcohol consumption:a comparison with nonalcoholics[J].Hepatology,2005,41(5):1144-50.
[5]He P,Court M H,Greenblatt D J,Von Moltke L L.Factors influencing midazolam hydroxylation activity in human liver microsomes[J].Drug Metab Dispos,2006,34(7):1198 - 207.
[6]王 华,吕金伟,张 程,等.二硫代氨基甲酸吡咯烷对小鼠急性凋亡性肝损伤的效应[J].中国药理学通报,2009,25(12):1610-4.
[6]Wang H,Lu J W,Zhang C,et al.Effects of pyrrolidine dithiocarbamate on acute apoptotic liver injury in mice[J].Chin Pharmacol Bull,2009,25(12):1610 -4.
[7]卢中秋,梁 欢,李萌芳,等.创伤弧菌脓毒症大鼠肝组织核转录因子-κB活性表达及抗菌药物的影响[J].中国急救医学,2007,27(12):1090 -3.
[7]Lu Z Q,Liang H,Li M F,et al.The activity of NF-κB in liver in Vibrio vulnificus septic rats and the intervention effects of antibacterialagents[J].Chin J Crit Care Med,2007,27(12):1090 - 3.
[8]Wahl C,Liptay S,Adler G,et al.Sulfasalazine:a potent and specific inhibitor of nuclear factor Kappa B[J].J Clin Invest,1998,101(5):1163-74.
[9]王喜军,刘 莲,孙 晖,等.乙醇诱导大鼠肝损伤的代谢组学和茵陈蒿汤的干预研究[J].中国药理学通报,2008,24(4):452-7.
[9]Wang X J,Liu L,Sun H,et al.Studies on the metabonomics of rat liver injury by ethanol and interfering effects of Yin Chen Hao Tang[J].Chin Pharmacol Bull,2008,24(4):452 -7.
[10]Liu Y,Jiao J J,Zhang C L,et al.A Simplified method to determine five cytochrome P450 probe drugs by HPLC in a single run[J].Biol Pharm Bull,2009,32(4):717 -20.
[11]黄娟娟,李 兵,曹力波,等.酒精对HBV转基因小鼠肝脏的损伤作用及其机制[J].中国药理学通报,2010,26(3):372-6.
[11]Huang J J,Li B,Cao L B,et al.The effect and mechanism of alcohol on liver injury in hepatitis B virus transgenic mice[J].Chin Pharmacol Bull,2010,26(3):372 -6.
[12]何 岚,彭 军.线粒体醛脱氢酶对心脏保护作用的研究进展[J].中国药理学通报,2009,25(12):1548 -51.
[12]He L,Peng J.Progress of mitochondrial aldehyde dehydrogenase in cardioprotection[J].Chin Pharmacol Bull,2009,25(12):1548 -51.
[13]Zhou Z X,Wang L P,Song Z Y,et al.Abrogation of nuclear factorκB activation is involved in zinc inhibition of lipopolysaccharideinduced tumor necrosis factor-α production and liver injury[J].Am J Pathol,2004,164(5):1547 -56.
[14]许洁琼,朱永平.抗成瘾药物研究的最新进展[J].中国药理学通报,2010,26(3):281 -5.
[14]Xu J Q,Zhu Y P.Recent research progress on anti-addiction drugs[J].Chin Pharmacol Bull,2010,26(3):281 -5.

