氧化葡萄糖酸杆菌立体选择催化2-甲基-1,3-丙二醇合成(R)-β-羟基异丁酸*
氧化葡萄糖酸杆菌立体选择催化2-甲基-1,3-丙二醇合成(R)-β-羟基异丁酸*
魏国栋,魏东芝,林金萍
(华东理工大学,鲁华生物技术研究所,生物反应器国家重点实验室,上海,200237)
β-羟基异丁酸是一种重要的化工医药产品,主要用于合成降压药卡托普利和其它的光学活性物质。试验利用氧化葡萄糖酸杆菌不对称氧化2-甲基-1,3-丙二醇合成了光学纯的(R)-β-羟基异丁酸,研究表明:在28℃和pH值5.5、底物浓度5 g/L、湿细胞浓度20 g/L的情况下,经过10 h的反应,(R)-β-羟基异丁酸的浓度达到20.5 g/L,转化率和光学纯度分别达到88.6%和95.3%。在培养基中添加一定量(0.1%)的1,2-丙二醇和乙二醇对菌体生长、立体选择性和催化活性都有一定的促进作用。通过流加2-甲基-1,3-丙二醇使其在反应体系中的浓度维持在5 g/L以下,以消除过高的底物浓度对细胞活性的抑制,在3.7 L反应器中经过24 h的反应,(R)-β-羟基异丁酸的浓度提高到50.2 g/L,摩尔转化率和光学纯度分别达到90.5%和93.2%。
氧化葡萄糖酸杆菌,生物转化,2-甲基-1,3-丙二醇,(R)-β-羟基异丁酸
氧化葡萄糖酸杆菌(Gluconobacter oxydans)是一种专性好氧的革兰氏阴性菌,属于醋酸杆菌科,以能够不完全氧化很多糖醇类化合物而著称,而其大多数参与反应的酶位于细胞膜上,催化反应生成的相应产物(醛、酮以及有机酸等)几乎能够全部分泌到培养基中,催化反应过程无需通过透膜运输,大大提高了其应用价值,相关研究和应用越来越受到研究人员的重视[1-6]。
光学活性β-羟基异丁酸,是具有不对称碳原子的双功能性物质,作为有机合成的基础材料,广泛用于合成多种生理活性物质,其合成方法一直是人们研究的热点。单一构型的R型β-羟基异丁酸可以作为有机合成的手性砌块参与其它重要手性分子的合成。目前,R型β-羟基酸的制备一般采用化学拆分的方法,存在副产物如S型β-羟基酸多,后续分离困难的缺陷,不能满足有关领域的需要,而生物转化法具有良好的区域选择性和立体选择性。目前已有利用Gluconobacter roseus IAM 1841,Acetobacter sp.和Acetobacter pasteurianus DSM 8937不对称氧化2-甲基-1,3-丙二醇生成(R)-β-羟基异丁酸的研究,但是β-羟基异丁酸的得率都比较低。目前,利用微生物氧化2-甲基-1,3-丙二醇生成(R)-β-羟基异丁酸的研究中,最高的产物浓度也只有 29 g/L[7-10],因此有必要进一步提高转化产物的浓度。本文主要以氧化葡萄糖酸杆菌静息细胞为生物催化剂,利用其立体选择性和区域选择性的不完全氧化功能,催化2-甲基-1,3-丙二醇生成光学纯(R)-β-羟基异丁酸,确定了转化产物的组成,并对全细胞催化过程进行研究。
1 材料与方法
1.1 实验菌株
氧化葡萄糖杆菌DSM 2003(Gluconobacter oxydans DSM 2003),由华东理工大学生物反应器国家重点实验室保藏。
1.2 仪器与试剂
恒温摇床,上海欣鑫自动化设备有限公司;3.7 L发酵罐,瑞士比欧生物工程公司;高效液相色谱,美国安捷伦1100 series。
2-甲基-1,3-丙二醇和β-羟基异丁酸甲酯购自西格玛奥德里奇公司,其余试剂为市售分析纯。
1.3 菌体培养
1.3.1 菌体摇瓶培养
发酵培养基配方:山梨醇73.0 g/L,酵母粉18.4 g/L,(NH4)2SO41.5 g/L,KH2PO41.52 g/L,MgSO4·7H2O 0.47 g/L。接种后置于摇床内在28℃,250 r/min下恒温振荡培养。
1.3.2 菌体发酵罐培养
在3.7L发酵罐中配制2 L培养基。发酵期间主要控制参数如下:(1)溶氧。通气量控制在300 L/h,发酵罐罐压控制在0.3~0.6×105Pa,最低搅拌转速控制在400 r/min,当发酵罐溶氧降至30%以下时,提高转速以增加溶氧,最高转速为1 000 r/min。(2)pH值。自动流加2 mol/L的NaOH溶液,保持pH值在6.0左右。(3)温度。培养过程中温度保持在28℃。
1.4 2-甲基-1,3-丙二醇转化反应
1.4.1 摇瓶转化
用0.1 mol/L的磷酸盐缓冲液配成一定菌体浓度的菌悬液,加入一定量的底物2-甲基-1,3-丙二醇,反应体系为10 mL,置于50 mL的三角烧瓶中,于28℃、250 r/min下反应。摇瓶转化实验均做3个平行样,取实验数据平均值。
1.4.2 3.7 L发酵罐转化
通过调节转速、罐压和通气速率来控制溶氧在30%以上。间隔0.5~1 h取样用气相色谱分析底物浓度,随时调整底物流加速度,使反应器内的底物浓度控制在5 g/L左右。
1.5 产物的分离纯化
转化液经离心除去菌体,真空旋转蒸发浓缩。经半制备色谱分离纯化得到目标产物。
1.6 分析方法
1.6.1 2-甲基-1,3-丙二醇测定方法的确定
具体色谱条件为:气相色谱(Agilent 6890),DBWAX毛细管柱,进样口温度为250℃,检测器的温度为280℃。升温程序为:100℃保持2 min,然后以20℃/min升温至180℃,保持1 min,再以30℃/min升温至220℃,保持5 min。
1.6.2 β-羟基异丁酸测定方法的确定
液相色谱条件:高效液相色谱(Agilent 1100 series),ZORBAX SB-Aq 柱,柱温30℃,进样 5 μL,流动相为0.1%的稀磷酸溶液,流速1 mL/min,紫外210 nm波长下检测。进样前,样品经过0.22 μm滤膜过滤。
1.6.3 β-羟基异丁酸对映体过量值测定条件的确定
(R,S)-β-羟基异丁酸甲酯标品用HP-chiral 20B手性柱在Agilent 6890气相色谱仪上进行分析。样品预处理:1 mL转化液加入2 mL甲醇(含3%H2SO4),在密闭的条件下于80℃反应3 h,生成甲酯后加入2 mL CHCl3萃取,然后用气相色谱进行分析。
色谱条件:气相色谱(Agilent 6890),HP-chiral 20B毛细管柱,进样口温度为120℃,检测器的温度为180℃,流速为0.7 mL。升温程序为:80℃保持0.2 min,然后以2.5℃/min升温至85℃,保持0.5 min。然后以1.5℃/min升温至95℃,保持0.5 min。再以1℃/min升温至105℃,保持10 min。
2 结果与讨论
2.1 氧化葡萄糖酸杆菌静息细胞催化2-甲基-1,3-丙二醇的产物生成情况分析
将氧化葡萄糖酸杆菌静息细胞催化2-甲基-1,3-丙二醇的转化液进行HPLC分析,出现3个产物峰(图1)。为了弄清反应过程,优化反应条件,有必要对这3个产物进行鉴定。
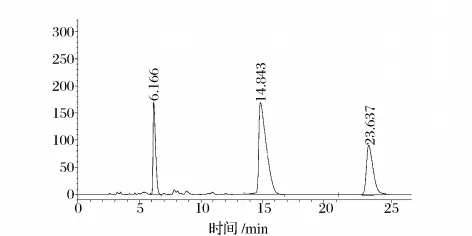
图1 G.oxydans不对称氧化2-甲基-1,3-丙二醇生成(R)-β-羟基异丁酸
首先对反应产物进行分离纯化。反应液经离心除去菌体,低温下真空旋转蒸发浓缩。用半制备色谱(Waters)进行分离纯化,色谱柱为Atlantis prep dC18OBD(Waters,5 μm,Φ19 mm ×100 mm),流动相为0.1%的磷酸溶液,流速为10 mL/min,上样量为1 mL,分别收集3个组分。将3个组分分别于低温下真空旋转蒸发浓缩,然后用半制备色谱分别进行2次纯化,流动相为5%的甲醇溶液。
产物的鉴定。先将2次纯化之后收集到的组分直接用GC-MS检测,第1组分和第3组分未能检测到结果,而第2组分经检测为2-甲基丙烯醛,结果如图2。
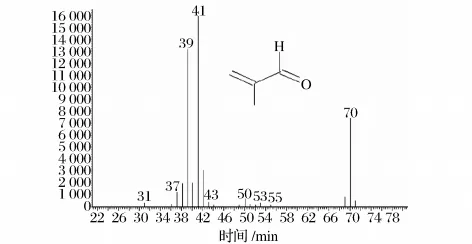
图2 第2组分的气质联用图谱
通过对2-甲基-1,3-丙二醇转化过程推断分析,第1和第3组分很有可能是有机酸,所以先对产物进行衍生化,然后用气质联用进行分析。根据图3和图4可知,第1组分是目标产物β-羟基异丁酸,第3组分是2-甲基丙烯酸。2个副产物2-甲基丙烯醛和2-甲基丙烯酸可能的形成途径是:底物2-甲基-1,3-丙二醇在氧化葡萄糖酸杆菌乙醇脱氢酶的作用下首先生成中间产物β-羟基异丁醛,而β-羟基异丁醛在氧化葡萄糖酸杆菌细胞其它酶的作用下发生脱水反应而形成2-甲基丙烯醛,继续氧化后生成2-甲基丙烯酸。副产物形成的确切途径有待于进一步研究。

图3 第1组分衍生物的气质联用图谱

图4 第3组分衍生物的气质联用图谱
2.2 静息细胞转化2-甲基-1,3-丙二醇生成(R)-β-羟基异丁酸的反应过程
2.2.1 底物浓度对产物生成和选择性的影响
由图5可知,氧化葡萄糖酸杆菌转化2-甲基-1,3-丙二醇的效率和选择性对底物浓度有依赖性。在底物浓度较低时,随着初始底物浓度的增加,反应效率也随之升高,在底物浓度为30 g/L时产物浓度达到最高。随着底物浓度的进一步提高,由于底物对细胞的活性产生明显地抑制,催化效率开始出现下降。产物的对映体选择性(e.e.)随着底物浓度的增加而降低。综合转化效率和产物光学纯度考虑,确定反应体系中的底物浓度为5 g/L。
2.2.2 细胞浓度对反应的影响
反应体系中的菌体量会直接影响参与反应的酶量,进而影响其转化的反应速度以及最终的转化效果。由图6可知,细胞浓度对产物的光学纯度没有太大影响。转化效率随着细胞浓度的增加而逐渐提高。当细胞浓度超过20 g/L时,随着细胞浓度的进一步提高,转化效率基本不再变化。因此,从高效利用菌体的角度出发,确定氧化葡萄糖酸杆菌全细胞转化体系中的细胞浓度为20 g/L。

图5 底物浓度对转化效率和选择性的影响

图6 细胞浓度对转化效率和选择性的影响
2.2.3 pH值对2-甲基-1,3-丙二醇转化反应的影响
由于酶的构型与其离子化状态有关,因此通过改变pH值可以改变酶反应的选择性。由图7可知,反应体系的pH值为5.5时,转化效率和产物的光学纯度达到最高,由此确定反应的最适pH值为5.5。

图7 pH对转化效率和选择性的影响
2.2.4 温度对2-甲基-1,3-丙二醇转化的影响
不同的温度下,菌体酶的活性不同,反应速率会有所变化,立体选择性也会有所不同。在合适的温度下,酶系能表现最大的活性。由图8中可知,当温度小于28℃时,随着温度的升高,活化分子增加,酶催化活性提高,转化速率也在提高;而当温度大于28℃时,随着温度升高转化速率开始下降,且产物光学纯度也略有下降,因此选择该转化反应最适温度为28℃。

图8 温度对转化效率和选择性的影响
2.2.5 在培养基中添加诱导物对菌体生长和细胞催化活性的影响
为了研究菌体培养阶段添加醇类物质对菌体转化能力的影响,实验中选取了乙醇、乙二醇、1-丙醇、1,2-丙二醇、1,3-丙二醇、甘油、1-丁醇、1,3-丁二醇、2,3-丁二醇和 2-甲基-1,3-丙二醇等化合物,于接种前添加在培养基中,添加浓度分别为0.1%。培养结束后,收集菌体,然后取相同量菌体进行转化反应,底物浓度为5 g/L,转化1 h后,用HPLC测定转化液中的β-羟基异丁酸浓度。将转化液衍生化后用GC测定β-羟基异丁酸的光学纯度。结果如表1所示,在培养基中添加不同诱导物,对菌体转化活性产生不同程度的影响,对选择性的影响不大。在培养基中添加0.1%的1,2-丙二醇和乙二醇,菌体转化活性均有较大提高,但乙二醇对菌体的生长有一定的抑制作用;在培养基中添加0.1%的2-甲基-1,3-丙二醇、甘油和2,3-丁二醇,菌体转化活性也有一定幅度提高。
在最优摇瓶转化条件下,经过10 h的反应,(R)-β-羟基异丁酸的浓度达到20.5 g/L,转化率和光学纯度分别达到88.6%和95.3%。
2.3 在3.7 L生物反应器中转化2-甲基-1,3-丙二醇
采用上述最适条件,在3.7 L反应器中进行氧化葡萄糖酸杆菌细胞转化2-甲基-1,3-丙二醇的反应。为了消除底物对细胞活性的抑制,采取流加策略维持反应体系中的底物浓度不超过5 g/L,结果如图9所示。在反应开始后10 h内,反应非常迅速。随着反应的进行,产物积累到30 g/L时,产物抑制效应逐渐显现,反应速率下降。当反应进行到2 4 h时,(R)-β-羟基异丁酸的浓度达到50.2 g/L,转化率和光学纯度分别达到90.5%和93.2%。相比于摇瓶中的转化结果,发酵罐中的转化率和积累的(R)-β-羟基异丁酸浓度都有明显的提高。同时对副产物2-甲基丙烯醛和2-甲基丙烯酸的浓度进行了测定,发现它们都是很微量的,浓度都小于1 g/L。

表1 添加剂对氧化葡萄糖酸杆菌细胞生长、光学选择性和催化活性的影响
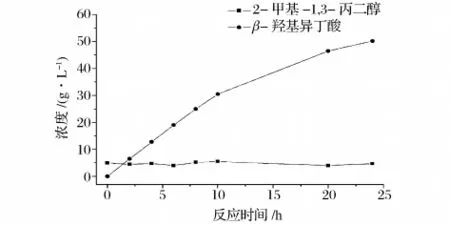
图9 在3.7 L发酵罐中补料分批转化2-甲基-1,3-丙二醇生成(R)-β-羟基异丁酸
3 结论
在氧化葡萄糖酸杆菌催化2-甲基-1,3-丙二醇生成(R)-β-羟基异丁酸的过程中,有副产物2-甲基丙烯醛和2-甲基丙烯酸的生成,但浓度都小于1 g/L。在所考察的影响因素(温度、pH值、初始底物浓度和细胞浓度等)中,底物浓度对产物的合成效率和选择性的影响最显著,产物选择性随着底物浓度增加而降低,5 g/L的底物就会对细胞活性产生抑制。在菌体培养过程中,添加0.1%的1,2-丙二醇对菌体生长、立体选择性和催化活性有一定的促进作用。最终,在温度28℃、pH值5.5、细胞浓度20 g/L、流加底物(≤5 g/L)的情况,3.7L反应器中(R)-β-羟基异丁酸的产量达到50.2 g/L,转化率和光学纯度分别达到90.5%和93.2%。
[1] De Ley J,Gillis M,Swings J.The genus Gluconobacter.In:Krieg NR,Holt J G(eds)Bergey's manual of systematic bacteriology[M].Baltimore:Williams and Wilkins,1984:267-278.
[2] Deppenmeier U,Hoffmeister M,Prust C.Biochemistry and biotechnological applications of Gluconobacter strains[J].Appl Microbiol Biotechnol,2002,60:233 -242.
[3] Prust C,Hoffmeister M,Liesegang H,et al.Complete genome sequence of the acetic bacterium Gluconobacter oxydans[J].Nat Biotechnol,2005,23:195 -200.
[4] Matsushita K,Toyama H,Adachi O.Respiratory chains and bioenergetics of acetic acid bacteria [J].Adv Microb Physiol,1994,36:247 -301.
[5] Tkac J,Navratil M,Sturdik E,et al.Monitoring of dihydroxyacetone production during oxidation of glycerol by immobilized Gluconobacter oxydans cells with an enzyme biosensor[J].Enzyme Microb Technol,2001,28:383 -388.
[6] Zigova J,Svitel J,Sturdik E.Possibilities of butyric acid production by butanol oxidation with Gluconobacter oxydans coupled with extraction[J].Chem Biochem Eng Q,2000,14:95-100.
[7] Ohta H,Tetsukawa H,Noto N.Enantiotopically selective oxidation of α,ω-diols with the enzyme systems of microorganisms[J].J Org Chem,1982,47:2 400-2 404.
[8] León R,Prazeres D M F,Fernandes P,et al.A multiphasic hollow fiber reactor for the whole-cell bioconversion of 2-methyl- 1,3-propanediol to(R)-β-hydroxyisobutyric acid[J].Biotechnol Prog,2001,17:468 -473.
[9] León R,Prazeres D M F,Molinari F,et al.Microbial stereoselective oxidation of 2-methyl-1,3-propanediol to(R)-beta-hydroxyisobutyric acid in aqueous/organic biphasic systems[J].Biocatal.Biotransform,2002,20:201-207.
[10] Molinari F,Gondolfi R,Villa R,et al.Enantioselective oxidation of prochiral 2-methyl- 1,3-propanediol by Acetobacter pasteurianus [J].Tetrahedron:Asymmetry,2003,14:2 041-2 043.
Enantioselective Oxidation of 2-methyl-1,3-propanediol to β-hydroxyisobutyric Acid Using Whole Cells of Gluconobacter oxydans DSM 2003
Wei Guo-dong,Wei Dong-zhi,Lin Jin-ping
(State Key Lab of Bioreactor Engineering,New World Institute of Biotechnology,East China University of Science and Technology,Shanghai 200237,China)
β-Hydroxyisobutyric acid(β-HIBA)is an important chemical commodity,which is used in the synthesis of Captopril and other optically active compounds.Microbial asymmetric oxidation of 2-methyl-1,3-propandiol using resting cells of Gluconobacter oxydans DSM 2003 was investigated for the synthesis of R-enantiomers of β-HIBA.The results indicated that the concentration of R-β-HIBA reached 20.5 g/L with a molar conversion rate of 88.6%and the optical purity of 95.3%at 10 h under the following conditions:temperature 28℃,pH5.5,substrate concentration 5 g/L and cell concentration 20 g/L.Biamass,stereo-selectivity and cell activity of Gluconobacter oxydans DSM 2003 were improved when 0.1%1,2-propanediol or ethylene glycol was added in the culture medium.Under the optimized reaction conditions in 3.7 L bioreactor,the concentration of R-β-HIBA reached 50.2 g/L with a molar conversion rate of 90.5%and the optical purity of 93.2%at 24 h in a 2-l batch reaction.It was proved efficient and a potential process for the oxidation of 2-methyl-1,3-propanediol to(R)-β-HIBA.
Gluconobacter oxydans,bioconversion,2-methyl-1,3-propandiol,β-hydroxyisobutyric acid
博士(林金萍为通讯作者)。
*国家973计划项目基金(No.2009CB724703)和生物反应器工程国家重点实验室专项经费(No.2060204)资助
2010-01-19,改回日期:2010-05-25

