磷胁迫对冬珊瑚幼苗根系构型与异速生长的影响
吴 楚,何开平,吴立双 (长江大学园艺园林学院,湖北 荆州 434025)
磷胁迫对冬珊瑚幼苗根系构型与异速生长的影响
吴 楚,何开平,吴立双
(长江大学园艺园林学院,湖北 荆州 434025)
采用沙培方式研究了磷胁迫对冬珊瑚根系构型和异速生长的影响。结果表明,在冬珊瑚幼苗生长期间,其拓扑学指数随磷处理浓度而增大。磷胁迫使其根系构型呈分枝状,而非通常情况下的鲱鱼骨状。在所有磷处理条件下,异速生长指数都小于1,表明冬珊瑚在幼苗期间其生物量主要用于地上部分的生长。
磷胁迫;根系构型;异速生长
磷是植物生长发育所必需的大量营养元素之一,是植物体内进行能量代谢、核酸和膜生物合成的重要物质,在光合作用、呼吸作用以及众多酶的调节方面具有重要的作用。在植物所吸收的无机营养元素中,磷对植物生长发育以及代谢的影响是最大的。然而,地球上磷矿资源非常有限。据估计,全球磷矿资源将在50 a后枯竭[1,2]。另一方面,尽管土壤中含有很多磷酸盐,但有效磷酸盐的浓度非常低,即使在肥沃的土壤中,有效磷的浓度很少超过10 μmol/L[3],而且磷在土壤中的运动速度非常慢[4],比硝酸盐低4~5个数量级[5],这样很容易在植物根系周围形成一个磷酸盐耗竭区[6]。因此,植物常常处于磷胁迫状态。磷胁迫引起根系发育与生理的改变,如根系发育进程[7]、根构型[8,9]、簇根的形成[10,11]、有机酸的分泌[11,12]。 人们研究磷胁迫反应,使用了模式植物和重要的农作物和林木,而对花卉的磷胁迫反应研究很少。本研究以冬珊瑚为材料,研究其对磷胁迫的反应及其异速生长,以期了解花卉根系在磷胁迫条件下的生长状况。
1 材料与方法
1.1 材料培育
冬珊瑚种子采自长江大学植物园。将河沙清洗干净,然后装入塑料盆中(直径15 cm,高15 cm),将事先催芽的冬珊瑚种子均匀播种于河沙表面,然后以洗净的河沙覆盖,以不见种子为度。将塑料盆移入温室。待种子萌发后,浇水和浇营养液交替进行(1 d水1 d营养液)。营养液的成分梯度为2.5、5、10、20 μmol/L,以1 mmol/L为对照。上述各浓度分别以1、2、3、4、5代表。培养45 d后,将冬珊瑚幼苗取出,用于分析。
1.2 根系扫描
使用WinRhizo根系分析系统对根系进行扫描和分析,取得总根长、总表面积、总投影面积、总体积以及根尖数等参数。
1.3 拓扑学指数和异速生长分析
根系高度(μ)和外部根节路径长度总数(α)的定义和计算根据Wu 等[8]的方法进行,lgα和lgμ之间直线关系的斜率为拓扑学指数。异速生长分析按照吴楚等[13]的方法进行。
1.4 数据处理
各个磷浓度处理均取50棵幼苗用于分析,各个参数以SPSS V10.0软件分析各个处理之间的差异,显著性水平为0.05。
2 结果与分析
2.1 磷胁迫对冬珊瑚幼苗根系特征和构型的影响
磷胁迫对冬珊瑚幼苗根系构型具有很大的影响。在磷2.5~10 μmol/L浓度范围内,根系总长度随磷浓度而增加,当磷浓度增大时(20 μmol/L和1 mmol/L),总根长度反而下降(图1A)。总表面积和总投影面积的变化趋势与总根长度的变化趋势相似(图1B和C)。这3个参数都只在第三(10 μmol/L)和第四(20 μmol/L)处理之间存在显著差异。总体上,根系体积随磷处理浓度而增加,前4种浓度处理(2.5~20 μmol/L)之间无显著差异,但它们与对照(1 mmol/L)之间存在显著差异(图2A)。从第一到第四处理(2.5~20 μmol/L),根节平均直径随磷浓度而增加;当磷浓度达到1 mmol/L时,根节平均直径反而下降(图2B)。第一种处理(2.5 μmol/L)和第三、第四处理(10和20 μmol/L)之间存在显著差异,第二和第三种处理(5和10 μmol/L)与第四种处理(20 μmol/L)之间存在显著差异,第四种处理与对照(1 mmol/L)之间存在显著差异。整个根系的根尖数量在10 μmol/L时达到最大,与其他几种处理存在显著差异(图2C)。 根系分叉数量和根节数量的变化趋势相同(图3A和B),且都存在第三种处理(10 μmol/L)与其他处理之间存在显著差异。
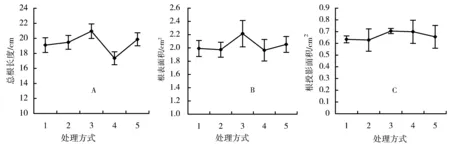
图1 磷有效性对总根长度、根表面积和根投影面积的影响Figure 1 The effects of phosphate availability on the total root length,root surface area,and root projected area
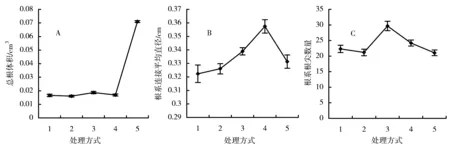
图2 磷有效性对根总体积、根节平均直径和根尖数的影响Figure 2 The effects of phosphate availability on the total volume,the average diameter of links per seedling and the number of root tips
根系高度(μ)为根系沿着主根的根节数量,外部根节路径长度总数(α)为整个根系一级根根节数的总和,反映了根系空间结构。这2个参数是分析根系构型的一个重要指标[14,15]。在磷胁迫处理下,这2个参数都在10 μmol/L时达到最大(图3C和D)。lgα和lgμ之间直线关系的斜率为指示根系构型的拓扑学指数。从图4可以得知,随着磷浓度增大,拓扑学指数逐渐增大。
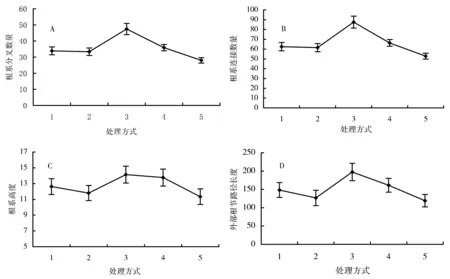
图3 磷有效性对分叉数、根节数、根系高度和外部根节路径长度的影响Figure 3 The effects of phosphate availability on the numbers of forks and the links,altitude,and external path length
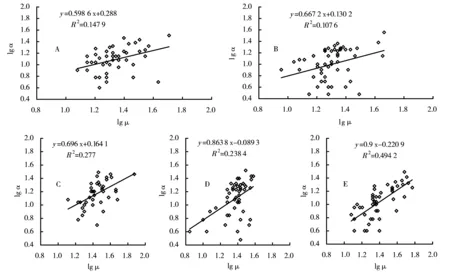
图A~E分别代表处理1~5图4 拓扑学指数变化Figure 4 The changes in toplogical index
2.2 磷胁迫对冬珊瑚幼苗异速生长的影响
异速生长分析建立在根系生物量(Wr)和地上部分生物量(Ws)的对数之间的直线关系的基础上,其直线关系的斜率即为异速生长指数。从图5可以看出,无论磷的处理浓度如何,直线的斜率(异速生长指数)都小于1,这表明在冬珊瑚幼苗阶段,生长偏向于地上部分,因此,这种生长特性引起生物量分配偏向于地上分配(图6)。在10 μmol/L时,冬珊瑚的总生物量(即地上部分和地下部分生物量的总和)最小。
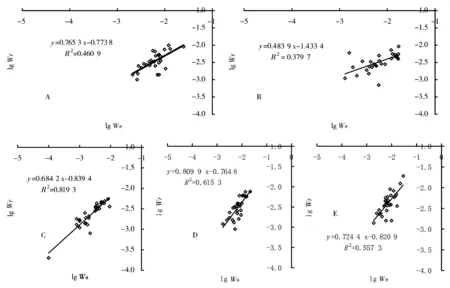
图A~E分别代表处理1~5图5 根茎异速生长分析Figure 1 Allometric analyses of roots and shoots
3 讨论
3.1 磷胁迫对冬珊瑚根系构型的影响

图6 磷有效性对根和地上部分干重的影响Figure The effects of phosphate availability on root and shoot dry weight
磷胁迫对冬珊瑚的根系构型产生了很大的影响(图1~4)。然而,拓扑学指数随着磷浓度而增大(图4),这表明低有效磷浓度引起冬珊瑚幼苗根系呈现更大的分枝性,而不是通常的结果(即鲱鱼骨型)。此结果与其他研究刚好相反[8,14~16]。其原因可能是冬珊瑚幼苗根系在低磷条件下对磷吸收效率较低,而在高磷条件下对磷吸收的效率较高。如果真是如此,则说明冬珊瑚幼苗根系在低磷条件下可能没有产生高亲和力的磷酸转运蛋白,或产生的高亲和力的磷酸转运蛋白很少。
3.2 磷胁迫对冬珊瑚异速生长的影响
无论在磷胁迫条件下(2.5~20 μmol/L)还是在磷充足的条件下(1 mmol/L),冬珊瑚幼苗的根系的异速生长指数都小于1(图5),这表明冬珊瑚在幼苗期间,生物量的分配都倾向于地上部分,从而出现图6所显示的结果。在许多情况下,磷胁迫会导致生物量分配倾向于地下[13,17],由此看来,在磷胁迫条件下,冬珊瑚在幼苗期间根系发育状况与许多植物不同。在磷胁迫条件下,植物根系对磷胁迫的反应与植物生长素的再分配有关[18],因此,在磷胁迫条件下冬珊瑚幼苗根系发育受到生长素再分配的影响较大,从而导致生物量向地上部分的分配超过了向地下部分的的分配(图6)。
[1]Runge-Metzger A.Closing the cycle:obstacles to efficient P management for improved global food security [A].Tiessen H.Phosphorus in the Global Environment:Transfers,Cycles and Management [C].New York,Wiley,1995.27~42.
[2]Tilman D,Fargione J,Wolff B,etal.Forecasting agriculturally driven global environmental change [J].Science,2001,292:281~284.
[3]Bieleski R L.Phosphate pools,phosphate transport,and phosphate availability [J].Annu Rev Plant Physiol,1973,24:225~252.
[4]Smith FW,Mudge SR,Rae AL,etal.Phosphate[J].transport in plants.Plant Soil,2003,248:71~83.
[5]Nye P H,Tinker P B.Solute movement in the soil-root system[M].Berkeley CA.USA:University of California Press,1977.193~204.
[6]Poirier Y,Bucher M. Phosphate transport and homeostasis inArabidopsis[J]. TheArabidopsisBook,September,2002. Rockville,MD:American Society of Plant Biologists. doi:10.1199/tab.0024.
[7]Sanchez-Calderon L,Lopez-Bucio J,Chacon-Lopez A,etal.Phosphate starvation induces a determinate developmental program in the roots ofArabidopsisthaliana[J].Plant Cell Physiol,2005,46:174~184.
[8]Wu C,Wei X,Sun H L,etal.Phosphate availability alters lateral root anatomy and root architecture ofFraxinusmandshuricaRupr.seedlings [J].J Integrative Plant Biol,2005,47:292~301.
[9]Jiang C,Gao X,Liao L,etal.Phosphate starvation root architecture and anthocyanin accumulation responses are modulated by the gibberellin-DELLA signaling pathway inArabidopsis[J].Plant Physiol,2007,145:1460~1470.
[10]Shane MW,Szota C,Lambers H.A root trait accounting for the extreme phosphorus sensitivity ofHakeaprostrata(Proteaceae) [J].Plant Cell Environment,2004,27:991~1004.
[11]Shu L,Shen J,Rengel Z,etal.Growth medium and phosphorus supply affect cluster root formation and citrate exudation byLupinusalbusgrown in a sand/solution split-root system [J].Plant Soil,2005,276:85~94.
[12]Watt M,Evans J R.Linking development and determinacy with organic acid efflux from proteoid roots of white lupin grown with low phosphorus and ambient or elevated atmospheric CO2concentration [J].Plant Physiol,1999,120:705~716.
[13]吴 楚,范志强,王政权.磷胁迫对水曲柳幼苗叶绿素合成、光合作用和生物量分配格局的影响[J].应用生态学报,2004,15(6):935~940.
[14]Fitter A H,Stickland T R.Architectural analysis of plant root systems.2.Influence of nutrient supply on architecture in contrasting plant species [J].New Phytol,1991,118:383~389.
[15]Fitter A H,Stickland T R,Harvey M L,etal.Archtectural analysis of plant root systems.1.Architectural correlates of exploitation efficiency [J].New Phytol,1991,118:375~382.
[16]Fitter A H.An architectural appraoch to the comparative ecology of plant root systems [J].New Phytol,1987,106(suppl.):61~77.
[17]Raghothama K G.Phosphate acquisition [J].Ann Rev Plant Physiol Plant Mol Biol,1999.,50:665~693.
[18]Nacry P,Canivenc G,Muller B,etal.A role for auxin redistribution in the responses of the root system architecture to phosphate starvation inArabidopsis[J].Plant Physiol,2005,138:2061~2074.
2010-10-13
湖北省教育厅资助项目(B2010130)
吴 楚(1965-),男,湖北天门人,理学博士,教授,主要从事植物生理生态学研究.
10.3969/j.issn.1673-1409(S).2010.04.014
Q945.78
A
1673-1409(2010)04-S047-05

