荷叶中紫云英苷和牛血清白蛋白相互作用的光谱学研究
邓胜国,邓泽元,范亚苇,单 斌
南昌大学食品科学与技术国家重点实验室,南昌大学高等研究院,南昌 330047
荷叶中紫云英苷和牛血清白蛋白相互作用的光谱学研究
邓胜国,邓泽元*,范亚苇,单 斌
南昌大学食品科学与技术国家重点实验室,南昌大学高等研究院,南昌 330047
本文采用荧光光谱法、紫外光谱法研究在生理条件(pH=7.4)下荷叶中紫云英苷 (AST)与牛血清白蛋白(BSA)的相互作用。结果表明AST可与BSA结合并通过静态猝灭作用机制对BSA内源性荧光进行猝灭。在温度为 298 K及 308 K时,测得其猝灭速率常数 (Kq)分别为 4.31×1013L/mol/s和 3.72×1013L/mol/s;结合常数 (Kd)分别为 2.009×105L/mol和 0.927×105L/mol;结合位点数 (n)分别为 0.943和 0.893。依据 298 K时测定的反应自由能变 (△G0=-30.25 kJ/mol),反应焓变 (△H0=-59.02 kJ/mol)及反应熵变 (△S0=-96.54 J/ mol/K),结果发现AST与BSA间的结合反应可自发进行且其作用力主要表现为氢键和范德华力。此外,根据Förster非辐射能量转移理论得到AST与 BSA之间的结合距离 (r)为 4.13 nm,表明非辐射能量可从 BSA转移至AST。
荷叶;相互作用;紫云英苷;牛血清白蛋白;荧光光谱;能量转移
血清白蛋白(Serum Albumin,SA)是血浆中含量最丰富的蛋白质,它能结合许多内源性和外源性物质,并能将这些物质输送到身体的各个部位,因此研究血清白蛋白与药物分子的相互作用,对了解药物在人体内的药理活性、吸收、分布及排泄等具有十分重要的意义。荷叶主要的活性成分是黄酮类化合物,具有解暑清热、生发清阳、散瘀止血等功效,已成为研究、利用的热点[1-3],但是目前国内尚无研究紫云英苷(从荷叶中分离纯化得到的一种黄酮苷类化合物,化学结构见图 1)与牛血清白蛋白相互作用的相关报道。荧光光谱分析法因本身具有简便、快速、灵敏等优点已广泛应用于蛋白质的研究中,本文采用荧光光谱法较详尽地研究了荷叶中的紫云英苷与牛血清白蛋白间的相互作用,并根据实验处理相关的光谱数据,首次计算得出紫云英苷与BSA之间的猝灭速率常数 (Kq),结合常数 (Kd),结合位点数(n),热力学参数 (△G0,△H0,△S0)及二者间的结合距离(r),力求从分子水平探讨紫云英苷与 BSA相互作用的机制,以期为进一步设计和筛选药用效果更加明显、毒副作用更小的新型药物提供科学的指导。
1 材料与方法
1.1 仪器与试剂
F-2500型荧光光度计 (日本日立公司);UV-2450紫外-可见分光光度计 (日本岛津公司);pHS-3C型酸度计(上海雷磁仪器厂);DK-98-Ⅱ型恒温水浴锅(天津市泰斯特仪器有限公司);Finnpipette可调式移液枪(美国芬兰雷勃公司)。
牛血清白蛋白 (BSA,Fraction V,相对分子质量65000,北京华美生物工程有限公司),用0.05 mol/L的NaCl溶液配制成 6.25×10-5mol/L的溶液,溶液保存于 277 K的冰箱中备用;紫云英苷 (Astragalin,简称AST,本实验室从荷叶中分离纯化获得,含量大于 95%)用甲醇溶解供试;pH=7.4的 Tris-HCl缓冲溶液;其他所用试剂均为分析纯,实验用水为二次蒸馏水。
1.2 实验方法
在 10 mL的平底小容量瓶中,分别加入 pH=7. 4的 Tris-HCl缓冲溶液 3 mL,0.05 mol/L的 NaCl溶液 3 mL,固定量的BSA及不同量的紫云英苷,以二次水定容至 10 mL,混合均匀后在一定温度下恒温。准确移取3.0 mL该溶液于石英荧光池中,在激发波长为 280 nm(荧光激发和发射狭缝均为 5 nm,测量电压 400 V)下,测定并记录BSA的荧光光谱及紫云英苷对BSA的荧光猝灭光谱。
2 结果与讨论
2.1 紫云英苷对BSA的荧光猝灭
蛋白质分子中含有色氨酸和酪氨酸等芳香氨基酸残基,在紫外光激发下,分子具有较强的内源荧光发射。这种内源性荧光容易受周围环境的影响,诸如蛋白质构象发生变化,蛋白质变性及蛋白质与药物分子发生结合反应时,都会使蛋白质荧光强度明显减弱而导致荧光猝灭。由图 2可知,当激发波长固定为 280 nm时,BSA在波长 343 nm处可发射强烈的荧光,BSA发射的荧光强度随着紫云英苷的不断滴加而逐渐降低,但其最大荧光发射波长 (343 nm)并不发生偏移,峰形基本保持不变,表明 BSA可与紫云英苷发生反应并产生不发荧光的复合物导致BSA荧光的猝灭。荧光猝灭可分为静态猝灭和动态猝灭两类[4],二者通常可依据不同温度下的测量结果得以区分。对静态猝灭,温度的升高将降低复合物的稳定性,导致静态荧光猝灭速率常数随温度的升高而减小。相比之下,温度的升高将增加分子间的有效碰撞和加剧电子转移的速率,促使动态荧光猝灭常数随温度的升高而增大。为了确定紫云英苷对BSA荧光猝灭的类型,先假设他们之间相互作用的类型为动态猝灭,根据 Stern-Volumer方程[5]:
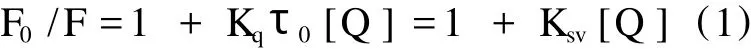
式中,Kq为双分子猝灭过程速率常数,Ksv为动态猝灭常数,τ0为猝灭剂不存在时荧光分子平均寿命 (生物大分子荧光寿命约为 10-8s[6]),[Q]为猝灭剂浓度(即紫云英苷的浓度),F0和 F分别为不添加和添加紫云英苷时BSA的荧光强度。

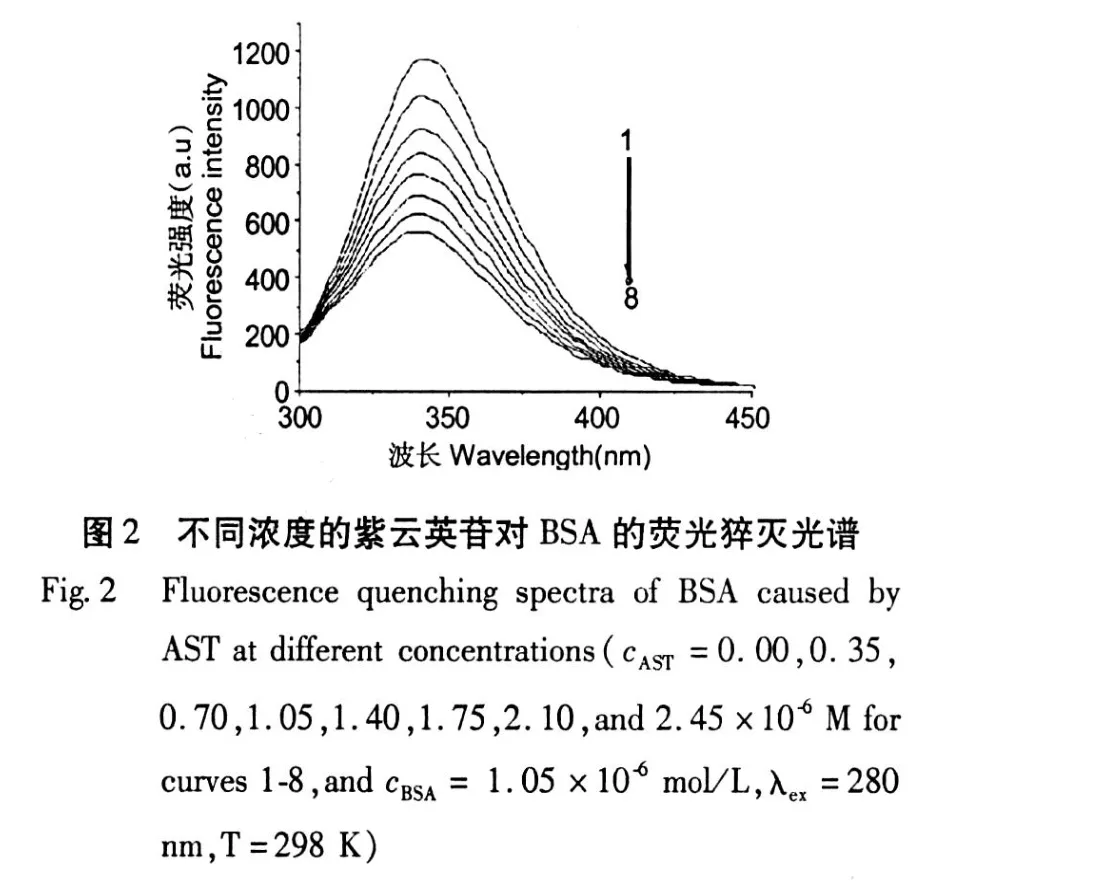
图 3 紫云英苷在 298 K及 308 K下猝灭BSA荧光的Stern-Vo lmer曲线Fig.3 Stern-Vo lmer curves for the binding of BSA to AST at 298 and 308 K(cBSA=1.05×10-6mol/ L,λex=280 nm)
根据图 3可得到线性方程 Y=4.31×105X+ 1.002,r=0.9993(T=298 K)及 Y=3.72×105X +1.021,r=0.9994(T=308 K),结果发现不同温度下的 Stern-Volumer图均呈现良好的线性关系 (T =298 K,r=0.9993;T=308 K,r=0.9994),这表示紫云英苷对 BSA的猝灭形式只能是静态猝灭或是动态猝灭[7]。同时可知它们的动态猝灭常数 (T= 298 K,Ksv=4.31×105L/mol;T=308 K,Ksv=3.72 ×105L/mol)与温度呈负相关,表明紫云英苷对BSA的猝灭方式可能主要是静态猝灭过程而不是动态猝灭,而相应的双分子猝灭过程速率常数 (T= 298 K,Kq=4.31×1013L/mol/s;T=308 K,Kq=3. 72×1013L/mol/s)均大于各类猝灭剂对生物大分子最大扩散碰撞猝灭速率常数 (Kq=2.0×1010L/ mol/s)三个数量级[8,9],这进一步证明紫云英苷对BSA的猝灭属于静态猝灭。
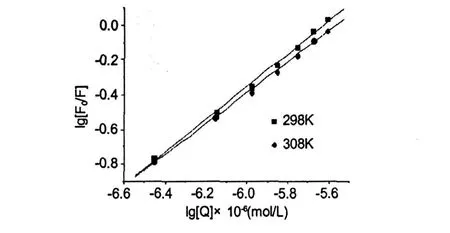
图 4 紫云英苷在 298 K及 308 K下猝灭 BSA荧光的双对数回归曲线图Fig.4 Double logarithmic regression curves ofBSA fluorescence quenching caused byAST at 298 and 308 K(λex=280 nm,cBSA=1.05×10-6mol/L)
2.2 紫云英苷对BSA的结合常数及结合位点数的计算
由静态猝灭而导致荧光体荧光强度减弱的过程,其荧光强度 F、猝灭剂浓度[Q]、结合常数 Kd及结合数 n之间的关系式表示如下[10,11]:
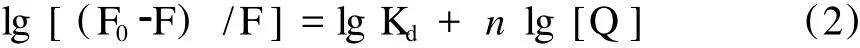
由图 4可得线性方程 Y=0.943X+5.303,r= 0.9985(T=298 K)及 Y=0.893X+4.967,r= 0.9994(T=308 K)。结合数近似等于 1(T=298 K,n=0.943;T=308 K,n=0.893)表明每一个 BSA分子可与一个紫云英苷分子结合形成复合物,同时结合常数 (T=298 K,Kd=2.009×105L/mol;T= 308 K,Kd=0.927×105L/mol)随着温度的增加而减少,这种变化趋势和上面实验计算得出的动态猝灭常数 (Ksv)及相应的双分子猝灭过程速率常数(Kq)的变化趋势一致,这表明紫云英苷分子与 BSA相互作用可能形成了不稳定的复合物,并且当温度升高时这种复合物会部分分解而导致结合常数下降。这些结果同时也表明温度对结合数及结合常数的影响较小,紫云英苷和BSA之间存在强烈的作用力,因此紫云英苷在体内可被BSA贮存及运输。
2.3 紫云英苷猝灭BSA荧光过程中热力学参数的测定及分子间作用力类型的判断
一般来讲,药物小分子与蛋白质间的结合力主要有氢键、范德华力、静电引力、疏水作用力等四种类型。药物不同,与蛋白质作用力类型也不相同,而自由能变 (△G0),焓变 (△H0)及熵变 (△S0)是判断药物小分子与蛋白质相互作用类型的主要热力学参数。当温度变化不大时,反应的焓变可视作常数,热力学参数之间的关系可用下列方程来描述:
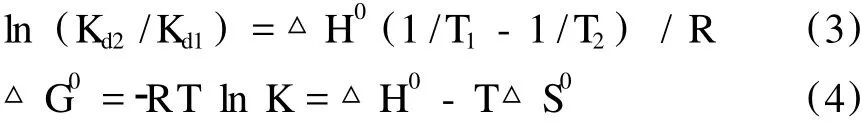
根据上述公式及不同温度 (T1,T2)下的结合常数 (Kd1,Kd2)计算出温度为 298 K时紫云英苷与BSA反应的热力学参数分别为△G0=-30.25 kJ/ mol,△H0=-59.02 KJ/mol,△S0=-96.54 J/mol/ K。△G0<0,表明紫云英苷与 BSA的结合反应可自发进行,ΔH<0及ΔS<0,则可推断它们之间的作用力主要表现为氢键和范德华力[12]。
2.4 紫云英苷对BSA作用距离的计算
根据 Förster非辐射能量转移理论[13],药物小分子与血清白蛋白结合形成复合物的结合距离越小,则蛋白质越容易储存和转运药物分子,药物分子更容易发挥其药理活性。能量转移效率 E与结合距离 r的关系为:
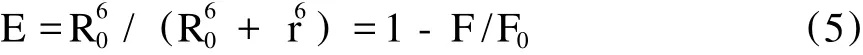
F为[BSA][紫云英苷]=1∶1(摩尔浓度比)时的BSA的荧光强度,F0为溶液中紫云英苷不存在时BSA的荧光强度,R0是转移效率为 50%时的临界距离。R0的计算公式如下:
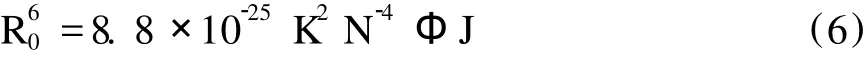
K2为偶极空间取向因子,N为介质折射指数,Ф为给体的荧光量子产率,J为给体的荧光发射光谱与受体的紫外吸收光谱间的重叠积分。J的表达式如下:
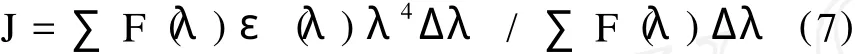
F(λ)为荧光给体在波长为λ的荧光强度,ε (λ)为受体在波长为λ的摩尔吸光系数,只要得到E,K2和N并通过实测光谱求出积分 J,则可计算出R0和 r。
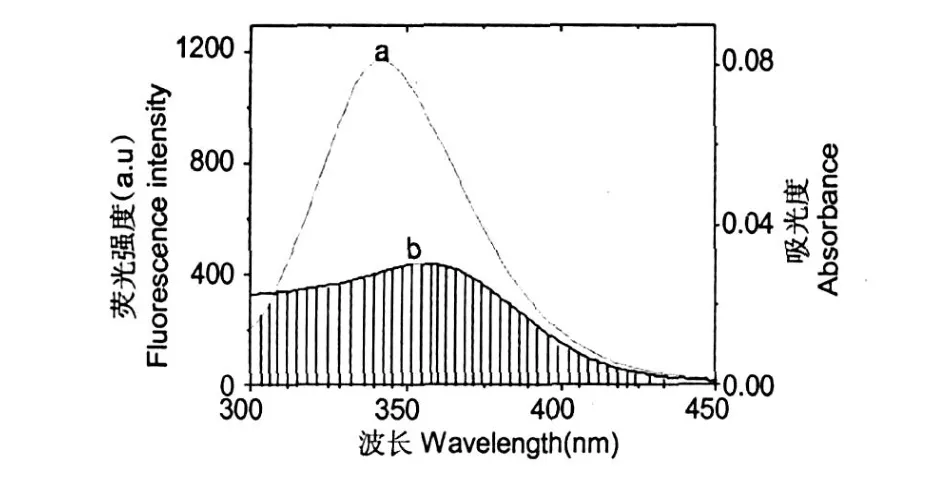
图 5 BSA的荧光光谱 (a)与紫云英苷紫外吸收光谱 (b)的重叠谱图Fig.5 Overlapping of the fluorescence emission spectra of BSA (a)and UV absorption spectra of AST(b),T=298 K (cAST=1.05×10-6M,cBSA=1.05×10-6M,T=298K)
本实验条件下,给体为 BSA,受体即为紫云英苷,取向因子为给体-受体各向随机分布的平均值K2=2/3,折射指数为水和有机物的平均值 N= 1.336,BSA中色氨酸的量子产率 Ф=0.15[14]。BSA的荧光光谱与紫云英苷的紫外吸收谱有部分重叠(图 5)。将图 5中的光谱重叠部分割成极小的矩阵面积,并结合式(7)求和算得光谱的重叠积分为 J= 8.42×10-14cm3·L/mol,将这些数值代入式 (6)得到 R0=3.64 nm,同时利用紫云英苷与BSA摩尔浓度比为 1∶1时复合物的荧光强度,通过式 (5)求出能量转移效率 E=0.287及求得紫云英苷距BS A分子色氨酸残基最短离为 r=4.13 nm(r<7 nm),表明BSA与紫云英苷间可以发生非辐射能量转移,紫云英苷的部分片断能够嵌插入BSA分子内部。
3 结论
实验表明紫云英苷可与 BSA以摩尔比 1∶1牢固结合并通过静态猝灭作用机制对BSA产生强烈的荧光猝灭。通过计算荧光猝灭过程中的热力学参数,表明紫云英苷与BSA的结合反应可自发进行且其作用力主要表现为氢键和范德华力。此外紫云英苷与BSA间的结合距离小于 7 nm,表明二者之间能够发生非辐射能量转移。因此紫云英苷分子的部分片断能够插入BSA分子内部并与BSA形成复合物,可以被蛋白质所贮存和运输。
1 JiLL(纪丽莲).Study on the antimicrobial activities of lotus leaves extracts with ethanol.Food Sci(食品科学), 1999,20:64-66.
2 Du LJ(杜力军),Sun H(孙虹),LiM(李敏),et al.Studies on the active components in the leaf ofNelum bo nucifera and black soybean and theirmixture with blood lipid regulating effect.Chin Tradit Herb D rugs(中草药),2000,31: 526-528.
3 Wu MJ,Wang L,Weng CY,et al.Antioxidant activity of methanol extract ofthe lotus leaf (Nelum bo nucifera Gertn.).Am J Chin M ed,2003,31:687-697.
4 Chen GZ(陈国珍),Huang XZ(黄贤智),Zheng ZX(郑朱梓),et al.Fluorescene Analysis(荧光分析法).Beijing: Science Press,1990,119-120.
5 EftinkMR,Ghiron CA.Fluorescence quenching studies with proteins.Anal B iochem,1981,114:199-227.
6 Jiang CQ,Gao MX,He JX.Study of the interaction between terazosin and serum albumin:Synchronous fluorescence determination of terazosin.Anal Chim Acta,2002,452:185-189.
7 Wang YQ,Zhang HM,Zhang Gh,et al.Studies of the interaction between paraquat and bovine hemoglobin.Int J B iol M acrom ol,2007,41:243-250.
8 GerbanowskiA,Malabat C,Rabiller C,et al.Grafting of aliphatic and aromatic probes on rapeseed 2S and 12S proteins: influence on their structural and physicochemical properties. J Agric Food Chem,1999,47:5218-5226.
9 Kandagal PB,Seetharamappa J,Shaikh S MT,et al.Binding of trazodone hydrochloride with human serum albumin:A spectroscopic study.J Photochem PhotobiolA,2007,185:239-244.
10 Feng XZ(冯喜增),Jin R(金瑞祥),Qu Y(曲芸),et al. Studies on the ions effect on the binding interaction between HP and BSA.Chem Res Chin Univ(高等学校化学学报), 1996,17:866-869.
11 Feng XZ,Lin Z,Yang LJ,et al.Investigation of the interaction be tween acridine orange and bovine serum albumin.Talanta,1998,47:1223-1229.
12 Ross PD,Subramanian S.Thermodynamics of protein association reactions:forces contributing to stability.B iochem istry, 1981,20:3096-3102.
13 SklarLA,HudsonBS,S imoniRD.Ther modynamicsof protein association reactions:forces contributing to stability.B iochem istry,1977,16:5100-5108.
14 Xu H,Liu QW,Wen YQ.Spectroscopic studies on the interaction be tween nicotinamide and bovine serum albumin.Spectrochim Acta A,2008,71:984-988.
Spectroscopic Investigation on the Interaction between Astragalin in LotusLeaf and Bovine Serum Album in
DENG Sheng-guo,DENG Ze-yuan*,FAN Ya-wei,SHAN Bin
State Key Lab of Food Science and Technology,Institute forAdvanced Study,Nanchang University,Nanchang 330047,China
The interaction between astragalin(AST)in lotus leaf and bovine serum albumin(BSA)in physiological condition(pH=7.4)was studied by fluorescence spectroscopy and ultraviolet absorption spectroscopy.The results demonstrated thatAST could bind to BSA and quenched the intrinsic fluorescence of BSA through static quenching mechanis m.The quenching rate constants of biomoleculer,the binding constants,and the number of binding sites between AST and BSA were Kq=4.31×1013L/mol/s and 3.72×1013L/mol/s,Kd=2.009×105L/mol and 0.927×105L/mol,n =0.943 and 0.893 at 298 K and 308 K,respectively.According to the free energy change(△G0=-30.25 kJ/mol), the enthalpy change(△H0=-59.02 kJ/mol)and the entropy change(△S0=-96.54 J/mol/K)obtained at 298 K, the binding ofBSA to ASTwas found to be spontaneous and the interaction between BSA and ASTwas driven mainly by hydrogen bonds and van derWaals forces.In addition,based on the Förster theory of non-radiation energy transfer,the binding distance(r=4.13 nm)between AST and BSA was close enough to transfer non-radiation energy from BSA to AST.
lotus leaf;interaction;astragalin;bovine serum albumin;fluorescence spectroscopy;energy transfer
1001-6880(2010)06-1081-05
2009-03-30 接受日期:2009-07-03
江西省教育厅 2003年重点项目(20030058);国家自然科学基金项目 (20562008);教育部长江学者和创新团队发展计划项目(IRT0540)
*通讯作者 Tel:86-791-8304402;E-mail:zeyuandengpaper@163.com
Q946.91;R284.1;TQ464.3;Q523
A

