正交试验优选苦参总生物碱提取工艺Δ
丛竹凤,高 鹏,代 龙#(1.山东省肿瘤防治研究院,济南市 50117;.山东中医药大学,济南市50355)
正交试验优选苦参总生物碱提取工艺Δ
丛竹凤1*,高 鹏2,代 龙2#(1.山东省肿瘤防治研究院,济南市 250117;2.山东中医药大学,济南市250355)
目的:优选苦参总生物碱的最佳提取工艺。方法:以酸水浓度、溶剂用量、渗漉液流速为考察因素,以苦参中苦参碱、氧化苦参碱含量之和以及总生物碱含量的综合评分为评价指标,采用正交试验优选最佳工艺条件。结果:优选的最佳提取工艺为采用10倍量的0.2%盐酸溶液进行渗漉提取,渗漉速度为3mL·min-1·kg-1。结论:酸水渗漉法操作简便、提取率高,可用于苦参总生物碱的提取。
苦参;总生物碱;提取工艺;正交试验
苦参[1]为豆科植物苦参Sophora flavescens Ait.的干燥根,味苦、性寒,归心、肝、胃、大肠、膀胱经,具有清热燥湿、杀虫、利尿等功效。苦参中的有效成分为总生物碱(简称总碱),主要有苦参碱(matrine)及氧化苦参碱(oxy-matrine)。现代药理研究表明[2],生物碱类成分具有广泛的生理活性,具有良好的开发应用前景。本试验比较了不同提取方法对苦参总碱的提取效果,并采用正交试验法优选最佳提取工艺。
1 仪器与材料
LC-2010A型高效液相色谱(HPLC)仪(日本岛津公司);AB135-S型十万分之一天平(瑞士梅特勒-托利多仪器有限公司);KQ-250型超声波清洗器(昆山市超声仪器有限公司);MV1100型紫外分光光度计(上海天美科学仪器有限公司);PK-S24型电热恒温水浴锅(上海精宏实验设备有限公司)。
苦参药材购自山东中医药大学门诊部,经山东中医药大学药学院生药系鉴定教研室鉴定为真品;苦参碱、氧化苦参碱对照品、苦参对照药材(中国药品生物制品检定所,批号分别为110805-200306、110780-200306、121019-200505);乙腈为色谱纯,水为2次重蒸水,其余试剂均为分析纯。
2 方法与结果
2.1 指标成分的确定
苦参中的主要活性成分为以苦参碱、氧化苦参碱为代表的总碱,因此试验选择苦参碱、氧化苦参碱以及苦参总碱的含量为工艺优选的指标成分。
2.2 苦参碱和氧化苦参碱含量测定[3]
2.2.1 色谱条件 色谱柱:十八烷基硅烷键合硅胶(150mm×4.6mm,5μm);流动相:乙腈-三乙胺磷酸溶液(3∶97,取三乙胺0.3mL、磷酸2mL,加水稀释至1000mL);流速:1.0mL·min-1;柱温:25℃:检测波长:220nm。
2.2.2 混合对照品溶液的制备 精密称取已干燥至恒重的苦参碱和氧化苦参碱对照品适量,加甲醇分别制成每1mL含苦参碱20μg、氧化苦参碱80μg的溶液,作为混合对照品溶液。
2.2.3 供试品溶液的制备 分别精密量取提取工艺下的供试品溶液,用流动相稀释至每1mL相当于含原药材0.02g,即得。
2.2.4 标准曲线的制备 取苦参碱、氧化苦参碱对照品适量,精密称定,用甲醇制成每1mL含苦参碱、氧化苦参碱分别为39.02、164.96μg的溶液,作为对照品溶液。分别精密吸取2种对照品溶液1、3、5、7、9μL,注入HPLC仪中,按上述色谱条件测定。分别以苦参碱和氧化苦参碱峰面积积分值(Y)对相应对照品进样量(X)进行线性回归,得苦参碱回归方程为Y=684270.89X+230.15(r=0.9999)、氧化苦参碱回归方程为Y=699091.60X-3397.3(r=0.9999)。结果表明,苦参碱、氧化苦参碱进样量分别在0.03902~0.35118、0.16496~1.48464μg范围内与各自峰面积积分值呈良好线性关系。
2.2.5 精密度试验 分别精密吸取混合对照品溶液10μL,进样5次,按上述色谱条件测定。结果,苦参碱、氧化苦参碱的RSD分别为0.76%、0.82%(n均为5),表明仪器精密度良好。
2.2.6 稳定性试验 取供试品溶液10μL,按上述色谱条件每隔1h测定1次,共测6次。结果,苦参碱的RSD=1.22%(n=6),氧化苦参碱的RSD=0.72%(n=6),表明供试品溶液在5h内稳定。
2.2.7 加样回收率试验 取已知苦参碱(1.1042mg)和氧化苦参碱(0.7210mg)含量的同一批样品6份,精密称定,分别加入一定量的对照品溶液,按“2.2.3”项下方法制备供试品溶液,照上述色谱条件测定,计算加样回收率。结果,苦参碱的平均回收率为99.13%,RSD=1.85(n=6);氧化苦参碱的平均回收率为100.97%,RSD=2.11(n=6)。
2.3 苦参总碱含量测定
[4],采用酸性染料比色法——溴甲酚绿显色法测定药材以及样品中的苦参总碱含量(总碱以氧化苦参碱计)。
2.3.1 对照品溶液的制备 取氧化苦参碱对照品适量,精密称定,加水制成每1mL含氧化苦参碱0.1mg的溶液,即得。
2.3.2 供试品溶液的制备 分别精密量取提取工艺下的供试品溶液,加水稀释至每1mL相当于含原药材0.05g,即得。
2.3.3 测定法 参考文献[4],选择420nm波长为最大检测波长。
2.3.4 标准曲线的制备 精密称取于120℃干燥至恒重的氧化苦参碱对照品10.20mg,置于100mL量瓶中,加水适量,超声使溶解,并稀释至刻度,摇匀,即得(每1mL中含氧化苦参碱0.102mg)。精密量取上述对照品溶液2.0、4.0、6.0、8.0、10.0mL,分别置于10mL量瓶中,加水稀释至刻度。以等量的水作为空白。取各样品1mL、pH 3.0的缓冲液8mL、溴甲酚绿溶液1mL,振摇后加入CHCl310mL,上下振摇一定时间,静置。待两相彻底分离后分取CHCl3层,于420nm波长处测定吸光度(A)。以A为纵坐标、氧化苦参碱检测浓度(C)为横坐标,制备标准曲线,得回归方程为A=6.3039C+0.0096(r=0.9996)。结果表明,氧化苦参碱检测浓度在0.0204~0.1020mg·mL-1范围内与峰面积积分值呈良好线性关系。
2.3.5 加样回收率试验 取已知苦参总碱含量(2.7160mg)的同一批样品6份,精密称定,分别加人一定量(2.7026mg)的氧化苦参碱对照品溶液,按“2.2.3”项下方法制备供试品溶液,按上述色谱条件测定,计算加样回收率。结果,平均回收率为98.67%,RSD=2.08%(n=6)。
2.4 苦参药材提取工艺预试验
苦参药材中苦参碱和氧化苦参碱为中等极性的生物碱。根据苦参生物碱的性质,可以采用的提取方法有水煎煮、乙醇回流、酸水渗漉法。笔者首先对上述3种提取方法进行了预试验:方法1为取苦参药材200g,粗粉碎,加8倍量水煎煮2次,每次2h,滤过,合并滤液,备用;方法2为取苦参药材200g,粗粉碎,加6倍量70%的乙醇回流提取2次,每次1.5h,滤过,合并滤液,备用;方法3为取苦参药材200g,粗粉碎,采用渗漉法进行提取,控制提取条件为药材粗粉以10倍量0.2%的盐酸溶液渗漉,流速为3mL·min-1·kg-1,收集渗漉液,备用。按“2.2”、“2.3”项下方法分别测定苦参碱、氧化苦参碱、苦参总碱的含量,并按下式计算得膏率、总碱转移率:得膏率=提取所得干膏质量/原提取药材总质量×100%;总碱转移率=提取出的苦参总碱质量/原药材中所含总碱质量×100%。预试验结果见表1。
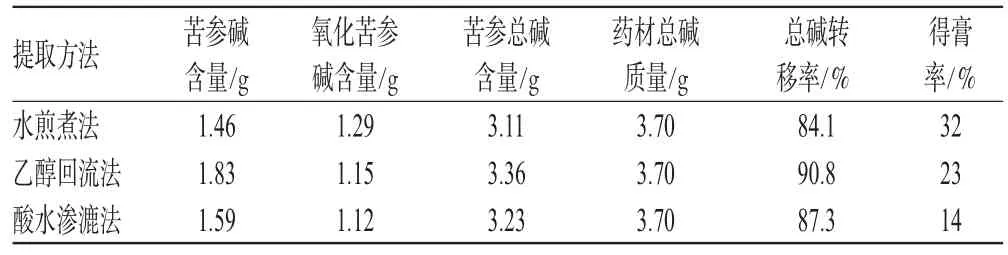
表1 预试验结果Tab 1 Pretest results
由表1可知,采用水煎煮、乙醇回流、酸水渗漉法进行提取时的提取效果相当,但对得膏率的影响大小顺序为水煎煮法>乙醇回流法>酸水渗漉法。从提取液中杂质量及简化工艺考虑,笔者采用了酸水渗漉法提取苦参总碱,并采用正交试验法进行了研究。
2.5 酸水渗漉法工艺优选
2.5.1 因素水平的选取 结合预试验,选取酸水浓度(A)、溶剂用量(B)、渗漉液流速(C)为考察因素,每个因素设3个水平,按L9(34)正交表进行试验。因素水平见表2。

表2 因素水平Tab 2 Levels and factors
2.5.2 正交试验结果 准确称取苦参药材100g,粉碎成粗粉,共9份。按正交表中各条件分别进行酸水渗漉,共得9份供试品溶液。分别测定其中的苦参碱和氧化苦参碱含量之和以及苦参总碱含量,并分别以苦参碱、氧化苦参碱含量之和以及总碱含量最高值作为10,其余8个数值以最高值按比例折算(即:测定值/最高值×10),二者之和记为综合得分。正交试验结果见表3;方差分析结果见表4。
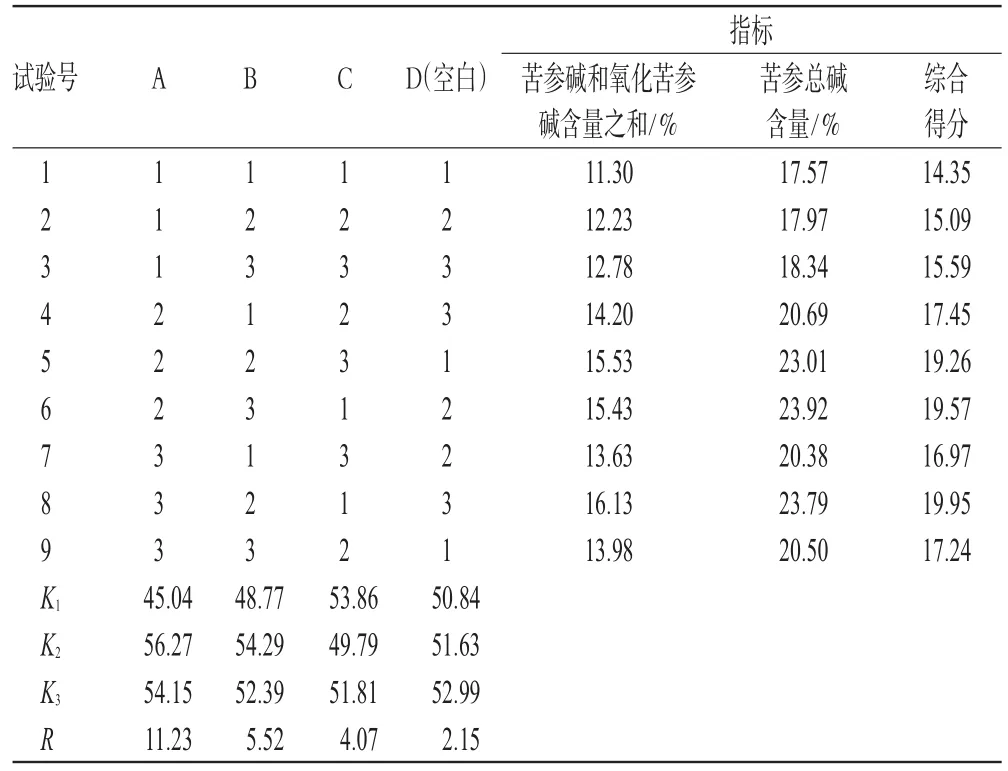
表3 正交试验结果Tab 3 Results of orthogonal experiment
由表3、表4可知,各因素对渗漉提取影响的大小顺序为A>B>C,其中酸水浓度有显著性影响,应选择其最优水平;溶剂用量、渗漉液流速无显著性影响,直观分析优选工艺为A2B2C1。结合工业实际及经验,渗漉速度选择水平1速度太慢,选择水平2即可,故拟定优选工艺为A2B2C2,即药材粗粉以10倍量0.2%的盐酸溶液渗漉,流速为3mL·min-1·kg-1。
2.5.3 工艺验证试验 根据拟定优选工艺条件,准确称取苦参药材200g,共6份,分为A2B2C1组和A2B2C2组,每组3份,按“2.2”、“2.3”项下方法分别测定提取物中苦参碱、氧化苦参碱含量之和及苦参总碱的含量,并进行比较。结果表明,拟定优选工艺与直观分析优选工艺相当。综合考虑,选择A2B2C2,即药材粗粉以10倍量0.2%的盐酸溶液渗漉,流速为3mL·min-1·kg-1。验证试验结果见表5。

表4 方差分析结果Tab 4 Results of variance analysis

表5 验证试验结果Tab 5 Results of validation test
3 讨论
苦参及其制剂为临床常用药,本试验选择苦参作为研究对象具有重要意义。本试验主要考察了苦参的提取工艺,选择多个指标性成分对提取方法进行考察,传统方法中水煎煮法、乙醇回流法和酸水渗漉法对生物碱的提取率相当,但得膏率却有较大差异,影响顺序为水煎煮法>乙醇回流法>酸水渗漉法。这说明,采用水煎煮法和乙醇回流法提取总碱时,会带入大量的杂质,需要进行后续处理方能上柱;而采用酸水渗漉法进行提取时,可以大大减少提取液中的杂质,为后续进一步的精制处理打下基础。
苦参总碱的含量测定多采用酸性染料比色法,生物碱分子中的仲胺及叔胺基团可以和溴甲酚绿在一定pH条件下产生较强的可见吸收,该测定方法吸收值稳定、结果准确。经过笔者测定,最大吸收波长为420nm,与文献报道[4]一致。
参考文献
[1] 国家药典委员会编.中华人民共和国药典(一部)[S].2005年版.北京:化学工业出版社,2005:141.
[2] 郑虎占.中药现代研究与应用[M].北京:学苑出版社,1999:3806.
[3] 王 苑,曾荣仕,朱湛华.RP-HPLC法测定苦参中苦参碱的含量[J].中国药房,2007,18(27):2124.
[4] 孟祥松,时 军.溴甲酚绿比色法测定苦参总碱含量的研究[J].安徽医药,2007,11(1):41.
Optimization of the Extraction Technology of Total Alkaloids from Sophora flavescens by Orthogonal Experiment
CONG Zhu-feng(Shandong Institute of Tumor Prevention Research,Jinan 250117,China)GAO Peng,DAI Long(Shandong University of TCM,Jinan 250355,China)
OBJECTIVE:To optimize the extraction technology of total alkaloids from Sophora flavescens.METHODS:The extraction technology of total alkaloids from S.flavescens was optimized by orthogonal experiment with the concentration of acid water,amount of solvent,velocity of percolation as factors and with the content of matrine and oxymatrine,content of total alkaloids as index.RESULTS:The optimal extraction technology was as follows:10-folds 0.2%hydrochloric acid and the velocity of percolation of 3mL·min-1·kg-1.CONCLUSION:Acid water percolation is simple in operation with high extraction rate.It is suitable for the extraction of total alkaloids.
Sophora flavescens;Total alkaloids;Extraction technology;Orthogonal experiment
R283.2;R284
A
1001-0408(2010)43-4064-03
Δ国家中医药管理局新药开发专项课题(DIX016A)
*主管药师,执业药师,硕士。研究方向:药物制剂及质量控制。电话:0531-67626447。E-mail:congzhufeng@163.com
#通讯作者:副教授。研究方向:中药制剂新技术、新剂型。电话:0531-82860367。E-mail:dailongdailong@263.com
2009-10-11
2010-01-21)
- 中国药房的其它文章
- 正交试验优选二氢青蒿素脂质体的制备工艺

