磷酸钙骨水泥/顺铂复合体理化性能研究
西安交通大学第一附属医院(西安 710061)
刘 娟 刘彦宁
磷酸钙骨水泥(Calcium phosphate cement,CPC)作为一种新型自固化人工骨替代材料的研究正在进行,磷酸钙骨水泥作为药物包括抗生素,成骨因子,肿瘤药物的载体治疗伴随疾病的研究日益受到重视。然而在磷酸钙骨水泥中引入药物这一类外加制剂的研究结果表明,载药骨水泥因加入的药物种类,剂量不同对磷酸钙骨水泥的理化性能影响不同[1,2]。
顺铂是一类广谱抗肿瘤药物,对很多种类肿瘤起到确切的治疗作用,以 CPC为载体复合顺铂制备的局部植入剂可延长其抗肿瘤的作用,可满足对多种敏感实体瘤的治疗。但我们知道CPC是一种强度介于松质骨和皮质骨之间的一种骨替代材料,而 CPC中加入顺铂是否影响其理化性能从而影响其应用。
材料和方法
1 材 料 CPC购自上海瑞邦生物材料有限公司,顺铂购自齐鲁制药有限公司,电子天平为上海精密仪器科学研究所生产,力学测定仪为美国 BIO-MAX公司 MTS858,扫描电镜为JSM-840型。恒温箱则由西安交通大学生物与遗传实验室提供,针戮计为自制。
2 方 法
2.1 CPC/cisplatin复合体的制备:将顺铂与磷酸钙骨水泥固相粉末分别按照质量比为0%,0.05%,0.1%,0.2%,0.4%的比例进行混合并充分混匀,按固液比例1g∶0.3ml的比例加入固化液,三者在室温下调和成糊状后推入直径 4.5mm,高度 10mm的预制模具中,分别制成上述质量比的数个直径 4.5mm,高度10mm的圆柱体,而后置入37℃,湿度 100%的培养箱内继续固化48h后取出,将两断端平行并打磨光滑。同样方法制备无药物磷酸钙骨水泥圆柱体使之直径为4.5mm,高度为10mm。每试样包含顺铂量为0mg,0.125mg,0.25mg,0.5mg,1mg。
2.2 CPC/cisplatin复合体固化时间的测定:称取 CPC和顺铂共计 1g,顺铂与磷酸钙骨水泥质量比分别为0%,0.05%,0.1%,0.2%,0.4%,按固 /液比率为1g∶0.3ml的比例加入固化液,在清洁干燥的中央呈凹形的塑料板上用硬质塑料调拌刀充分调拌均匀,环境温度控制在 23±1℃左右,调和时间 60~90s,将调和物呈膏状体时填充入直径 4.5mm,高度10mm的预制模具中,调和物填充至水准面。从调和结束后第1min把模板放入37℃,相对湿度大于90%的恒温箱中,箱内放置一台压头直径为1mm,压头重量为400G的针戮计。每隔30s小心地把压头垂直降落到调和物表面,停留5s,直至表面不能观察到圆形压痕。从调和结束至调和物表面无圆形压痕的这段时间定为凝固时间,每组测3个试样。
2.3 CPC/cisplatin复合体抗压缩强度的测定:取3个试样,将试样上下两端打平,游标卡尺精确测量每一样本的直径和高度,将其置于实验机平台上并使其刚好接触实验机上下平台,而后施加荷载速度为1mm/min直至出现裂痕,记录极限力量数值,根据下面公式计算压缩强度:C=P/S=(4P)/(л×D2)=P/15.89625(MPa)。在此公式中 C为最大压缩强度(MPa),P为最大有效破坏负荷(N),S为受压缩面积(mm2),D为模块直径(mm)。对上述试样碎裂块留置以用于扫描电镜观察。
2.4 CPC/cisplatin复合体扫描电镜观察分别取各组碎裂样本,粘接在样本板上,真空干燥后,样本表面喷金处理使其具有良好导电性,而后用扫描电镜观察各组样本的显微结构并直接测量其孔径大小。
2.5 CPC/cisplatin复合体孔隙率测定根据排水(乙醇)法[3]来测量样品中的孔隙率。
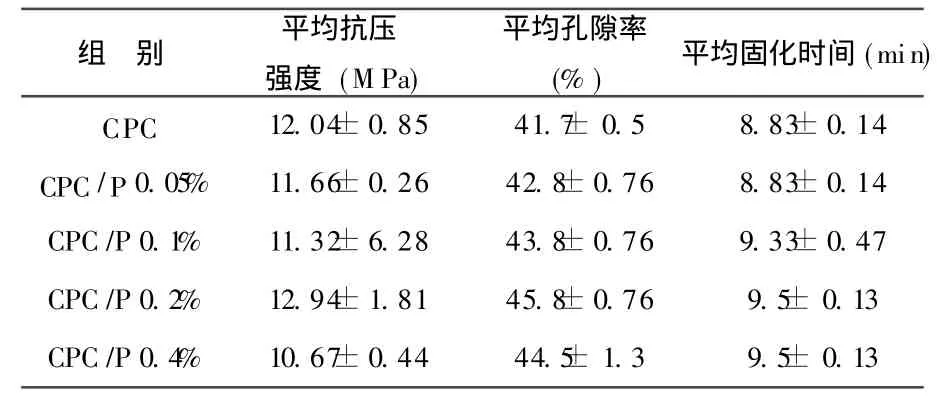
附表 CPC/cisplatin复合体抗压缩强度、孔隙率、固化时间测定

附图 CPC/cisplatin复合体包含不同比例顺铂时扫描电镜图(×2000)
结 果
1 CPC/cisplatin复合体科抗压强度、固化时间测定结果,见附表。从表中可以看出 CPC载入的药物量的比例由 0提高到0.2%时,其平均压缩强度不因所载入药物量的增加而有所降低,反而有所提高,当载入量达 0.4%时,其平均压缩强度有所下降,孔隙率则由最初的42.8%增加到44.5%,固化时间则由8.8 min左右提高到9.5min左右。
2 CPC/cisplatin复合体扫描电镜观察,见附图。从扫描电镜图可以看出,没有复合有顺铂的CPC复合体为一均匀松针样排列,断面粗糙,有许多不同直径大小的不规则缝隙存在,孔径约在2~20μm之间,而复合有顺铂的CPC复合体基本晶体结构没有改变,呈棒状或块状不规则排列,同样具有不规则缝隙相互连通,孔径约在2~20μm之间,而且从图中可以看出 CPC不因所复合药物量的增加其显微结构有明显变化。
讨 论
CPC作为一种理想的骨修复材料在临床上已有报道,但其作为抗肿瘤药物的植入材料的研究虽有报道,主要还是集中于CPC作为抗肿瘤药物的缓释作用、规律的研究[4,5],而对其强度方面的研究少有报道。
CPC与顺铂复合比例比较低时复合体强度改变不明显(P>0.05),认为一方面是与其所复合药物量少有关外,另一方面可能是顺铂填充于CPC属于物理填充,不影响 CPC晶体的形成从而不够成对其强度有所影响。通常认为影响CPC强度的因素很多,其中药物的载入是影响因素之一,Otsuka对此研究很多[6~8],认为CPC中加入药物可影响其强度,但这种改变不影响其行使正常的功能。本研究中加入的顺铂量还没有对CPC的强度构成明显影响。
顺铂载入CPC中同样对其中的孔径、孔隙构成影响,而孔径、孔隙的多少又直接影响 CPC的骨传导活性。孔径过小不利于骨组织的长入,成骨细胞生长所需最低孔径为70μm[9],最佳孔径为200~400μm[10]。本研究中伴随 CPC载入顺铂量比例的增加,孔径在 5-20μm之间,显然这样的孔径不足以容纳骨细胞的直接长入,只有通过外周材料的降解新骨才不断长入。但事实上由于顺铂作为一类化疗药物当其以CPC作为载体而在局部缓释时在杀死肿瘤细胞同时对正常的骨组织亦有损伤,此时孔径的大小相对于顺铂而言作用有限,有关这一方面的研究将在以后的章节中讨论。
固化时间是影响临床应用的一个重要因素,从骨水泥的固化时间上考虑,不但避免了固化时间短造成的水泥调和的困难,也节省了固化时间长所造成的手术时间的浪费。通常而言,当药物的量在一定的范围之内时,加有药物的CPC的固化时间通常不受影响,大约在5~20min之间。研究表明,承载的大部分药物在一定浓度内可满足局部用药的需要并不明显影响CPC的凝结时间。药物复合入CPC的机制有物理填充、化学反应和物理化学作用,其作用机理是由该药物的物理化学性质所决定的。在本组实验中我们所加顺铂占 CPC总体量不是很大,其填充入CPC应属物理填充,此外在我们所研究的药量范围内复合体的固化时间不因所加药物量的不同而有所差别(P>0.05),从而认为本实验中加入的顺铂量没有明显影响 CPC的固化时间,从而认为可满足临床的需要
[1] Dos Santos LA,De Oliverira LC.Influenceof polymeric additives on the mechanical properties of a-tricalcium phosphatecement.Bone,1999,25(2):99-102.
[2] 黄 奥,刘昌胜.妥布霉素对磷酸钙骨水泥性能的影响.中国生物医学工程学报,2001,21(5):417-429.
[3] Li L H,Ding S,Zhou C R.Preparation and degradation of PLA/Chitosan composite materials.Journal of Applied Polymer Science.2004,91:274-277.
[4] 黄 波,范清宇,藩朝晖.自制磷酸钙骨水泥对顺铂缓释作用的动物体内实验.现代肿瘤学,2006,14(8):1007-1009.
[5] Yasuhisa Tahara,Yoshiaki Ishii.Apatite cement containing cis-diamminedichloroplatinum implanted in rabbit femur for sustained release of the anticancer drug and bone formation.JOrthop Sci,2001,6:556-565.
[6] Otsuka M,Matsuda Y,Suwa Y,etal.A novel skeletal drug delivery system using self-setting calcium phosphate cement.2.physicochemical propertics and drug release rate of the cement-containing indomethacin.Journal of pharmaccutical.Sciences,1994,83(5):611-615.
[7] Otsuka M,Matsuda Y,Suwa Y,etal.A novel skeletal drug delivery system using self-setting calcium phosphate cement.Physicochemical propertics and drug release rate of bovine insulin and bovine albumin.Journal of pharmaccutical.Sciences,1994,83(2):255-258).
[8] Otsuka M,Sawada Y,Matsuda T,etal.antibiotic delivery system using bioactive bonecement sonsisting of bis-GM A-TEGDM A resin and bioactive glass ceramics.Biomaterials,1997,18(23):1559-1564.
[9] 郑岳华,侯小妹,杨兆雄.多孔羟基磷灰石生物陶瓷的进展.硅酸盐通报,1995,3:20-28.
[10] Dear-mo Liu.Influence of porosity and pore size on the compressive strength of porous hydroxyapatite ceramic.Ceramics International,1997,23:135-139.

