实时荧光定量 PCR构建朊病相关蛋白 p38MAPK标准品质粒和标准曲线
任 伟,杨利峰,赵德明
(1.北京市兽药监察所,北京 100107;2.中国农业大学动物医学院国家海绵状脑病实验室,北京 100193)
传染性海绵状脑病(TSEs)也称朊病,是由朊病毒引起的人和动物的一组神经退行性疾病,其中包括牛疯牛病(BSE)、人克雅氏病(CJD)和羊痒病(Scrapie)等。TSEs的发病机制目前仍以 Prusnier的朊蛋白学说为主,即体内正常的富含 α-螺旋的PrPC转变成致病性的富含 β-折叠的 PrPSc,并在中枢神经系统聚集而导致疾病的发生[1]。朊病毒病的病理变化主要集中于中枢神经系统(CNS),包括脑海绵状病变、神经元空泡化、神经元丧失、星形胶质细胞增生和小胶质细胞激活[2]。
有丝分裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)是非常保守的丝氨酸/苏氨酸蛋白激酶,是信号转导过程中一组主要的信号分子。迄今已证明该家族有 4个成员,即 ERK12,c-Jun N端激酶,p38MAPK,ERK 5/BMK1。它们存在于各类哺乳动物细胞中,能被多种生长因子、细胞因子及促分裂剂激活。其主要功能为促进细胞增殖和分化的信号传导。p38MAPK是 1993年发现的一类新的 MAPK通路,可以通过对细胞内信号的传递参与细胞对外界许多刺激的调节反应。还能与细胞内其他信号通路之间相互作用,是细胞内信号传递系统的交汇点或共同通路[3]。虽然p38MAPK在朊病中的具体作用仍不十分清楚,但有研究称神经细胞的死亡过程中 p38MAPK可能被激活。
因此,研究朊病感染模型小鼠成神经瘤细胞系N2a中 p38MAPK mRNA的表达进行定量,有助于进一步揭示朊病毒诱导神经细胞凋亡机制。本研究成功构建了实时荧光定量 PCR检测小鼠 N2a细胞 p38MAPK基因表达标准品质粒和标准曲线,为阐释 p38MAPK基因在朊病诱导细胞凋亡过程中的地位和作用奠定分子生物学基础。
1 材料与方法
1.1 实验材料 小鼠神经瘤细胞系 N2a(ATCCCCL-131TM),购自中国科学院细胞生物所;Trizol购自 Invitrogen公司;Reverse Transcriptase M-MLV购自 Promega公司;Trans5a感受态细胞、pEasy-T1、SYBRⓇGreen Realtime PCR Master Mix、2×PCR TaqMix、凝胶回收试剂盒、质粒小量提取试剂盒,均购自北京全式金生物技术有限公司。实时荧光定量 PCR仪,OPTICON2型,MJResearch公司。
1.2 N2a细胞的复苏、培养 取出液氮罐中装有N2a细胞的冻存管立即放入预热至 37℃的水浴中并摇动,使管中细胞悬液融化后低速离心 5min 960 r/m in,离心后弃去冻存液,取 1 mL完全 DMEM加至管中反复吹打,吸出吹打后的液体加至培养瓶中,重复冲洗吹打一次。用含 10%胎牛血清的完全DMEM培养基 4~5 mL调整细胞至所需浓度,37℃、5%CO2、饱和湿度培养。 12~24 h待细胞贴壁后,更换新鲜培养液继续培养。
1.3 细胞总 RNA提取 用 0.1%DEPC水处理所有实验用具(37℃,2 h),塑料器皿高压灭菌,其他用品 180℃干烤 3 h。于 1.5mLEppendorf管总放入约 105细胞,加入 1m L Trizol用振荡器充分振荡混匀,使细胞充分裂解。冰浴 5 min。12 000 r/min离心 5 min,弃上清。加入 350μL氯仿,充分振荡振摇 15秒或上下来回颠倒数次,静置 15 min,12 000 r/m in离心 5min。吸取上层清亮的液相,移取 RNA水相至新的 1.5 mLEppendorf管,加入异丙醇,加入比例为 0.5mL/m LTrizol静置,-20℃静置30 min;4℃离心 12 000 r/min,10min。倒去上清,加入比例为 1m L75%酒精/mL Trizol;充分颠倒,洗涤 RNA沉淀 1次,7 500 r/min离心 10min。小心的吸取管中液体,风干 5~10 min,加入无 RNA酶的 DEPC水 50μL溶解 RNA。参照 MLV反转录酶说明书进行反转录,反转录反应总体系为 20μL。
1.4 小鼠 β-actin、p38MAPK部分基因片段的克隆 利用引物设计软件 Primer Premier5.0,按照已经发表的鼠相应 mRNA序列,分析并设计特异性引物。引物由上海生工生物工程技术公司合成。序列如下:上游 5'-ACTGCCAAGGAGCATCTA-3',下游 5'-GAAGAGCCTGACCTACAGT-3'。以上述反转录产物为模板,反应体系为总体积为 50μL,体系成分为:三蒸水 21μL;2×PCR TaqMix 25 μL;上下游引物各 1μL;cDNA 2μL。参数为:95 ℃,5min;94 ℃,30 s、55℃,30 s、72 ℃,30 s,35个循环;72℃10 min。反应结束后,以 2%(质量分数)琼脂糖凝胶电泳验证扩增产物。
1.5 重组标准质粒制备 按PCR产物回收试剂盒操作说明对 PCR产物进行纯化、回收。按pEASY-T1 Cloning Kit说明书,将纯化产物与pEASY-T1载体连接,连接体系为 5μL,其反应组分为:pEASY-T1克隆载体 1μL、PCR产物 0.5~4μL,加灭菌三蒸水至总体积 5μL,加连接产物于50μL冰浴上融化的感受态细胞轻弹混匀,冰浴 30 min。42℃热激 30 s,立即置于冰上 2min。加 250 μL平衡至室温的 LB培养基,200 r/min,37℃孵育1 h。取 8μL,500 mM IPTG,40μL,20 mg/mL X-gal混合,均匀地涂于准备好的 LB/Amp+培养基平板上,在 37℃放置 30 min。待 IPTG,X-gal被吸收后,取 200μL菌液加到平板上,将细胞均匀涂开,培养过夜。按全式金 PCR产物回收试剂盒操作说明进行提取质粒,并进行质粒 PCR和测序鉴定。
1.6 实时荧光定量 PCR标准曲线的建立及定量分析 使用按照SYBRⓇGreen Realtime PCRMaster Mix的使用说明,将质粒稀释成含有 103~108拷贝 /μL的 6个梯度,定量 PCR仪上扩增,制作标准曲线配制 20μL real-time PCR反应体系,按照下列反应程序(见表 1)进行设定。
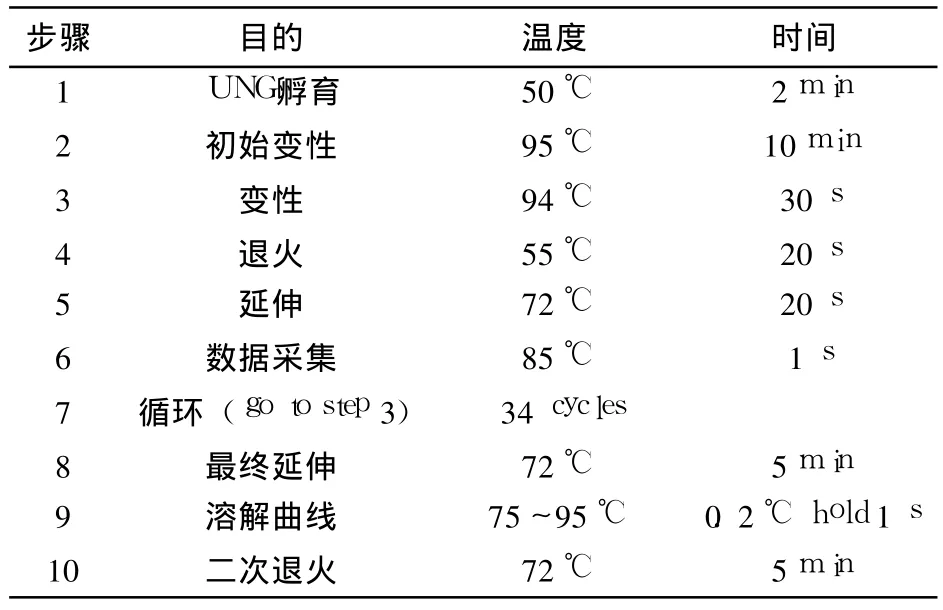
表1 PCR反应程序
2 结果
2.1 p38 MAPK基因扩增重组质粒的构建 以小鼠 N2a细胞的 cDNA为模板,进行 PCR扩增,产物经 2%琼脂糖凝胶电泳,在预期大小处有一特异性条带(图 1),将扩增产物回收、纯化、插入T载体,质粒提取,经 M13通用测序引物进行自动测序后,利用 Blast软件与 GenBank中相应的基因序列进行比对,结果表明,成功的构建了p38MAPK质粒。

图1 p38MAPK PCR扩增目的片段
2.2 标准曲线的建立和直线回归方程的确定 对β-actin、p38 MAPK、DR6重组质粒按照 102~107倍比稀释后,取 1μL各稀释度的质粒为模板进行real-time扩增,系统自动生成标准曲线和回归方程,结果如图 2所示。结果表明,所有曲线回归分析均存在一个高相关系数(r2=0.999),Tm值稳定,峰值单一,没有引物二聚体和非特异性产物的熔解峰,特异性较好。

图2 p38MAPK标准曲线、扩增曲线和溶解曲线
3 讨论
RT-PCR技术是指在 PCR反应体系中加入荧光基团,利用荧光信号累积实时监测整个 PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。该技术以其敏感、特异、污染少、可定量、高通量等优点而倍受青睐,常用的有 TaqMan探针法和 SYBR Green I染料法[4]。
结合染料 SYBR Green I是一种双链 DNA结合染料,与双链 DNA结合后,其荧光增强约 1 000倍,而不掺入链中的 SYBR染料分子仅有微弱荧光信号背景,荧光信号的增加与 PCR产物的增加同步。SYBR Green I染料法的优势在于能监测任何双链DNA序列的扩增,不需设计探针,方法简便,成本低,因此在核酸的检测和定量中广泛应用[5]。
实时荧光定量 PCR准确检测样品的前提是构建重组标准品质粒和制定标准曲线[6]。在探究机体在正常或疾病反应过程中特定蛋白的 mRNA表达量变化已经广泛应用于各类研究中,如检测免疫性渗出或炎症部位细胞因子水平的推断。尽管在结果分析时也要考虑 mRNA水平与蛋白质水平的偏差,但大量文献报道 RT-PCR定量的特定蛋白 mRNA水平与 ELISA测定的该蛋白质有良好的相关性。
朊病中 p38MAPk的作用仍存在争议。通过研究 PrP106-126诱导人神经瘤细胞系 SH-SY5Y细胞凋亡过程中的细胞信号变化发现,PrP106-126可以导致细胞死亡,并激活 caspase-3。p38MAPK的阻断剂可以阻止神经细胞的死亡。这一发现说明神经细胞的死亡过程中 p38MAPK被激活。但 J.Carimalo等人在研究 PrP106-126导致小鼠神经瘤细胞系 N2a的过程中却发现,与 p38MAPK同属于有丝分裂活化酶(JNK)家族中的 c-Jun氮端激酶是导致该神经细胞凋亡的主要受体蛋白,而JNK-c-Jun通路在此过程中起到了至关重要的作用。同时,他还指出 N2a细胞凋亡过程中 p38激酶的作用并不明显。基于本研究可以在分子水平上更好的阐明朊病发病过程中 p38MAPK的功能和作用,更好的揭示朊病的发病机理。
[1] Prusiner S B.Novel Proteinaceous Infectious Particles Cause Scrapie[J].Science,1982,216:136-144.
[2] Prusiner S,M Scott,SDeArmond,et al.Prion Protein Biology-Review[J].Cell,1998,93:337-348.
[3] Stefano Thellunga,Valentina Villaa,Alessandro Corsaro,et al.p38MAPKinase Mediate the Cell Death Induced by PrP106-126 in the SH-SY5Y Neuroblastoma Cells[J].Neurobiology of Disease,2002,(13):69-81.
[4] 温立斌,何孔旺,杨汉春,等猪抗病毒蛋白基因重组质粒实时荧光定量 PCR标准曲线的建立[J].中国农业大学学报,2009,14(2):124.
[5] 王 科,王晓雄,石炳毅.实时荧光定量 PCR在细胞因子 mRNA检测研究中的应用[J].北京生物医学工程,2006,25(002):217-221.
[6] 张太翔,宁章勇,赵德明,等.实时荧光定量 PCR构建奶牛生殖系统 Pr P基因标准品质粒和标准曲线[J].中国农业大学学报,2007,12(2):124.
- 中国兽药杂志的其它文章
- 磷酸泰乐菌素脂质体的制备及体外释放动力学研究
- 宠物与宠物保健品

