桑色素与溶菌酶相互作用的荧光光谱法研究
黄 威,田 皎,赵 楠,张国文,2,*
(1.南昌大学生命科学与食品工程学院,江西南昌330031;2.南昌大学食品科学与技术国家重点实验室,江西南昌330047)
桑色素与溶菌酶相互作用的荧光光谱法研究
黄 威1,田 皎1,赵 楠1,张国文1,2,*
(1.南昌大学生命科学与食品工程学院,江西南昌330031;2.南昌大学食品科学与技术国家重点实验室,江西南昌330047)
在生理酸度(pH7.4)条件下,应用荧光光谱法研究了桑色素与溶菌酶(LYS)相互作用的光谱特性。研究发现,桑色素对溶菌酶的内源荧光产生强烈的猝灭作用,其荧光机理为静态与动态并存的复合猝灭方式。求出了不同温度下桑色素与溶菌酶作用的结合常数和结合位点数。由Van’t Hoff方程式计算了桑色素与溶菌酶反应的热力学参数:焓变(ΔH)和熵变(ΔS)值分别为-30.26kJ/mol和26.76(J/mol·K),表明桑色素与溶菌酶之间的作用力以静电引力为主。根据Förster非辐射能量转移理论,求出了桑色素与溶菌酶色氨酸残基之间的结合距离为4.05nm。同步荧光光谱显示,桑色素使得溶菌酶的构象发生了变化。
桑色素,溶菌酶,荧光光谱,热力学参数
溶菌酶(lysozyme,缩写LYS)是一种广泛存在于生物体内的小分子碱性蛋白,由129个氨基酸残基组成,包含6个色氨酸(Trp)和3个酪氨酸(Tyr)残基,其中Trp-62和Trp-108是最主要的荧光团。溶菌酶是生物体内不可缺少的非特异性体液免疫因子,具有抗菌、消炎、抗病毒等诸多的生理功能[1]。溶菌酶能与许多药物分子结合,从而协同发挥药效。近年来,对药物与溶菌酶相互作用的研究相当活跃[2-4]。桑色素(Morin,结构式如图1)是从黄桑木、桑橙树和许多中草药中提取的一种黄酮类化合物,具有抗氧化、抗炎和抗肿瘤等药理活性[5]。本文采用荧光光谱法研究了生理酸度(pH 7.4)条件下桑色素与溶菌酶的相互作用,测定其动态猝灭常数、结合常数、结合位点数和给体-受体间结合距离,探讨了两者结合主要驱动力的类型和桑色素对溶菌酶构象的影响。该研究为从分子水平上了解桑色素与溶菌酶相互作用机制提供重要信息,为进一步寻求相关新药的发现、食用功能因子的开发等奠定了实验基础。

图1 桑色素的结构式
1 材料与方法
1.1 材料与仪器
桑色素标准品 用无水甲醇配制成3.004× 10-3mol/L溶液,使用时根据所需进行稀释,中国药品生物制品检定所产品;溶菌酶 用0.05mol/L的NaCl溶液配制成7.86×10-5mol/L的贮备液,溶液保存于4℃的冰箱中备用,北京华美生物工程有限公司产品;pH7.4的 Tris-HCl缓冲溶液;0.10mol/L的NaCl;其他试剂 均为分析纯;实验用水 均为二次蒸馏水。
F-4500型荧光光度计 日本日立公司;UV-2450紫外-可见分光光度计 日本岛津公司;pHS-3C型酸度计 上海雷磁仪器厂。
1.2 实验方法
在10mL的比色管中,依次加入2.0mL pH7.4的Tris-HCl缓冲溶液,2.0mL 0.10mol/L的NaCl溶液,128μL 7.857×10-5mol/L的溶菌酶溶液,以二次蒸馏水定容至10mL。准确移取3.0mL该溶液于石英荧光池中,用可调式移液器逐次加入一定体积的桑色素溶液(桑色素的累加体积为90μL),混合均匀并静置5min。在荧光光度计上记录荧光发射光谱和同步荧光光谱。在荧光猝灭实验中,λex=280nm;同步荧光扫描时取Δλ=15nm和60nm(荧光激发和发射狭缝均为5nm)。
2 结果与讨论
2.1 桑色素对溶菌酶荧光的猝灭作用
在溶菌酶结构中,Trp-62和Trp-108是最主要的荧光团,它们位于溶菌酶的底部结合区。当药物分子与溶菌酶发生作用,主要体现在Trp-62残基荧光强度的变化[2]。图2可以看出,固定溶菌酶的浓度,随着溶液中桑色素浓度的不断增加,溶菌酶在344nm左右的内源荧光被逐渐猝灭,并产生一定的蓝移,同时桑色素在510nm附近的荧光强度逐渐增加,而且在449nm处有一个等发射点,这些现象表明,桑色素与溶菌酶之间发生相互作用,使氨基酸残基所处微环境发生变化[6]。
2.2 荧光猝灭机理
一般情况下,产生荧光猝灭作用的原因主要有动态猝灭和静态猝灭[6]。为了进一步阐明荧光猝灭机理,用Stern-Volmer方程对荧光实验数据进行分析:F0/F=1+Kqτ0[Q]=1+Ksv[Q],式中F0和F分别为未加入和加入桑色素时溶菌酶的荧光强度,Kq为双分子猝灭过程速率常数,Ksv为动态猝灭常数,τ0为没有猝灭剂存在下荧光分子平均寿命,生物大分子荧光寿命约10-8s[6],[Q]为桑色素的浓度。作出F0/F-[Q]关系图(见图3),并计算出不同温度下的动态猝灭常数(见表1)。若桑色素对溶菌酶的荧光猝灭机理为单一的动态或静态猝灭方式,F0/F与[Q]间应存在线性关系。由图3可见,猝灭曲线并未表现出线性关系,Ksv随温度升高有降低趋势,表明桑色素对溶菌酶的荧光猝灭机理并非单一的静态猝灭,而是静态和动态猝灭并存的复合猝灭机理[6-7]。
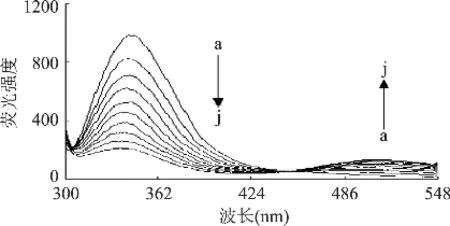
图2 不同浓度的桑色素对溶菌酶荧光光谱的影响
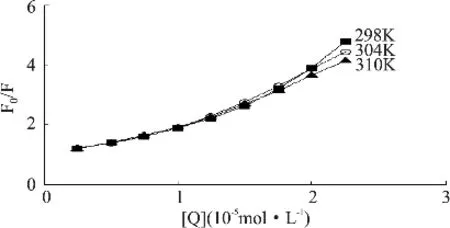
图3 桑色素对溶菌酶荧光猝灭的Stern-Volmer图
2.3 结合常数和结合位点数
有机小分子与生物大分子任一位点发生作用时,体系中发生作用的小分子与未作用的小分子之间处于一种平衡状态,这种平衡关系可以用以下方程描述[8]:lg[(F0-F)/F]=lgK+nlg[Q],式中K为结合常数,n为结合位点数。以lg[(F0-F)/F]对lg[Q]进行一元线性回归,由直线的截距和斜率求得桑色素与溶菌酶作用的结合常数K和结合位点数n,结果列于表1中。结合常数达106量级,表明桑色素与溶菌酶存在较强的结合,温度升高使结合能力稍微减弱,溶菌酶与桑色素间有一个结合位点。
2.4 作用力类型

表1 不同温度下桑色素与溶菌酶作用的猝灭常数Ksv、结合常数K、结合位点数n及热力学参数
有机小分子和蛋白质等生物大分子之间的相互作用力主要有疏水作用力、氢键、范德华力和静电引力等。当温度变化范围不大时,作用过程的焓变随温度的改变可忽略不计,根据热力学参数之间的关系式lgK=-ΔH/2.303RT+ΔS/2.303R(式中K为对应温度下的结合常数,R为气体常数),以lg K对1/T进行一元线性回归,由直线的斜率和截距计算出反应的焓变(△H)和熵变(△S),再由ΔG=ΔH-TΔS计算出结合反应的自由能变(ΔG),结果见表1。Ross[9]总结出小分子与生物大分子反应的热力学参数与主要作用力类型的关系。即当ΔS>0,ΔH>0为典型的疏水作用力;ΔH<0,ΔS<0为氢键和范德华力;当ΔH<0,ΔS>0时,主要存在静电相互作用。由表1可见,ΔG<0,H<0,△S>0,表明桑色素与溶菌酶的作用过程是一个熵增加、Gibbs自由能降低的自发过程,其作用力主要为静电引力。
2.5 构象研究
同步荧光光谱可以提供荧光发色基团附近微环境的变化信息,同步荧光波长Δλ=15nm和60nm时所测得的同步荧光光谱分别为酪氨酸残基和色氨酸残基的光谱特征[10],根据酪氨酸和色氨酸残基同步荧光光谱的变化可得出其微环境的变化,进而可推断蛋白质构象的变化。研究发现,当 Δλ分别为15nm和60nm时,增加桑色素的浓度,酪氨酸残基的最大发射波长发生了轻微的红移(移动了2.4nm),如图4A所示,说明桑色素与溶菌酶的结合使得酪氨酸残基附近微环境的极性增大、疏水性降低[11],而色氨酸残基的最大发射波长没有明显的移动(图4B),表明在结合过程中色氨酸残基附近的微环境没有明显的改变。
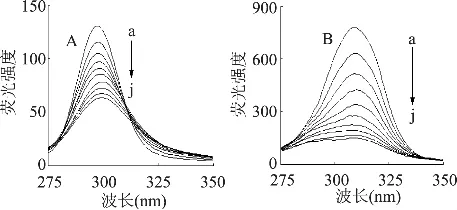
注:cLYS=1.00×10-6mol/L;cmorin=0,0.25,0.50,0.75,1.00,1.25,1.50,1.75,2.00,2.25×10-5mol/L for curves a→j;pH=7.4,T=298K;(A)Δλ=15nm;(B)Δλ=60nm。
2.6 结合距离
由Förster非辐射能量转移理论[12]和能量转移效率E与供能体-受能体间距离r以及临界能量转移距离R0的关系式:E=1-F/F0=R60(/R60+r6);R60= 8.8×10-25K2n-4ΦDJ;J=∑F(λ)ε(λ)λ4Δλ/∑F(λ)Δλ。式中R0为E=50%时的临界距离;K2为偶极空间取向因子,可取供能体-受能体各向随机分布的平均值2/3;n为介质的折射指数,一般取水和有机物折射指数的平均值1.336;ΦD为供能体的荧光量子产率,通常取0.15[13];F(λ)为荧光供能体在波长λ处的荧光强度,ε(λ)为受能体在波长λ处的摩尔吸光系数,J是供能体的荧光发射光谱和受能体的吸收光谱之间的光谱重叠积分。图5为溶菌酶的荧光光谱与桑色素的紫外吸收光谱的重叠图谱。根据上述公式分别求得光谱的重叠积分 J=2.225×10-14cm3· L/mol,R0=2.92nm,E=0.122以及桑色素在溶菌酶中的结合部位距62位色氨酸残基间的距离r =4.05nm。

图5 溶菌酶荧光光谱(a)和桑色素吸收光谱(b)的重叠图谱
3 结论
静态与动态并存的复合猝灭方式是桑色素对溶菌酶的内源荧光产生猝灭作用的主要原因;桑色素与溶菌酶之间存在较强的结合作用,且有一个结合位点,桑色素在溶菌酶中的结合部位距62位色氨酸残基间的距离为4.05nm,静电引力是结合作用的主要驱动力;桑色素与溶菌酶结合使得酪氨酸残基附近的微环境发生了变化,进而导致溶菌酶构象的改变。
[1]朱奇,陈彦.溶菌酶及其应用[J].生物学通报,1998,33(10):9-10.
[2]Wang Z,Li D J,Jin J.Study on the interaction of puerarin with lysozyme by spectroscopic methods[J].Spectrochim,Acta Part A,2008,70:866-870.
[3]Li D J,Zhu J F,Jin J.Spectrophotometric studies on the interaction between nevadensin and lysozyme[J].J Photoch Photobio A:Chem,2007,189:114-120.
[4]张国文,陈秀霞,郭金保,等.荧光法研究橙皮苷、淫羊藿苷与溶菌酶的相互作用[J].光谱学与光谱分析,2009,29(1):184-187.
[5]Fang S H,Hou Y C,Chang W C,et al.Morin sulfates/ glucuronides exertanti-inflammatory activity on activated macrophages and decreased the incidence of septic shock[J].Life Science,2003,74:743-756.
[6]陈国珍,黄贤智,许金钩,等.荧光分析法[M].第二版.北京:科学出版社,1990.
[7]Lakowicz J R.Principles of Fluorescence Spectroscopy,second ed[M].Plenum Press,New York,1999:237-265.
[8]Hu Y J,Liu Y,Wang J B,et al.Study of the interaction between monoammonium glycyrrhizinate and bovine serum albumin[J].J Pharm Biomed Anal,2004,36(4):915-919.
[9]Ross D P,Subramanian S.Thermodynamics of protein association reaction:contributing to stability[J].Biochemistry, 1981,20:3096-3099.
[10]Lakowicz J R,Weber G.Quenching of protein fluorescence by oxygen,detection of structural fluctuations in proteins on the nanosecond time scale[J].Biochemistry,1973,12:4171-4179.
[11]Wang Y Q,Zhang H M,Zhang G C,et al.Interaction of the flavonoid hesperidin with bovine serum albumin:A fluorescence quenching study[J].J Lumin,2007,126:211-218.
[12]杨频,高飞,马贵斌.生物无机化学导论[M].西安:西安交通大学出版社,1991.
[13]Hu Y J,Liu Y,Shen X S,et al.Studies on the interaction between 1-hexylcarbamoyl-5-fluorouracil and bovine serum albumin[J].J Mol Struct,2005,738:143-147.
Study on the interaction of morin with lysozyme by fluorescence spectroscopy
HUANG Wei1,TIAN Jiao1,ZHAO Nan1,ZHANG Guo-wen1,2,*
(1.College of Life Science and Food Engineering,Nanchang University,Nanchang 330031,China;2.State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China)
The spectroscopic character between morin and lysozyme(LYS)was studied using fluorescence spectroscopy under the simulative physiological condition(pH7.4).lt was observed that there was a strong fluorescence quenching reaction of morin to lysozyme,the quenching mechanism was suggested as both static and dynamic quenching for morin-LYS system.The binding constants K and number of binding sites n of morin with lysozyme were obtained by fluorescence quenching method.The thermodynamic parameters of the interaction between morin and lysozyme were measured according to the Van’t Hoff equation.The enthalpy change(△H)and the entropy change(△S)were calculated to be-30.26kJ·mol-1,26.76J·mol-1·K-1respectively,which indicated that the interaction of morin with lysozyme was driven mainly by electrostatic interactions.The binding locality was an area 4.05nm away from tryptophan residue in lysozyme based on Förster nonradiation energy transfer mechanism.The results of synchronous fluorescence spectra showed that the binding of morin to lysozyme induced conformational changes in lysozyme.
morin;lysozyme;fluorescence spectroscopy;thermodynamic parameters
TS201.1
A
1002-0306(2010)11-0088-04
2009-11-04 *通讯联系人
黄威(1987-),男,本科生,研究方向:食品化学。
国家大学生创新性实验计划项目(081040308);江西省自然科学基金项目(2007GZH1924)。

