阿舒假囊酵母摇瓶分批补料发酵产核黄素的研究
刘志文,简 琛,李昆太,2,*
(1.江西农业大学生物科学与工程学院,江西南昌330045;2.南昌市发酵应用技术重点实验室,江西南昌330045)
阿舒假囊酵母摇瓶分批补料发酵产核黄素的研究
刘志文1,简 琛1,李昆太1,2,*
(1.江西农业大学生物科学与工程学院,江西南昌330045;2.南昌市发酵应用技术重点实验室,江西南昌330045)
利用摇瓶分批补料培养模式考察了补料基质对核黄素合成的影响。首先考察了葡萄糖补加浓度对阿舒假囊酵母菌体生长和核黄素合成的影响,结果表明,葡萄糖的补加对阿舒假囊酵母的菌体生长具有促进作用,但是当葡萄糖的补加浓度超过0.5g/100mL发酵液时,会对核黄素的合成产生严重的阻遏或抑制效应。在此基础上,考察了补加不同碳源对核黄素发酵的影响,结果显示,补加1.0g/100mL发酵液的蔗糖或麦芽糖虽然均利于菌体生长,但同样会对核黄素的合成具有负作用。最后考察氮源的补加对阿舒假囊酵母发酵的影响,结果表明,补加酵母膏和玉米浆能显著促进菌体的生长,且二者最终的核黄素合成量分别为1582.1mg/L和1816.77mg/L,均明显高于不补加任何氮源实验方案下的1135.48mg/L。
阿舒假囊酵母,核黄素,生物合成,分批补料发酵
核黄素(riboflavin)又名维生素B2,化学名称为6,7-二甲基-9-(1′-D-ribityl)-异咯嗪,其分子式为C17H20N4O6,相对分子质量为376[1-2]。核黄素是维持机体正常代谢所必需的营养物质,是机体内许多酶系统的重要辅基——黄素腺嘌呤二核甘酸(FAD)与黄素单核甘酸(FMN)的组成成分,参与机体的能量代谢和各种物质代谢。目前,核黄素主要用于防治核黄素缺乏症,如舌炎、口角炎等[3]。近几年来研究表明,核黄素还具有利尿、降血脂和改善心脏功能等作用。由于化学合成法较为复杂且成本高,因此,核黄素主要采用微生物发酵法进行生产[4]。目前广泛应用于工业化发酵产核黄素的菌株主要有阿舒假囊酵母(Eremothecium ashbyii)、棉阿舒囊霉(Ashbya gossypii)。针对阿舒假囊酵母产核黄素的发酵工艺已有一些报道。例如,李嵘等[5]以阿舒假囊酵母为菌株,研究出了摇瓶发酵核黄素过程中碳源、氮源、微量元素、初始pH、接种量和促生因子等发酵条件的优化配方。为了进一步提高核黄素的产量,惠明等[6]提出,适当减少EMP途径的碳架物质流而增加HMP途径的碳架物质与能量的代谢流,将有利于核黄素的过量合成。陆文清等[7]对核黄素的补料发酵进行了研究。分批补料发酵能使营养物质在某个阶段维持在一定浓度,既可保证发酵过程中基质的供给,又可有效地消除某些基质对产物合成所产生的阻遏或抑制效应,因此更有利于菌体生长和产物合成[8]。本论文对阿舒假囊酵母摇瓶分批补料发酵产核黄素进行了初步研究。
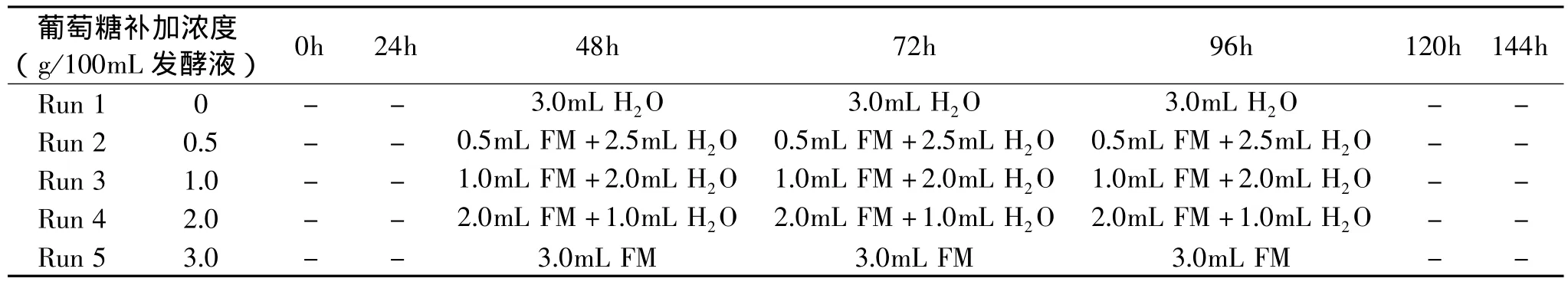
表1 摇瓶分批补料发酵中葡萄糖的具体补料模式
1 材料与方法
1.1 材料与仪器
阿舒假囊酵母(Eremothecium ashbyii) 由本实验室保存;斜面培养基(g/L) 葡萄糖10、蛋白胨10、KH2PO42.0、MgSO41.5、琼脂20,pH 5.6~6.0;种子培养基(g/L) 葡萄糖 30、蛋白胨 15、玉米浆 5、KH2PO41.0、MgSO40.75,pH 5.6~6.0;发酵培养基(g/L) 葡萄糖 50、酵母膏20、玉米浆20、KH2PO42.0、MgSO41.0、NaCl 1.0,pH 6.0~7.5;核黄素标准品上海史瑞可生物科技有限公司;玉米浆、蛋白胨 江西省国药有限公司惠赠;酵母膏 北京奥博星生物技术有限公司;其它试剂 均为国产分析纯。
摇床,可见分光光度计,电子天平等。
1.2 摇瓶培养方法
1.2.1 斜面培养 从-20℃的冰箱中取出保藏好的甘油管菌种,接种于配制好的斜面,置于28℃恒温培养箱培养48h。
1.2.2 种子培养 以无菌水洗下斜面上的菌体,制成菌悬液。取菌悬液2mL接至装量为30mL/250mL三角瓶的种子培养基中,28℃在摇床上振荡(180r/min)培养36h。
1.2.3 摇瓶分批补料发酵 按10%接种量将培养好的种子液接至装量为30mL/250mL三角瓶的发酵培养基中,28℃振荡(180r/min)培养,根据实验方案在发酵过程补加一定量的基质。定时取样测定相关参数,测定结果为三个平行样的平均值。
1.3 分析方法
1.3.1 菌体生物量测定 采用测量菌丝干重法(Dry cell weight,DCW)。吸10mL发酵液至离心管中,5000r/min离心,去上清液,用蒸馏水洗菌体一次,所得菌体80℃烘至恒重后称量。
1.3.2 葡萄糖测定 采用DNS法[9]。
1.3.3 核黄素含量的测定 采用比色法[10]。
2 结果与讨论
2.1 摇瓶分批补料发酵过程葡萄糖补加模式的建立
2.1.1 葡萄糖补加浓度对菌体生长及核黄素合成的影响 为了更精确地从摇瓶培养中获得影响核黄素产量变化的因素,以便从中为阿舒假囊酵母今后工业化发酵工艺的优化提供参考,在摇瓶培养过程中采用了分批补料的培养模式。每个摇瓶分别在第48、72、96h补加补料培养基(FM:300g葡萄糖/L),以补充发酵中后期菌体对基质的需求,使得每次所补加的葡萄糖浓度分别为0、0.25g/100mL发酵液、0.5g/100mL发酵液、1.0g/100mL发酵液、2.0g/100mL发酵液和3.0 g/100mL发酵液。表1为具体的补加方案。
以上5种葡萄糖补加方案下,发酵最终(144h)所得的菌体量以及核黄素产量如图1所示。
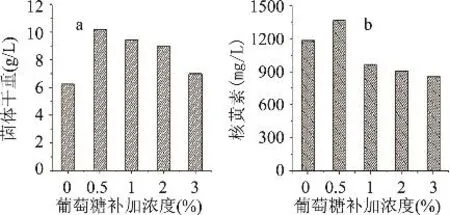
图1 葡萄糖不同补加浓度对菌体生长和核黄素合成的影响
由图1a可以看出,这5种葡萄糖补加方案下最终所得的菌体量分别为 6.2434、10.2052、9.4844、9.0286、6.9881g/L。由此可见,当摇瓶发酵过程不补加葡萄糖,所得的菌体量在所有方案中最低,这可能是由于随着发酵的不断进行因基质缺乏所致。但是,当葡萄糖的补加浓度由0.5%逐渐升高至3.0%,所得的菌体量却呈逐渐下降的趋势,其中3.0%补加方案下所得的菌体仅为6.9881g/L。
由图1b可以看出,这5种葡萄糖补加方案下最终所得的核黄素产量分别为 1179.45、1363.52、958.72、904.48、853.38mg/L。值得注意的是,当补加的葡萄糖浓度超过0.5%(Run 3、Run 4和Run 5),尽管所得的菌体量均高于发酵过程不补加葡萄糖的实验处理(Run 1),但是其核黄素效价却明显低于Run 1方案,而且随着葡萄糖补加浓度的增大,最终核黄素产量呈现下降趋势。这表明,在阿舒假囊酵母发酵产核黄素的过程中,发酵液中1.0%浓度以上的葡萄糖就可能会对核黄素的合成产生阻遏或抑制效应。另外,0.5%浓度的葡萄糖补加方案下所得的核黄素产量达1363.52mg/L,明显高于不补加葡萄糖下的1179.45mg/L,这再次说明通过补加低浓度的葡萄糖,既可保证发酵过程中基质的供给,又可有效地消除高浓度葡萄糖对核黄素合成产生的阻遏或抑制效应,从而在不降低菌体生长的情况下(图1a),不会对核黄素的合成产生负作用。
综合以上结果,在阿舒假囊酵母发酵过程中补加一定量的葡萄糖,对阿舒假囊酵母的菌体生长具有促进作用,但是会对核黄素的合成产生阻遏或抑制效应。因此,如何通过发酵过程葡萄糖的补加来协调菌体生长与核黄素合成是工艺控制的关键点之一。
2.1.2 葡萄糖补加浓度对阿舒假囊酵母发酵过程的影响 为了进一步了解补加葡萄糖对阿舒假囊酵母发酵过程所产生的影响,测定了0%葡萄糖补加浓度(Run 1)、1.0%葡萄糖补加浓度(Run 3)和3.0%葡萄糖补加浓度(Run 5)等方案下,菌体生长、总糖消耗以及核黄素合成的动态变化情况,如图2所示。

图2 葡萄糖补加对阿舒假囊酵母发酵的影响
从图2a可以看出,当发酵过程不补加葡萄糖,随着发酵的进行,发酵液的葡萄糖浓度逐渐降低,到第72h时降低至0.86g/100mL,第96h时已接近于零;Run 3和Run 5实验方案由于在第48、72、96h补加了葡萄糖,因此该培养条件下在第72~144h时的发酵液葡萄糖浓度分别能维持在1.2~1.8、4.7~5.5g/100mL。
从图2b可以看出,当发酵过程不补加葡萄糖(Run 1),菌体生物量在第 96h时达到最大值(8.0030g/L),然而由于未补加营养物质,导致菌体因营养的缺乏而自溶,表现在第96h以后菌体量因自溶反而开始下降,在发酵结束后(144h)菌体干重仅为6.2434g/L。对于补加1%和3%浓度葡萄糖的实验方案(Run 3和Run 5),由于及时补充了营养物质,菌体量在第72~96h时略高于不补加葡萄糖的方案(Run 1)。补加1%浓度葡萄糖实验方案的菌体量在整个发酵过程中逐渐增加,在发酵结束时(144h)菌体干重达到9.48435g/L;然而值得注意的是,补加3%浓度葡萄糖实验方案的菌体量在第96h明显小于补加1%浓度葡萄糖实验方案下的菌体量,且第96h在呈现明显的下降趋势,在发酵结束时(144h)菌体干重仅为6.9881g/L,考虑到这个阶段发酵液中的葡萄糖浓度保持在4.7~5.5g/100mL(图2a),因此可以推断发酵中后期高浓度的葡萄糖抑制了菌体的生长。
由图2c所示三种方案下的核黄素产量动态变化可以看出,和菌体生长趋势稍不同的是,虽然Run 3和Run 5在第48、72、96h补加了葡萄糖,但是这二者在第72~144h期间核黄素的合成量均低于不补加葡萄糖的实验方案(Run 1),而且Run 5的核黄素合成量低于Run 3同期的核黄素合成量。由此可以再次分析得出,尽管补加1%浓度葡萄糖利于阿舒假囊酵母的菌体生长,但是该浓度葡萄糖会对核黄素的合成产生阻遏或抑制作用,而且随着发酵液中葡萄糖浓度的进一步加大,这种负效应更为明显。
综合从以上实验结果(图1和图2)可以推断,高葡萄糖浓度会对核黄素的生物合成产生负作用,而低葡萄糖浓度又会由于基质的缺乏而影响菌体生长,因此为了解决生长与合成之间的矛盾,获得更高的核黄素产量,葡萄糖的限制性补加是一种较佳的选择。本实验所示的0.5%浓度葡萄糖补加方式,即符合这一推论。
2.2 不同碳源的补加对菌体生长及核黄素合成的影响
在发酵生产中,常用的碳源主要有葡萄糖、蔗糖和麦芽糖。为了考察阿舒假囊酵母分批补料发酵过程中更适宜的补料碳源,分别选取了葡萄糖、蔗糖和麦芽糖三种常用碳源,在发酵过程的第48、72、96h分别补加1%浓度的上述碳源物质,最终(第144h)所得的结果如图3所示。

图3 不同碳源的补加对菌体生长(a)及核黄素合成(b)的影响
由图3a可以看出,在发酵过程的第48、72、96h分别补加1%浓度的葡萄糖、蔗糖和麦芽糖均有利于菌体的生长,其最终的菌体干重分别为 9.3217、12.1242、10.8636g/L,其中补加蔗糖方案下所得的菌体量最大,而发酵过程不补加任何碳源最终所得的菌体量仅为6.4152g/L。
由图3b可以看出,补加葡萄糖的方案所合成的核黄素最少,仅为942.58mg/L。而补加蔗糖和麦芽糖方案下的核黄素产量分别为 1143.97mg/L和1139.96mg/L,还略低于CK(发酵过程不补加任何碳源)的1184.29mg/L。
综合以上结果可以分析,尽管在发酵过程补加碳源促进了阿舒假囊酵母的菌体生长,但是在1%补加浓度下,仍然会对核黄素的合成产生一定的抑制作用。这再次说明,为了提高核黄素的产率,发酵过程总糖浓度的控制是一个关键工艺参数。
2.3 氮源的补加对菌体生长及核黄素合成的影响
为了考察氮源的补加对阿舒假囊酵母菌体生长及核黄素合成的影响,在摇瓶分批补料发酵过程中分别在第48、72、96h补加酵母膏和玉米浆,使得每次补加的酵母膏和玉米浆浓度为0.33g/100mL发酵液,最终(第144h)的发酵结果如图4所示。
由图4a可以看出,在发酵过程的第48、72、96h分别补加0.33%浓度的酵母膏和玉米浆,其最终的菌体干重分别为10.0261g/L和7.4770g/L,均高于不补加任何氮源的处理,由此可见,补加有机氮源尤其是酵母膏能促进菌体的生长。与菌体量不同的是,补加酵母膏的实验方案下所得的核黄素产量反而低于补加玉米浆的方案,二者最终的核黄素合成量分别1582.10mg/L和1816.77mg/L(如图4b所示),且均明显高于CK处理下的1135.48mg/L。
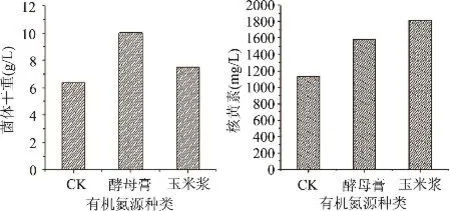
图4 不同氮源的补加对菌体生长及核黄素合成的影响
以上实验结果表明,有机氮源对核黄素的合成具有显著的促进作用。核黄素分子(C17H20N4O6)中含有4个氮原子,因此随着发酵的进行,补加一定的氮源,可能有利于产物的形成。
3 结论
摇瓶分批补料的培养条件和发酵罐中进行的分批补料发酵有一定的差异,但是相对于摇瓶分批发酵而言,摇瓶分批补料培养能更为全面地反映所考察的因素对菌体代谢的影响,尤其是能为发酵罐中的工艺调控提供更为客观、有效的信息。因此,本论文对阿舒假囊酵母摇瓶分批补料发酵产核黄素进行了初步研究。
3.1 考察了葡萄糖补加浓度对阿舒假囊酵母菌体生长和核黄素合成的影响,结果表明,葡萄糖的补加对阿舒假囊酵母的菌体生长具有促进作用,但是当葡萄糖的补加浓度超过0.5g/100mL发酵液时,会对核黄素的合成产生严重的阻遏或抑制效应。
3.2 考察了补加不同碳源对核黄素发酵的影响,结果显示,补加1.0g/100mL发酵液的蔗糖或麦芽糖虽然均利于菌体生长,但同样会对核黄素的合成具有负作用。
3.3 考察氮源的补加对阿舒假囊酵母菌体生长及核黄素合成的影响,结果表明,补加酵母膏和玉米浆能显著促进菌体的生长,且二者最终的核黄素合成量分别1582.10mg/L和1816.77mg/L,均明显高于不补加任何氮源实验方案下的1135.48mg/L。
[1]张会图,姚斌,范云六.核黄素基因工程研究进展[J].中国生物工程杂志,2004,24(12):32-38.
[2]Boris I,Wolfgang E,Nicholas S,et al.Biosynthesis of Vitamin B2[J].J Biol Chem,2005,31:28541-28546.
[3]项昭保,戴传云,朱蠡庆.核黄素生理生化特性及其功能[J].食品研究与开发,2004,25(12):90-95.
[4]仪宏,朱文正,张华峰.核黄素生产技术发展[J].中国食品添加剂,2003(4):14-17.
[5]李嵘,余俊红,吴佩琮,等.发酵法制核黄素[J].无锡轻工大学学报,1997,16(1):14-18.
[6]惠明,孙俊良,张星元.Ecemothecium ashbyii T30过量合成核黄素发酵工艺条件研究[J].饲料研究,2000(3):13-16.
[7]陆文清,章克昌,吴佩琮.核黄素产生菌的补料发酵[J].无锡轻工大学学报,2000,19(3):240-243.
[8]叶勤.发酵过程原理[M].北京:化学工业出版社,2005.
[9] Miller GL.Use ofdinitrosalicylic acid reagentfor determination of reducing sugar[J].Analytical Chemistry,1959,31(3):426-428.
[10]黄伟坤,等.食品检验与分析[M].北京:轻工业出版社,1989.
Study on the shake-flask fed-batch fermentation of riboflavin by Eremothecium ashbyii
LIU Zhi-wen1,JIAN Chen1,LI Kun-tai1,2,*
(1.College of Biological Science and Technology,Jiangxi Agricultural University,Nanchang 330045,China;2.Nanchang Key Laboratory of Applied Fermentation Technology,Nanchang 330045,China)
The components of feeding medium were investigated by the shake-flask fed-batch cultivation of Eremothecium ashbyii.Firstly,the effects of various concentrations of glucose feeding on cell growth and riboflavin biosynthesis were performed.The results showed that glucose feeding could accelerate the cell growth,but the concentration of glucose feeding above 0.5g/100mL would cause lower production of riboflavin.Secondly,the study of various carbon sources on the fermentation of E.ashbyii revealed that,1.0g/100mL of sucrose or maltose had a positive effect on cell growth,and had a negative influence on riboflavin biosynthesis.Finally,the effects of nitrogen sources on the cell growth and riboflavin biosynthesis by E.ashbyii were conducted.The results showed that yeast extract and corn steep liquor could not only stimulate the cell growth,but also had a positive effect on riboflavin biosynthesis.The final riboflavin production under yeast extract or corn steep liquor feeding was 1582.1mg/L and 1816.77mg/L,respectively,which were significantly higher than that obtained without nitrogen feeding(1135.48mg/L).
Eremothecium ashbyii;riboflavin;biosynthesis;fed-batch cultivation
TS201.2+4
A
1002-0306(2010)12-0214-04
2009-05-07 *通讯联系人
刘志文(1967-),女,本科,实验师,从事微生物研究。

