苯胺-2,4-二氨基酚共聚物吸附水中Hg(Ⅱ)的动力学和热力学研究*
胡秋婵 王 宁 符 浩 孙 立 沈立锋 翟建平**
(1.南京大学环境学院,污染控制与资源化研究国家重点实验室,南京,210046;2.南阳市环境监测站,南阳,473060)
苯胺-2,4-二氨基酚共聚物吸附水中Hg(Ⅱ)的动力学和热力学研究*
胡秋婵1王 宁2符 浩1孙 立1沈立锋1翟建平1**
(1.南京大学环境学院,污染控制与资源化研究国家重点实验室,南京,210046;2.南阳市环境监测站,南阳,473060)
利用化学氧化法合成苯胺-2,4-二氨基酚共聚物,通过静态吸附实验研究了该共聚物吸附水中汞离子的动力学和热力学.对实验数据采用准一级和准二级动力学方程、Langmuir等温线方程、Freundlich等温线方程进行拟合,并进行相应的热力学分析.研究结果表明,苯胺-2,4-二氨基酚共聚物对水中Hg(Ⅱ)具有很好的去除效果,最大吸附容量达800 mg·g-1,吸附等温线符合Langmuir单层吸附模型;动力学过程符合准二级动力学模型;吸附焓变化量ΔH=58.51 kJ·mol-1,表明该吸附反应为化学吸附且为吸热反应;三种实验温度下吉布斯自由能变化量均为负值,表明该吸附反应能自发进行.
苯胺-2,4二氨基酚共聚物,汞离子,动力学,热力学.
汞是毒性最强的水体重金属污染物之一,被美国环境保护局列为优先污染物[1].环境中任何形式的汞均可在一定条件下转化为剧毒的甲基汞,甲基汞进入人体后主要侵害神经系统,尤其是中枢神经系统,著名的日本水俣病就是甲基汞引起的.自工业革命以来,汞在全球大气、水和土壤中的含量已增加了3倍左右,工业区附近汞的含量更高,汞污染的不断加剧对人类健康和环境造成极大危害,在全球产生了重大的不利影响.
汞处理的传统方法有膜分离、还原法、离子交换、化学沉淀、反渗透和吸附法等[2-3],其中吸附法以操作简单、经济实用的优点备受研究者关注.活性炭、聚合物、硅酸盐、生物质及其它粘土、有机质已被用于去除水中汞离子,但都存在吸附效果不佳、水化学条件适应性不强等问题.高分子聚合物对于重金属离子具有较好的去除效果,有望成为新型的重金属吸附剂.LU等人采用苯胺和磺酸苯二胺的共聚物吸附去除水样中的无机汞[4].王静等人采用聚苯胺吸附去除水溶液中汞离子取得了很好的效果[5].在此基础上,进一步研究吸附机理、改进材料性能、提高吸附能力,研发高效的吸附材料具有很强的实际应用价值.
最近本研究组合成了一种新的共聚物(苯胺-2,4-二氨基酚共聚物)[6],该共聚物合成产率高(>95%),性能稳定,各种水化学条件下无苯胺和2,4-二氨基酚溶出,不会造成二次污染.本文着重研究了该共聚物在静态吸附实验条件下对水中Hg(Ⅱ)的吸附特性,以及温度、离子强度等因素对动力学和热力学的影响.
1 实验部分
1.1 苯胺-2,4-二氨基酚共聚物(PANDAP)的合成
苯胺单体(AR)为上海国药集团生产,经过二次蒸馏提纯.含汞离子溶液由购自Sigma-Aldrich公司的Hg(NO3)2·H2O(纯度为99%)配置而成,硝酸(优级纯)、盐酸(优级纯)购自南京化学试剂有限公司,其它试剂购自上海国药集团,实验中水溶液均由电阻率为18.25 mΩ·cm的超纯水配制.
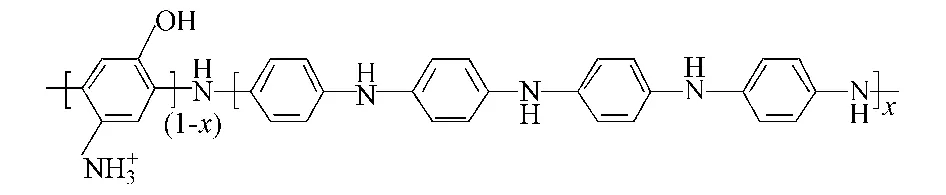
将苯胺单体和硫酸溶于超纯水中,在搅拌条件下加入2,4-二氨基酚,其中苯胺、硫酸和2,4-二氨基酚的浓度分别为 0.2 mol·l-1、1.0 mol·l-1、16 mmol·l-1,混匀后室温下磁力搅拌 20 min 后加入 0.28 mol·l-1的过硫酸铵氧化剂,反应8h.得到的产物用超纯水洗净、抽滤直至滤液无色后在102℃真空干燥箱中干燥8h,研成粉末待用.所得共聚物化学结构如下:
1.2 PANDAP对水中Hg(Ⅱ)的吸附
准确称取一定量的Hg(NO3)2·H2O,用超纯水配成[Hg2+]=1000 mg·l-1的储备液,滴加适量的HNO3,用时进行稀释.在50 ml的聚乙烯螺口离心管中,加入10 mg苯胺-2,4-二氨基酚共聚物吸附剂,再加入40 ml稀释后的汞溶液,混匀后置于控温振荡培养箱(150 r·min-1)中平衡24h,再用0.45 μm滤膜过滤,上清液中汞离子浓度用原子荧光检测.实验中pH值用HNO3与NaOH溶液调节,离子强度用NaNO3调节.
2 结果与讨论
2.1 吸附剂用量的影响
图1为吸附剂苯胺-2,4-二氨基酚共聚物的用量与去除率及吸附容量的关系(初始浓度C0=50 mg·l-1,pH=5.5,离子强度 0.1 mol·l-1NaNO3).由图1 可见随着吸附剂用量的增加,苯胺-2,4-二氨基酚共聚物对水中Hg(Ⅱ)的去除率升高,同时吸附容量随之降低.吸附剂用量在0.125—0.25 g·l-1之间时去除率迅速升高,之后汞离子的去除率逐渐趋于稳定.开始时去除率的升高是因为随着吸附剂量的增加,对水中Hg(Ⅱ)起吸附作用的表面积增大,之后更多吸附剂的增加对于吸附效果没有明显影响则是因为相对于汞离子而言吸附剂已经足量,从而导致吸附剂的利用率降低.最终确定实验的吸附剂用量为0.25 g·l-1.

图1 吸附剂用量对苯胺-2,4-二氨基酚共聚物吸附汞离子的影响Fig.1 Effect of adsorbent dose on Hg(Ⅱ)adsorption by poly(aniline-co-2,4-diaminophenol)
2.2 吸附时间及温度对共聚物吸附汞离子的影响
图2为不同温度条件下共聚物对汞离子的吸附动力学(初始浓度C0=50mg·l-1,pH=5.5,离子强度0.1 mol·l-1NaNO3).如图2所示,苯胺-2,4-二氨基酚共聚物吸附水中Hg(Ⅱ)在2h内去除效果达到80%以上,在10h内达到平衡.随着温度的升高,共聚物对汞离子的去除率随之提高,298 K、308K、318K的汞离子的去除率分别为92.5%、95.8%、98.3%,这说明该吸附过程为吸热反应.推测苯胺-2,4-二氨基酚共聚物对汞离子的吸附机理主要为:共聚物含有大量的含氮官能团氨基,而氨基中氮原子提供的孤对电子可以与汞形成较强的络合物[7],氨基对汞离子具体吸附机理如下所示:


图2 吸附反应时间和温度对Hg(Ⅱ)吸附的影响Fig.2 Effect of adsorption time and temperature on adsorption of Hg(Ⅱ)
2.3 吸附等温线及离子强度对吸附的影响
研究了三种不同离子强度条件下共聚物对水中Hg(Ⅱ)的吸附效果.对所得结果分别进行Langmuir和Freundlich方程拟合,拟合参数见表1.可以看出苯胺-2,4-二氨基酚共聚物对于水中Hg(Ⅱ)的吸附符合Langmuir等温线方程.也就是说,汞离子在共聚物表面的吸附主要是单层吸附,与该共聚物对水中Hg(Ⅱ)的吸附主要是依靠含氮官能团与汞离子发生表面络合的假设是一致的.

表1 苯胺-2,4-二氨基酚共聚物吸附等温线的Langmuir和Freundlich拟合参数Table 1 Langmuir and Freundlich parameters of Hg adsorption isotherms on poly(aniline-co-2,4-diaminophenol)
图3 是对不同离子强度(三种离子强度分别为 0.01,0.1,1mol·l-1的 NaNO3溶液,pH=5.5)下共聚物对水中Hg(Ⅱ)的吸附等温线.结果表明随离子强度的提高,PANDAP共聚物对汞离子的最大吸附量提高.在离子强度分别为 0.01、0.1、1 mol·l-1时,最大吸附容量从 600mg·g-1左右增加到 800 mg·g-1左右.与活性炭、碳酸盐等一般吸附剂相比具有更好的吸附效果,比苯胺和磺酸苯二胺的共聚物(最大吸附容量为 497.9mg·g-1)[4]及聚苯胺(最大吸附容量为 600mg·g-1)[5]等高聚物吸附材料的最大吸附容量也高.
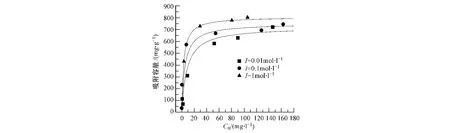
图3 离子强度对共聚物吸附性能的影响Fig.3 Adsorption isotherms of Hg(Ⅱ)on poly(aniline-co-2,4-diaminophenol)at three levels of ionic strength
一般认为,离子强度的增加使得更多的硝酸根阴离子迁移至亚胺态N正电中心,降低了溶液和共聚物表面的电势,使共聚物接收质子的能力增加,即抑制了脱质子化反应的发生,从而减少了活性吸附位点的数量[8],从而会抑制氨基对汞离子的吸附.然而本研究多次重复实验均表明,随离子强度的提高,PANDAP共聚物对汞离子的最大吸附量提高.说明共聚物对于处理高盐度含汞废水具有潜在应用价值,但其具体机理有待进一步研究.
2.4 共聚物吸附水中Hg(Ⅱ)动力学和热力学研究
对图2中数据分别进行准一级和准二级动力学方程拟合,参数见表2,准二级拟合所得吸附平衡时的吸附容量Qe与实测值较为接近,而且线性相关系数R2更接近于1,可见该共聚物对于水中Hg(Ⅱ)的吸附动力学符合准二级动力学方程,该吸附过程主要受化学吸附控制[9].

表2 准一级和准二级动力学方程拟合参数Table 2 Adsorption kinetic parameters of Hg on poly(aniline-co-2,4-diaminophenol)
根据热力学公式计算共聚物吸附水中Hg(Ⅱ)的熵变化量ΔS=235.84kJ·mol-1·K-1,吸附焓变化量ΔH=58.51 kJ·mol-1,正的焓变表明该吸附反应为吸热过程,其绝对值在 20.9—418.4kJ·mol-1之间,表明该吸附过程为化学吸附[9].在三种温度下吸附自由能的变化量ΔG分别为-9.67、-11.58、-14.41 kJ·mol-1,负的吸附自由能变化量表明该吸附反应能自发进行.
3 结论
苯胺-2,4-二氨基酚共聚物对水中Hg(Ⅱ)具有很好的去除效果,最大吸附容量达800 mg·g-1,且随离子强度的提高,最大吸附量也提高,这将使其在高盐度废水、高盐地下水等处理中具有独特优势.吸附等温线符合Langmuir单层吸附模型,表明其吸附机理主要是含氮官能团与汞离子发生表面络合.该吸附反应为化学吸附且为吸热反应,反应能自发进行.苯胺-2,4-二氨基酚共聚物在处理含汞废水方面将具有良好的应用前景.
[1]Cameron R E.Guide to site and soil description for hazardous waste site characterization.Volume 1:Metals[M].U.S.Environmental Protection Agency:Washington,DC,1992
[2]Nam K H,Gomez-Salazar S,Tavlarides L L.Mercury(Ⅱ)adsorption from wastewaters using a thiol functional adsorbent[J].Ind Eng Chem Res,2003,42∶1955-1964
[3]Aguado J,Arsuaga J M,Arencibia A.Adsorption of aqueous mercury(Ⅱ)on propylthiol-functionalized mesoporous silica obtained by cocondensation[J].Ind Eng Chem Res,2005,44∶3665-3671
[4]Lu Q F,Huang M R,Li X G.Synthesis and heavy-metal-ion sorption of pure sulfophenylenediamine copolymer nanoparticles with intrinsic conductivity and stability[J].Chem-A Euro J,2007,13∶6009-6018
[5]Wang Jing,Deng Bao Lin,Chen Huan,et al.Removal of aqueous Hg(Ⅱ)by conductive polyaniline:sorption characteristics and mechanisms[J].Environ Sci Technol,2009,43∶5223-5228
[6]Zhang Ya,Mu Shaolin,Zhai Jianping.Nanostructured poly(aniline-co-2,4-diaminophenol)synthesized via chemical copolymerization and the properties of the resulting copolymer[J].Synthetic Metals,2009,159∶1844-1851
[7]Guerra D L,Airoldi C,Viana R R.Performance of modified montmorillonite clay in mercury adsorption process and thermodynamic studies[J].Inorg Chem Commun,2008,11∶20-23
[8]Kang E T,Neoh K G,Tan K L.Polyaniline:A polymer with many interesting intrinsic redox states[J].Prog Polym Sci,1998,23∶277-324
[9]Abhijit Maiti,Sunando DasGupta,Jayant Kumar Basu,et al.Batch and column study:adsorption of arsenate using untreated laterite as adsorbent[J].Ind Eng Chem Res,2008,47∶1620-1629
KINETICS AND THERMODYNAMICS OF Hg(Ⅱ)ADSORPTION ONTO POLY(ANILINE-CO-2,4-DIAMINOPHENOL)
HU Qiuchan1WANG Ning2FU Hao1SUN Li1SHEN Lifeng1ZHAI Jianping1
(1.State Key Laboratory of Pollution Control and Resource Reuse,School of Environment,Nanjing University,Nanjing,210093,China;2.Environmental Monitoring Station of Nanyang,Nanyang,473060,China)
A batch method was used to investigate the kinetics and thermodynamics of Hg(Ⅱ)adsorption onto poly(aniline-co-2,4-diaminophenol)synthesized by chemically oxidative polymerization,where the Lagrangian pseudo-first-order and pseudo-second-order kinetic model, Langmuir, Freundlich isotherm models were applied to simulate the experimental parameters.The results show that mercury adsorption isotherm onto poly(aniline-co-2,4-diaminophenol)is well described by Langmuir model and the adsorption can be approximated more favorably by the pseudo-second-order model,and the Qmaxis 800 mg·g-1at pH 5.5,with ion strength 1mol·l-1NaNO3.The calculated thermodynamic parameters(ΔG,ΔH and ΔS)show that the adsorption of Hg(Ⅱ)onto poly(aniline-co-2,4-diaminophenol)is feasible,endothermic and spontaneous.
poly(aniline-co-2,4-diaminophenol),mercury ion,adsorption kinetics,thermodynamics.
2009年11月24日收稿.
*南京大学研究生创新基金资助(2010CL07).
**通讯联系人,Tel:025-83592903;E-mail:jpzhai@nju.edu.cn

