典型蛋白质折叠中阳离子-π相互作用的特异性
乔 辉 李晓琴 徐海松 孔令强 彭 宇
(北京工业大学生命科学与生物工程学院,北京 100124)
典型蛋白质折叠中阳离子-π相互作用的特异性
乔 辉 李晓琴*徐海松 孔令强 彭 宇
(北京工业大学生命科学与生物工程学院,北京 100124)
蛋白质中的阳离子-π相互作用是带正电荷的氨基酸(Lys、Arg)和芳香族氨基酸(Phe、Tyr、Trp)之间的一种作用力.对α/β类蛋白中两种典型折叠类型(单绕和双绕)的研究表明:(1)单绕结构中阳离子-π相互作用的分布密度大约是双绕结构中的2.6倍;(2)在单绕结构中,样本所含氨基酸残基数量与样本中阳离子-π的数量有明显的相关性,在双绕结构中没有发现类似的相关性;(3)Lys、Arg与Tyr在单绕中比在双绕中更容易形成阳离子-π相互作用;(4)Arg-Tyr组合在单绕中出现的几率较大,Arg-Phe组合在双绕中出现的几率较大;(5)阳离子-π相互作用在65%的单绕样本中形成阵列或分布在结构的首尾间.
单绕; 双绕; 阳离子-π相互作用; 特异性
阳离子-π相互作用是存在于阳离子和芳香性体系之间的一种相互作用力[1-3],属于非键相互作用. 1981年Sunner等[4]从实验上证实了阳离子-π在气相中是一种显著的相互作用,但阳离子-π相互作用在凝聚态及液态环境中得到证实并定量研究之后,作为一种重要的非键相互作用才逐渐被人们重视[1].
在现代结构生物学中,阳离子-π相互作用也是一种重要的非键相互作用[5-6].作为神经递质的乙酰胆碱(Ach)和乙酰胆碱酯酶(AchE)就是通过阳离子-π结合的[7].2009年Dougherty等[8]在Nature上发表文章指出尼古丁与大脑中的乙酰胆碱受体就是通过阳离子-π结合从而使人产生烟瘾的.
在组成蛋白质的氨基酸中,带正电荷的氨基酸Lys、Arg可以和芳香族氨基酸Phe、Tyr、Trp形成阳离子-π相互作用,如图1所示.阳离子-π相互作用主要是静电作用引起的[1-3],在一级近似下可以看作是正电荷和电四极矩之间的吸引力[9].在蛋白质结构的稳定性研究中,相对于氢键、离子键以及疏水作用这些常规的相互作用,阳离子-π相互作用没有得到充分的重视,但有关阳离子-π相互作用对蛋白质稳定性的研究报道在增加[10-21].
有研究表明,阳离子-π相互作用对于维持跨膜螺旋(TMH)蛋白和跨膜折叠(TMS)蛋白的结构稳定性有重要作用,并且阳离子-π相互作用在TMS蛋白和TMH蛋白中的分布情况有很明显的不同[11];人们在蛋白质与蛋白质接触界面上发现存在大量由Arg参与的阳离子-π相互作用的存在[12];在人类生长激素受体(PDB:3HHR)的胞外结构域中有阳离子-π相互作用阵列(Lys-Tyr-Arg-Phe-Arg-Trp-Lys)的存在[13];在α-淀粉酶抑制剂中存在高度保守的阵列(Trp-Arg-Tyr)[14].此外,阳离子-π相互作用对于DNA结合蛋白[15-16]、RNA结合蛋白[17-18]、治疗性蛋白[19]、延长因子蛋白[20]以及DNA-蛋白质复合物[21]等的结构稳定性都有重要作用.
本文通过对两种典型蛋白质折叠类型(单绕和双绕)中阳离子-π相互作用的对比分析,将有助于理解阳离子-π相互作用在维持蛋白质空间结构稳定性方面的作用,为相关蛋白质的设计提供理论指导.

1 材料和方法
1.1 材 料
从SCOP数据库下的Astrall.65[22]中选取了样本间序列相似度小于25%的149个全部单绕结构样本和79个全部双绕结构样本,利用CAPTURE程序[23]计算阳离子-π相互作用信息,得到信息完整可用的样本103个,其中包括66个单绕、37个双绕.
单绕和双绕是α/β类蛋白中两种典型的折叠类型.单绕是“单绕平行β筒”(singly wound parallel βbarrel),它由8个βα二级结构单元首尾连接而成,序列上紧邻的β单元在空间上也紧邻排列,即β1β2β3β4β5β6β7β8,βkαkβk+1(k=1-7)间满足右手螺旋关系,蛋白质头部的β1与处于蛋白质尾部的β8空间紧邻,形成筒状结构,拓扑结构如图2所示.双绕是“双绕平行β片”(doubly wound parallel β-sheet),平行β片由3-8个不等的βα二级结构单元组成,其中由6个β单元连接、β片层对称排列、β1与β4空间紧邻的双绕结构最为典型,通常成为“ROSSMANN”折叠,6个β单元的排列方式为;β3β2β1β4β5β6,βkαkβk+1(k=1-5)间满足右手螺旋关系,空间拓扑结构如图3所示.
1.2 参数定义
第i种氨基酸的组分comp(i)为
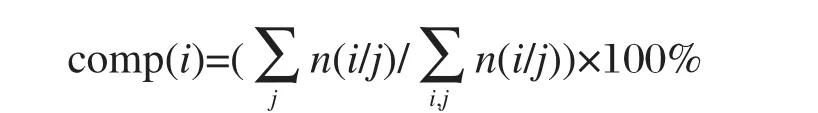
上式中n(i/j)代表第j个蛋白样本中氨基酸i出现的频次,i=1-20,j=1-103(j=1-66为单绕,j=67-103为双绕),以下类同.
第i种氨基酸参与阳离子-π相互作用的参与率compπ(i)为
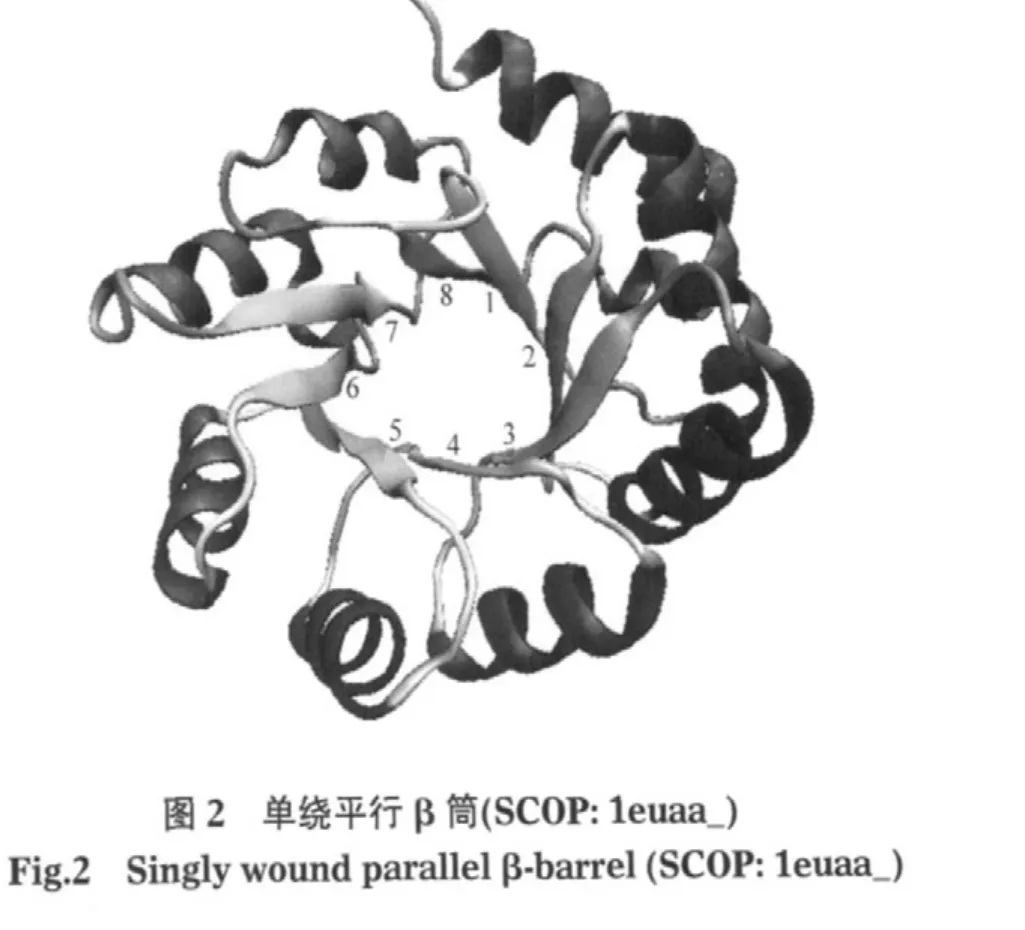


式中nπ(i/j)代表第j个蛋白样本中氨基酸i参与阳离子-π作用的频次.
样本j的氨基酸残基总量N(j)为

1.3 阳离子-π相互作用的判别准则
蛋白质结构中,带正电荷的氨基酸和芳香族氨基酸之间形成阳离子-π相互作用的判别依据是几何准则和能量准则[5].几何准则是:所有的阳离子和π体系之间的距离在1 nm内,并且二者之间在最近接触距离上形成的缝隙不能大到能插入一个水分子;能量准则是:当Ees≤-8.36 kJ·mol-1,或-8.36 kJ· mol-1<Ees≤-4.18 kJ·mol-1且同时满足EvW≤-4.18 kJ·mol-1,则判定阳离子和π构成一个阳离子-π相互作用,其中Ees为静电能,EvW为范德华力能.
CAPTURE程序是结合OPLS力场[24-25]和量子力学从头计算(HF/6-31G**)建立起来的[5].依据上述判别准则,在给定PDB-ID号或蛋白质空间结构信息的条件下,程序CAPTURE可以在线计算并返回蛋白质结构中有效的阳离子-π相互作用信息.
2 结果及分析
2.1 不同折叠中阳离子-π相互作用的特点
对任一蛋白样本j,利用CAPTURE程序可以得到该样本中阳离子-π相互作用的信息,对该信息进行处理可以得到:样本j的阳离子-π相互作用的数量Nπ(j)、样本j的氨基酸残基总数N(j)、阳离子-π相互作用的分布位置等信息,部分数据列于表1.
阳离子-π相互作用的分布密度定义为Nπ(j)/ N(j),表示平均每个氨基酸残基中包含的阳离子-π相互作用数目,该值越大代表密度越大.表2中分别列出了单绕和双绕折叠结构中阳离子-π相互作用的数量均值Nπ(j)、氨基酸残基总数均值N(j)和分布密度的数值.从表2可以看到;单绕中阳离子-π相互作用的分布密度为1.51%,双绕中阳离子-π相互作用的分布密度为0.58%,单绕远远大于双绕.
对表1中单绕和双绕中氨基酸残基的数量N(j)和阳离子-π的数量Nπ(j)的相关统计分析显示:单绕中N(j)与Nπ(j)有较好的相关性,相关系数R为0.68;双绕中N(j)与Nπ(j)没有明显的相关性,相关系数R为0.05.
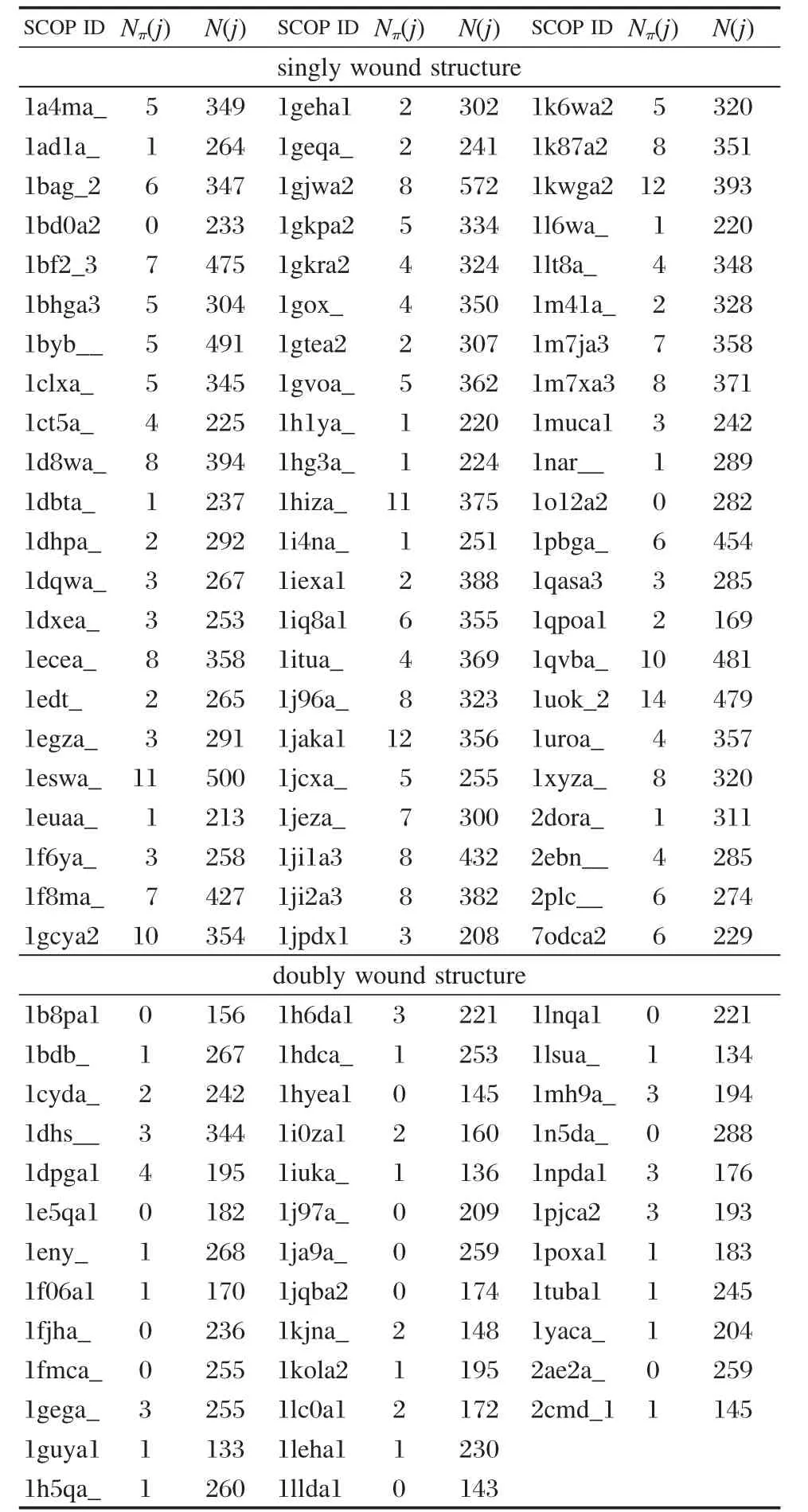
表1 阳离子-π相互作用的分布Table 1 Distribution of cation-π interactions

表2 典型蛋白质折叠中阳离子-π相互作用的特异性Table 2 Specificity of cation-π interactions in typical protein folds
2.2 阳离子-π相互作用中5种氨基酸的参与率
根据1.2节中氨基酸组分comp(i)及氨基酸参与阳离子-π的参与率compπ(i)的定义,表3中分别列出了单绕和双绕中参与阳离子-π的5种氨基酸的上述参数信息.
从组分上看,Lys、Arg、Phe、Tyr和Trp的组分在单绕和双绕中均依次降低,三种芳香族氨基酸中Trp的组分明显偏低.
在单绕和双绕中,氨基酸Trp参与阳离子-π的的参与率都是最高的,分别达到24.25%和24.00%,大约每4个Trp中就有一个参与阳离子-π相互作用的形成.Trp在单绕和双绕中参与率之比为1.01,接近1,说明Trp在单绕和双绕中形成阳离子-π相互作用的能力相当,不存在结构上的特异性.Trp较高的阳离子-π参与率是因为:Trp上的吲哚基团是很强的阳离子结合位点,从而更容易和带正电荷的氨基酸结合形成阳离子-π相互作用.
Lys、Arg和带正电荷的氨基酸在单绕和双绕中的组分之比分别为0.95、1.09、1.01,而Lys、Arg在单绕和双绕中的参与率之比却分别达到2.61和2.18,说明提供阳离子的Lys、Arg在单绕中比在双绕中更容易参与阳离子-π相互作用.芳香族氨基酸Tyr也具有同样的特异性.
2.3 不同组合阳离子-π相互作用的分布
两种带正电荷的氨基酸和三种芳香族氨基酸参与阳离子-π相互作用的组合方式有六种,即:Arg-Phe、Arg-Tyr、Arg-Trp、Lys-Phe、Lys-Tyr和 Lys-Trp,我们分别统计了这六种组合方式在单绕和双绕中出现的百分比的情况,结果见表4.
从表4可以看到:在单绕和双绕中Arg组合都比Lys组合更多地参与了阳离子-π的形成;Arg-Tyr组合在单绕中的百分比明显大于在双绕中的百分比;Arg-Phe组合在双绕中的百分比明显大于在单绕中的百分比;其它组合在单绕和双绕中的分布相当.
2.4 阳离子-π相互作用在结构中的位置分布
利用RasTop软件观察每一个蛋白样本的空间结构,辨识结构中阳离子-π相互作用在结构中的位置,对全部样本进行阳离子-π相互作用位置分布统计分析,我们发现:66个单绕样本中,阳离子-π相互作用分布在蛋白质首尾(即β1α1与β8α8)之间样本有24个,占到了总数的36.36%,其中有10个样本在首尾间存在2个或2个以上的阳离子-π相互作用,阳离子-π相互作用组合Lys-Tyr、Lys-Trp、Arg-Trp出现的频次分别为8、6、9,占全部组合总数的2/3; 37个双绕样本中,阳离子-π相互作用分布在蛋白质结构转折处即β1α1与β4α4之间的样本1个,占总数的2.70%,具体结果见表5.
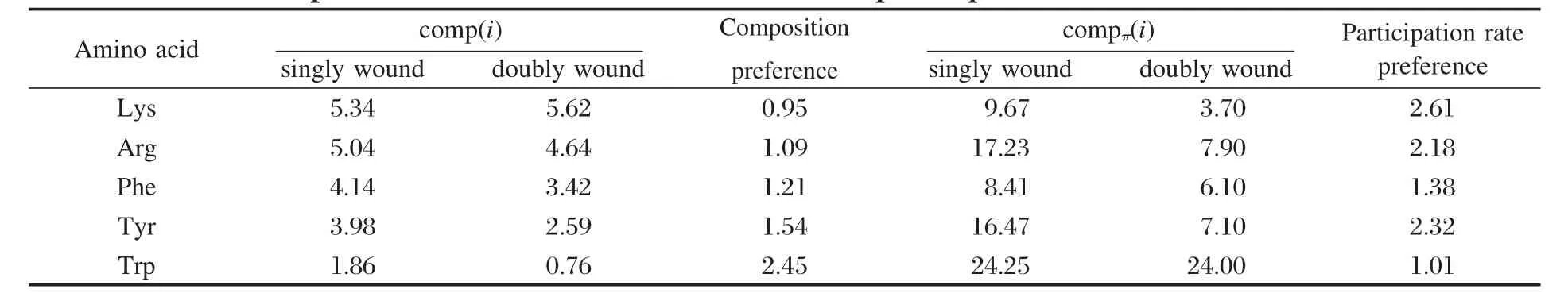
表3 5种氨基酸的组分及其阳离子-π的参与率Table 3 Composition of five kinds of amino acids and participation rate of cation-π interactions

表4 不同组合阳离子-π相互作用的分布(%)Table 4 Distribution(%)of different cation-π interactions

表5 典型蛋白质折叠中阳离子-π相互作用的位置分布特异性Table 5 Location specificity of cation-π interactions in typical protein folds
在某一蛋白样本中,如果同一个氨基酸残基与两个氨基酸氨基分别形成阳离子-π相互作用,我们视该蛋白质样本存在阳离子-π相互作用阵列.对66个单绕样本及37个双绕样本,利用RasTop软件观察每一个样本的空间结构,确定样本是否存在阳离子-π相互作用阵列并进行统计,结果显示:单绕样本中存在构成阳离子-π相互作用阵列的样本为22个,占到了总数的33.33%;双绕中存在阳离子-π相互作用阵列的样本2个,占样本总数的5.41%,具体结果见表5.
在单绕样本中,形成阳离子-π相互作用阵列或阳离子-π相互作用分布在结构首尾之间的样本达到43个,占单绕样本总数的65.15%.在双绕样本中,满足上述条件的样本仅为3,占双绕样本总数的8.10%,具体结果见表5.
3 结 论
单绕和双绕同属α/β类蛋白,同由βα基本二级结构单元组成,且βkαkβk+1间满足右手螺旋关系,氨基酸的组分在两种结构中除Trp外也基本相同.但阳离子-π相互作用的信息在两种结构中却存在诸多差异:单绕中阳离子-π相互作用的分布密度远大于双绕中阳离子-π相互作用的分布密度;Lys、Arg、Tyr在单绕中更容易参与阳离子-π相互作用; Arg-Phe组合在双绕中出现几率较大,Arg-Tyr组合在单绕中出现几率较大;阳离子-π相互作用在65%的单绕样本中形成阵列或分布在结构的首尾间等,说明阳离子-π相互作用存在不同折叠类型的特异性,阳离子-π相互作用在稳定单绕结构中的作用强于双绕.
1 Ma,J.C.;Dougherty,D.A.Chem.Rev.,1997,97(5):1303
2 Mecozzi,S.;West,A.P.;Dougherty,D.A.J.Am.Chem.Soc, 1996,118(9):2307
3 Mecozzi,S.;West,A.P.;Dougherty,D.A.Proc.Natl.Acad.Sci. U.S.A.,1996,93(20):10566
4 Sunner,J.;Nishizawa,K.;Kebarle,P.J.Phys.Chem.,1981,85 (13):1814
5 Gallivan,J.P.;Dougherty,D.A.Proc.Natl.Acad.Sci.U.S.A., 1999,96(17):9459
6 Cheng,J.G.;Luo,X.M.;Yan,X.H.;Li,Z.;Tang,Y.;Jiang,H.L.; Zhu,W.L.Sci.China Ser.B-Chem.,2008,51(8):709
7 Sussman,J.L.;Harel,M.;Frolow,F.;Oefner,C.;Goldman,A.; Toker,L.;Silman,I.Science,1991,253(5022):872
8 Xiu,X.;Puskar,N.L.;Shanata,J.A.P.;Lester,H.A.;Dougherty, D.A.Nature,2009,458(7237):534
9 Dougherty,D.A.Science,1996,271(5246):163
10 Prajapati,R.S.;Sirajuddin,M.;Durani,V.;Sreeramulu,S.; Varadarajan,R.Biochemistry,2006,45(50):15000
11 Gromiha,M.M.Biophysical Chemistry,2003,103(3):251
12 Crowley,P.B.;Golovin,A.Protein,2005,59(2):231
13 DeVos,A.M.;Ultsch,M.;Kossiakoff,A.A.Science,1992,255 (5042):306
14 Pflugrath,J.W.;Wigand,G.;Huber,R.;Vertesy,L.J.Mol.Biol., 1986,189(2):383
15 Gromiha,M.M.;Santhosh,C.;Ahmad,S.International Journal of Biological Macromolecules,2004,34(3):203
16 Gromiha,M.M.Polymer,2005,46(3):983
17 Anbarasu,A.;Anand,S.;Mathew,L.;Sethumadhavan,R. International Journal of Biological Macromolecules,2007,40(5): 479
18 Chakkaravarthi,S.;Gromiha,M.M.Polymer,2006,47(2):709
19 Shanthi,V.;Ramanathan,K.;Sethumadhavan,R.Journal of Computer Science&Systems Biology,2009,2(1):51
20 Prasad,V.R.;Sathpathy,S.Protoplasma,2009,238(1-4):11
21 Wintjens,R.;Liévin,J.;Rooman,M.;Buisine,E.J.Mol.Biol., 2000,302(2):395
22 http://astral.berkeley.edu/scopseq-1.65.html
23 http://capture.caltech.edu/
24 Jorgensen,W.L.;Tirado-Rives,J.J.Am.Chem.Soc.,1988,110 (6):1657
25 Jorgensen,W.L.;Maxwell,D.S.;Tirado-Rives,J.J.Am.Chem. Soc.,1996,118(45):11225
Specificity of Cation-π Interactions in Typical Protein Folds
QIAO Hui LI Xiao-Qin*XU Hai-Song KONG Ling-Qiang PENG Yu
(School of Life Science and Bioengineering,Beijing University of Technology,Beijing 100124,P.R.China)
In proteins,cation-π interactions are formed between positively charged amino acids(Lys,Arg)and aromatic amino acids(Phe,Tyr,Trp).We investigated the cation-π interactions in two typical folding structures of α/β proteins,namely,the singly wound structure and the doubly wound structure.The results reveal that:(1)The distribution density of cation-π interactions in singly wound structures is about 2.6 times as high as that in doubly wound structures;(2)In singly wound structures,a correlation is observed between the amount of residues and their cationπ interactions while no correlation is observed in doubly wound structures;(3)Lys,Arg and Tyr in singly wound structures participate more easily in cation-π interactions than those in doubly wound structures;(4)Arg-Phe pairs are preferred in doubly wound structures while Arg-Tyr pairs are preferred in singly wound structures;(5)In singly wound structures,65%of the cation-π interactions form arrays or distribute between the starting point and the end point in the structures.
Singly wound;Doubly wound;Cation-π interaction;Specificity
O641
Received:April 29,2010;Revised:June 28,2010;Published on Web:August 10,2010.
*Corresponding author.Email:lxq0811@bjut.edu.cn;Tel:+86-10-67391610;Fax:+86-10-67392001.
The project was supported by the National Natural Science Foundation of China(30570427)and Natural Science Foundation of Beijing,China (4092008).
国家自然科学基金(30570427)和北京市自然科学基金(4092008)资助项目
ⒸEditorial office of Acta Physico-Chimica Sinica

