一株拮抗储粮真菌的细菌菌株鉴定和初步研究
代岩石吴子丹伍松陵王松雪宋 慧孙长坡
(吉林农业大学生命科学学院1,吉林 130118)
(国家粮食局科学研究院2,北京 100037)
一株拮抗储粮真菌的细菌菌株鉴定和初步研究
代岩石1,2吴子丹2伍松陵2王松雪2宋 慧1孙长坡2
(吉林农业大学生命科学学院1,吉林 130118)
(国家粮食局科学研究院2,北京 100037)
在粮库仓储玉米中分离到一株强烈拮抗储粮真菌的细菌,初步研究表明该菌株对储粮中的主要产毒真菌如黄曲霉菌、赭曲霉菌、三线镰刀菌等都具有强烈的拮抗作用。利用生理、生化等常规技术并结合16S rDNA分子鉴定方法,最终确定该菌株为一株解淀粉芽孢杆菌,命名为 Bacillus amyloliquefaciens ASAG1。进一步确定了ASAG1菌株的摇瓶发酵最适培养基、发酵条件,并对发酵液中,活性抑菌物质的性质进行了初步研究和纯化。该研究的开展为进一步明确活性抑菌组分提供了借鉴,同时也为利用生物技术防控粮食中的产毒真菌提供了一个新思路。
储粮 产毒真菌 拮抗 解淀粉芽孢杆菌 活性物质
谷物是人们摄取营养、赖以生存的能量来源,是平衡膳食金字塔中比例最大、最为重要的物质基础[1]。因发霉、害虫危害导致的储粮品质劣变和损失严重危害着我国储粮安全。据联合国粮农组织(FAO)统计,每年约有 25%粮食因真菌毒素污染影响食用[2-3]。目前发现危害粮食储藏的真菌有 150多种,并可产生 200多种真菌毒素[4]。人体摄入这些毒素之后能够导致呕吐、消化系统和神经系统症状、多种原发性癌症、甚至急性中毒死亡等等[4]。因此防止粮食霉变是保持粮食品质的重要方法之一。
目前所用的防霉方法主要是通过降低储藏水分、温度等物理作用处理粮食及其制品以防止霉菌生长,或通过添加化学防霉剂的方法控制储粮及粮食产品霉变[5-6]。但是这些方法具有破坏营养、效果持续时间短、防霉不彻底和成本高等缺陷,从而造成实际防控效果不理想,另外有些化学防霉剂,本身具有一定毒性,使用不当反而会影响食用安全和污染环境。而利用一些有着抗真菌作用又对人体无害的微生物防霉则有成本低、增值快、作用效果持久、安全高效、绿色环保等优点。因此研究、开发生物防霉和利用微生物及其代谢产物防霉等技术,是提高防霉效率、减少营养损失、降低储存成本的好方法。另外某些微生物的代谢过程还可以降解粮食和饲料中的不容易被机体消化吸收的大分子,使其降解成可以被机体直接吸收利用的小分子,从而在提高粮食利用率的同时,并提升了产品价值。
本研究对从储粮中分离得到的一株拮抗产毒真菌的解淀粉芽孢杆菌进行了菌株鉴定,并初步验证该菌株具有较好拮抗产毒真菌作用和使用安全性。同时对该菌株的培养条件以及抑菌谱进行了研究。在初步分析抑菌活性物质特点的前提下,从发酵液中粗提浓缩了抑菌活性物质。
1 材料与方法
1.1 材料
1.1.1 菌种
从储备粮库的玉米中分离筛选到具有强烈抑制真菌作用的一株细菌,并经纯化、培养作为本研究目的菌株。本研究中用于作为指示菌及抗菌谱研究的储粮主要有害真菌有黑曲霉菌 (Aspergillus.nigerCG2 MCC3.4463)、黄曲霉菌 (Aspergillus.flavusCG MCC 3.4410)、赭曲霉菌 (Aspergillus.ochraceusCG MCC 3.4520)、灰绿曲霉菌 (Aspergillus.glaucusCG MCC 3.3980)、烟曲霉菌 (Aspergillus.fum igatusCG MCC 3.3552)、赤 曲 霉 菌 (Aspergillus. ruberCG MCC 3.3956)、黄绿青霉菌 (Penicillium.citreo-virideCG M2 CC3.4038)、疣孢青霉菌 (Penicillium.verruculosum CG MCC3.4297)、半裸镰刀菌 (Fusarium.sem itectum CG MCC3.0719)、尖孢镰刀菌 (Fusarium.oxysporumCG MCC3.2830)、三线镰刀菌 (Fusarium.tricinetum CG MCC3.4731),其中黄曲霉菌、赭曲霉菌、三线镰刀菌为产毒株,均购自中国普通微生物菌种保藏管理中心;炭黑曲霉菌 (Aspergillus.carbonarius),由中国农业大学梁志宏老师赠予;苏云金芽孢杆菌 (B acillus. thuringiensisHD73)、蜡样芽孢杆菌 (B acillus.cereus 14579)、蜡样芽孢杆菌 (B acillus.cereus10987)、枯草芽孢杆菌 (B acillus.Subtilis168)由中国农业科学院植物保护研究所惠赠。
1.1.2 培养基
用于摇瓶发酵的 4号液体培养基,做抗菌谱试验的 4号固体培养基,做抑菌试验用培养基有 PDA (马铃薯葡萄糖培养基)、察氏培养基、高盐察氏培养基和浓糖察氏培养基。
1.1.3 试验主要仪器
温度梯度 PCR仪:AB I公司;恒温混匀器:eppen2 dorf公司;5810R离心机:eppendorf公司;自动高压灭菌器:H IRAYAMA公司;全温振荡培养箱:河北太仓科学仪器有限公司;IX71显微镜:奥林巴斯公司。
1.1.4 试验主要试剂与耗材
无菌微孔滤膜(滤径为 0.2μm,除菌用):PALL公司;核酸回收试剂盒:大连 TaKaRa公司;血琼脂培养基:友康基业生物科技 (北京)有限公司;生化试剂:主要购置于 Sigma公司、北京鼎国昌盛生物技术有限公司;其他化学试剂(均为分析纯):北京奥博星生物技术公司和北京化学试剂厂。
1.2 试验方法
1.2.1 菌株的分离
①把粮库的储藏玉米 25 g加入到 225 mL无菌水中,振荡摇洗 30 min,样液做梯度稀释到 103~104倍,接 PDA培养基,其配方为:马铃薯 200 g/L、葡萄糖 20 g/L、琼脂 20 g/L,自然 pH,48 h开始观察,每天 1次共观察 7 d。②观察发现培养皿中有拮抗真菌的菌落,挑取该菌落,以划线方式接 PDA培养基, 48 h后观察。③挑取形态不同的各个菌落在 PDA培养基上与不同的储粮有害真菌做对峙试验。④挑选有较强拮抗现象的菌落,重复步骤②,若平皿上只生长一种菌落,重复步骤③,有拮抗现象,则该拮抗菌株被分离纯化成功。若平皿上生长有多种菌落,则反复重复步骤③、④直至拮抗菌株被分离纯化出来。若单一菌落对真菌无拮抗作用则需返回步骤③,重复以上各步骤,直至拮抗菌株被分离纯化。
1.2.2 菌株对产毒真菌的拮抗作用初步验证
将黄曲霉菌、赭曲霉菌、三线镰刀菌接入到1 000 g经辐照灭菌的高水份玉米中,28℃、相对湿度70%培养 90 d,分别取 25 g样品,粉碎后检测黄曲霉毒素B1、赭曲霉毒素、玉米赤霉烯酮。黄曲霉毒素B1检测方法参照 GB/T 5009.22—2008、赭曲霉毒素检测方法参照 GB/T 5009.96—2008、玉米赤霉烯酮检测方法参照 GB/T 5009.209—2008。用以上经验证产毒的黄曲霉菌、赭曲霉菌、三线镰刀菌分别与筛选出来的有拮抗作用的菌株做对峙试验,以测定其对产毒真菌的拮抗作用。
1.2.3 菌株的鉴定
①革兰氏染色;②芽孢染色;③分解淀粉试验:将该菌株与对照菌枯草芽孢杆菌一起接在加入 2%可溶性淀粉的 PDA培养基上,31℃培养 48 h后在培养基表面均匀滴加 1%碘酒精溶液,再放入培养箱, 30 min后观察;④测定该菌株生长情况,检测在 600 nm波长的吸光值,绘制菌株生长曲线,观察产生芽孢情况;⑤16S r DNA鉴定:选择对数生长期的菌液作为提取样本,提取基因组DNA,对 16S rDNA目的片断 PCR进行扩增[7]。
引物序列:
Bs16sR:5′-TGGAGA GTT TGA TCC TGG CTC AG-3′
Bs16sF:5′-AAG GAG GTGATC CAG CCG CAC CT-3′
PCR反应体系 (50μL):纯水 30μL,10×buffer 5μL,dNTP4μL,lmol/L的MgCl2 3μL,上下游引物各1μL,模板DNA 4μL,Taq DNA聚合酶 1μL。
PCR反应条件:①94℃预变性 5 min;②94℃变性 30 s、57℃退火 40 s、72℃延伸 90 s,31个循环;③72℃延伸 10 min。PCR产物回收插入 PMD-18T载体后由上海生工进行序列测定。
序列输入 GenBank数据库中进行比对,选择同源性高的序列使用 Clustal W→TreeView软件构建系统发育树[8]。
1.2.4 菌株安全性初步评价
以产生外毒素的蜡样芽孢杆菌 14579、蜡样芽孢杆菌 10987、苏云金芽孢杆菌为对照,将目的菌株与三种对照菌株接在血琼脂培养基上,31℃培养 48 h观察溶血现象[9]。
1.2.5 培养基筛选
中所用的 4种用于目的芽孢杆菌培养的培养基分别命名为 1号培养基[10],2号培养基[11],3号培养基[12],4号培养基[13]。经以上 4种培养基发酵后的除菌发酵液用牛津杯定量法比较抑菌效果,从中选出一种最适培养基。同时,从储粮主要有害真菌中筛选出一种被抑制作用明显、对人体危害小、生长快速、便于观察的菌株作为抑制试验指示菌。
1.2.6 培养条件优化
以选定的培养基为基础,摇床培养,200 r/min。时间条件优化:比较培养 8、12、16、24、30、36、48、60、72、96 h的发酵液抑菌作用。pH条件优化:调整培养基 pH值,分别为 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0培养72 h后比较抑菌作用。温度条件优化:比较 25、27、29、31、33、35、37℃培养 72 h的发酵液抑菌作用。
1.2.7 菌株抑菌谱试验
采用对峙试验方法[14],ASAG1菌株与 12种常见储粮有害真菌在 4号培养基上做对峙试验。
1.2.8 除菌发酵液抑菌试验
将ASAG1菌株发酵液以 12 000 r/min离心 10 min,上清液用 0.2μm无菌微孔滤膜过滤除菌后,采用牛津杯定量法[15]做抑制试验,测量抑菌圈直径大小,以确定该菌株对 12种常见储粮有害真菌的抑菌效果。其中黑曲霉菌、黄曲霉菌、烟曲霉菌、炭黑曲霉菌、疣孢青霉菌、赭曲霉菌、黄绿青霉菌使用察氏培养基,三线镰刀菌、半裸镰刀菌、尖孢镰刀菌使用PDA培养基,灰绿曲霉菌使用高盐察氏培养基,赤曲霉菌使用浓糖察氏培养基做抑菌试验。
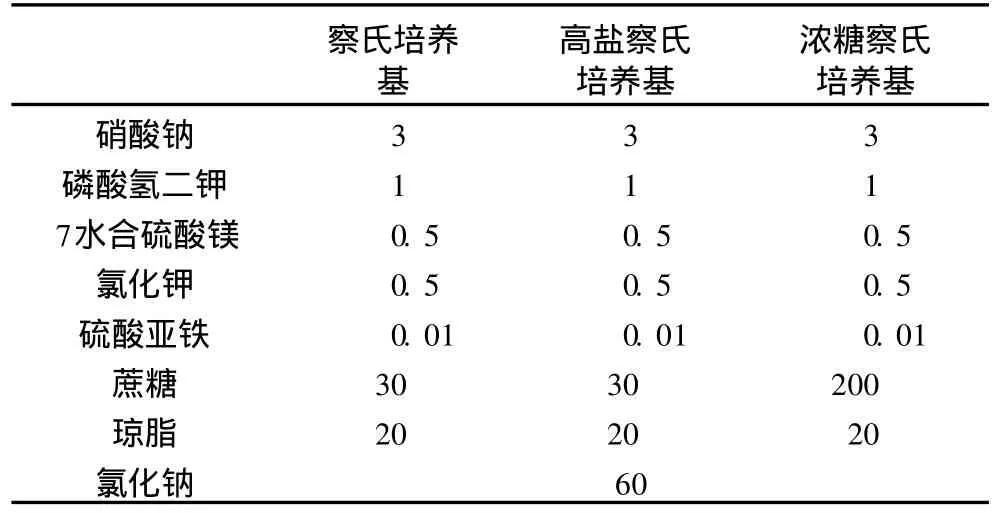
表1 培养基配方/g/L
1.2.9 活性抑菌物质性质初步研究
以培养 72 h的发酵液为基础。①用 1 mol/L盐酸和 1 mol/L氢氧化钠调整发酵液 pH值分别为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0,观察发酵液有无沉淀及比较各 pH值时发酵液的抑菌作用。②发酵液以不同温度、持续时间加热,比较经 70℃300 min、100℃15 min、100℃30 min、100℃60 min、100℃120 min、121℃20 min处理后的发酵液抑菌作用。③将 1 mL发酵液与乙醇、甲醇、丙酮、乙腈、异丙醇、二氯甲烷等常用有机溶剂等体积混合后密闭放置 24 h,氮吹,除去有机溶剂,用纯水定容至 1 mL,做抑菌试验比较其抑菌作用。
1.2.10 活性物质的初步提取
利用发酵液在不同pH值时产生沉淀的性质,用 1 mol/L氢氧化钠调整发酵液 pH值至11.0,5 000 r/min离心5min,去除沉淀,再用1mol/L盐酸调pH值至3. 0,12 000 r/min离心 10 min,弃掉上清液,沉淀加少量纯水,再调 pH值到 7.0溶解,再加纯水定容为原体积的 1/100,再取 100倍浓缩粗提液 100μL加纯水定容至10 mL,混匀,与发酵液原液做等量抑菌试验,比较二者活性大小。
2 结果与分析
2.1 菌株分离
在 PDA培养基上挑选有强烈拮抗储粮真菌作用的菌株,经反复纯化培养及拮抗作用测试,筛选出一株细菌,命名为ASAG1菌株。ASAG1菌株为革兰氏阳性短杆菌。芽孢染色镜检如图 1所示,可产生大量芽孢。
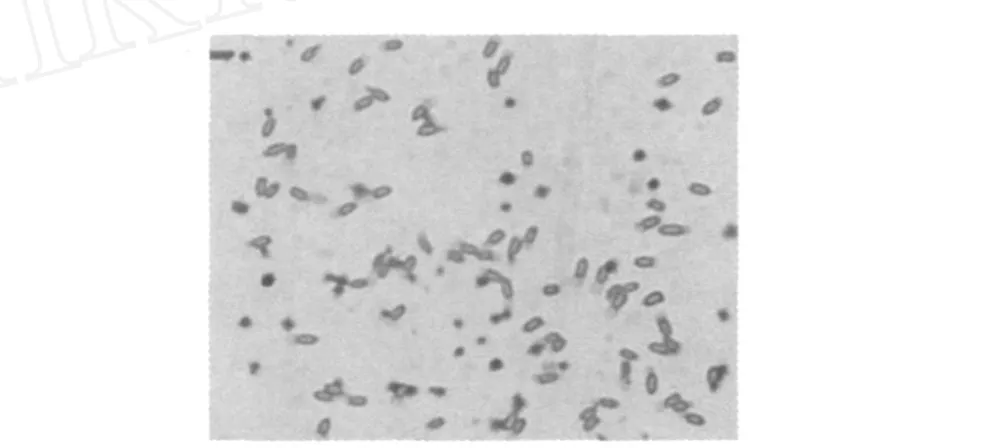
图 1 B.amyloliquefaciensASAG1菌株芽孢染色镜相
2.2 菌株鉴定
分解淀粉试验结果如图2所示,可以看出,该菌的分解淀粉能力要比对照菌(枯草芽孢杆菌)强得多。
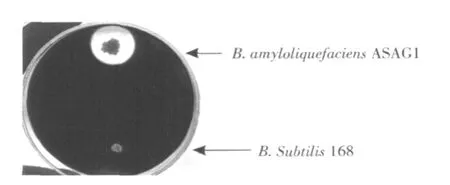
图 2 B.amyloliquefaciensASAG1菌株分解淀粉试验
2.3 16S rDNA序列测定及分析
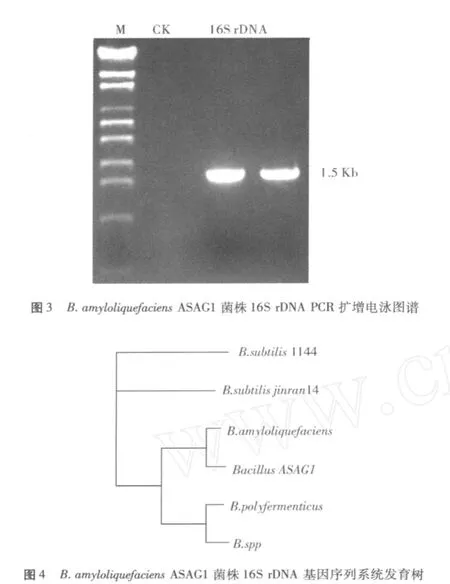
由图3可以看出,菌株ASAG1的16S r DNA核苷酸片段大小为 1.5 Kb左右,测定结果为 1 468 bp。将上述序列输入 www.NCB I.Nih.nih.gov./blast.与Genbank数据库的序列比进行同源性分析,并利用Clusta X软件构建系统发育树,如图 4。
综合以上分析可将该菌株鉴定为解淀粉芽孢杆菌 (B acillus am yloliquefaciens)。并将该菌的 16S r D2 NA序列提交到 NCB I Genbank中登录注册,序列接受号为:FJ597542。
2.4 外毒素产生分析
安全性初步评价试验中,如图 5所示,可以看出,三株对照菌蜡样芽孢杆菌 14579、蜡样芽孢杆菌10987、苏云金芽孢杆菌菌落周围均有明显的溶血环,而ASAG1菌株则无溶血现象。因此,初步验证了ASAG1菌株不产外毒素,使用安全。
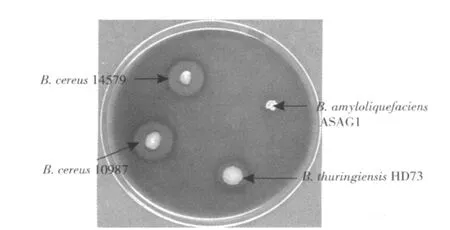
图 5 B.amyloliquefaciensASAG1菌株产外毒素测定结果
2.5 储粮真菌产生真菌毒素的鉴定及 ASAG1菌株对真菌的拮抗效果
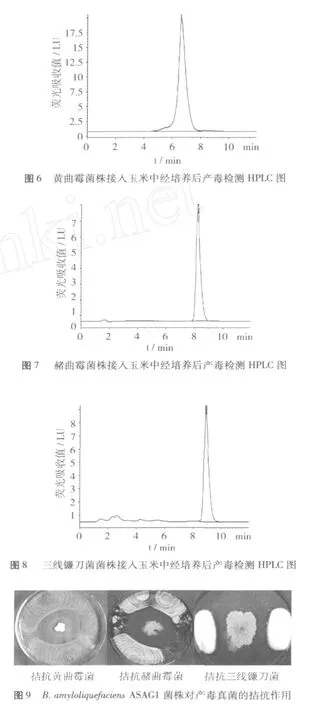
将ASAG1菌株与在粮食中生长、经检验产毒(如图 6至图 8所示)的黄曲霉菌、赭曲霉菌、三线镰刀菌做对峙试验,结果如图 9所示,其对这三株产毒真菌有明显的拮抗作用。
2.6 培养基筛选与培养条件优化
试验过程中发现,活性物质对黑曲霉菌的抑制作用明显,且黑曲霉菌对人体相对安全、容易操作、生长速度快、24~48 h就可以观察结果,适合作为试验指示菌使用,以下的试验将以此为基础展开。
ASAG1菌株在四种培养基中经摇床培养 200 r/ min,31℃,72 h后,除菌发酵液对黑曲霉菌的抑制作用在图 10中可以看出,4号培养基的抑制作用最明显,抑菌圈直径最大为 23 mm,3号培养基的抑菌圈为16 mm,2号培养基的抑菌圈为 10 mm,1号培养基的抑菌圈为 8 mm。因此选择 4号培养基作为ASAG1菌株产生抑菌活性物质的最适培养基。试验结果说明,糊精、葡萄糖、蔗糖、乳糖这 4种碳源中,以乳糖作为碳源最有利于 ASAG1菌株发酵产生抑菌活性物质,牛肉膏、胰蛋白胨、蛋白胨中,以蛋白胨作为氮源最有利于 ASAG1菌株发酵产生抑菌活性物质。无机氮源中,硝酸钠效果要好于硫酸铵。4号培养基配方为:马铃薯 100 g/L、乳糖 40 g/L、蛋白胨15 g/L、硝酸钠 0.5 g/L、7水合硫酸镁 4 g/L,pH值7.0(4号培养基加入 20 g/L琼脂即为 4号固体培养基)。
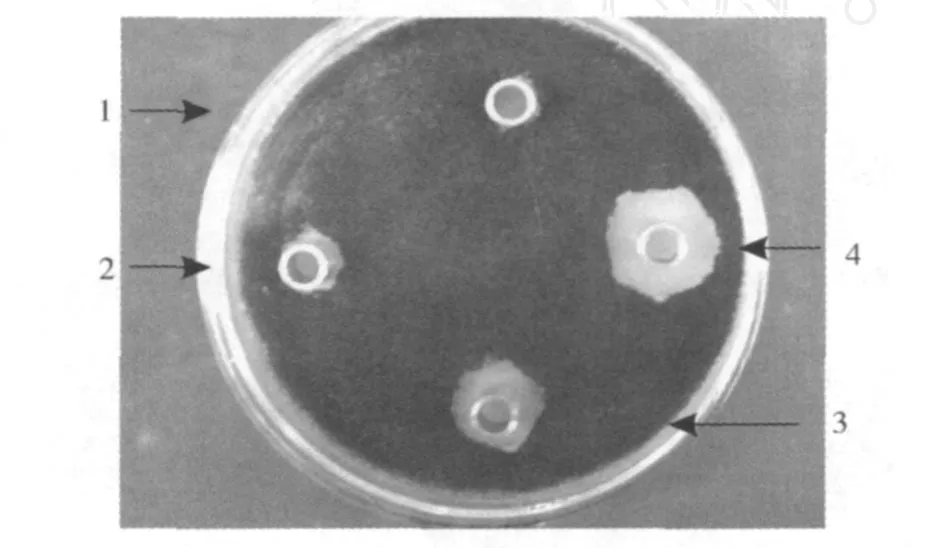
图 10 B.amyloliquefaciensASAG1菌株在 4种不同培养基中产生活性物质的能力
ASAG1菌株摇瓶培养,24 h开始有抑菌活性物质产生,随时间延长,抑菌活性物质的含量逐渐增加,如表 2所示,到 48 h抑菌圈直径达到 22 mm,之后抑菌圈直径没有明显增大。培养基的 pH值在5.0~11.0之间,均可以产生活性物质,但与 pH值7.0时的抑菌圈相比较小,如表 3所示,这表明, ASAG1菌株产生的活性抑菌物质的 pH值适应范围较宽,最适 pH值为 7.0。ASAG1菌株在不同温度下培养产生的活性物质的量差异不大,如表 4所示, 31℃培养时抑菌圈的直径最大为 23 mm,25℃和37℃培养时抑菌圈直径分别为20 mm和 21 mm。这说明ASAG1菌株适应温度范围较宽。因此,培养基pH值 7.0,31℃,培养 48~72 h,是ASAG1菌株的最佳培养条件。
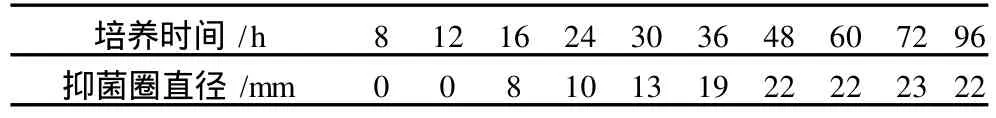
表2 培养时间对抑菌活性物质产生的影响
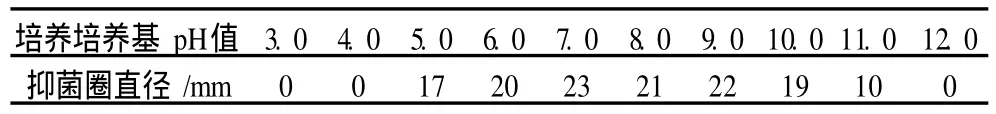
表3 培养基pH值对抑菌活性物质产生的影响
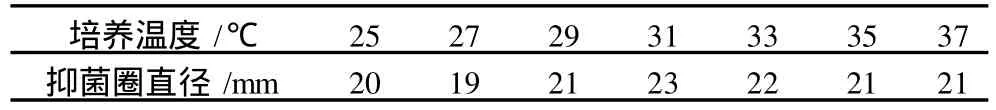
表4 培养温度抑菌活性物质产生的影响
2.7 菌株与除菌发酵液抑菌效果
ASAG1菌株与 12种常见储粮有害真菌,在 4号固体培养基上做对峙试验,结果表明:ASAG1菌株对黑曲霉菌、黄曲霉菌、烟曲霉菌、三线镰刀菌、炭黑曲霉菌、疣孢青霉菌、赭曲霉菌、半裸镰刀菌、尖孢镰刀菌有明显的拮抗作用。而黄绿青霉菌、灰绿曲霉菌、赤曲霉菌在 4号固体培养基上不能生长,无法观察拮抗作用。
牛津杯定量法对除菌发酵液的抑菌试验结果,如表 5所示,ASAG1菌株发酵液对以上 12种真菌都有明显的抑制作用。
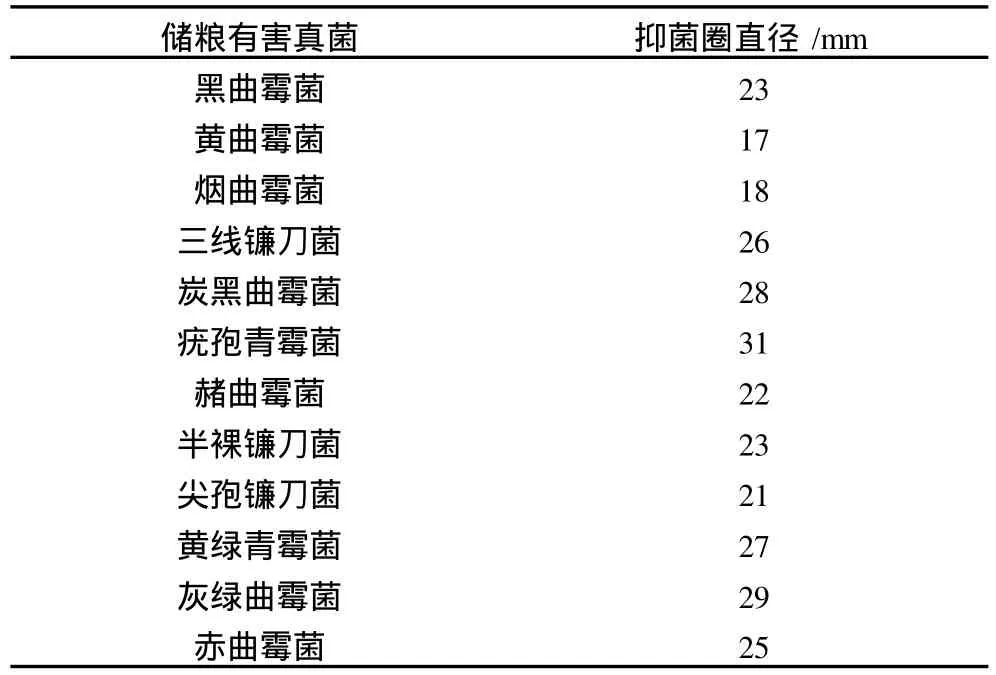
表5 除菌发酵液对 12种储粮有害真菌抑制作用
2.8 活性物质的性质探索与初步提取
向ASAG1菌株发酵液中加盐酸调 pH值到 5.1时,发酵液开始产生沉淀,上清液有活性;继续加盐酸,pH值到 4.0时,上清液活性消失,当发酵液 pH值为 3.0时,沉淀量最大。加氢氧化钠溶液调发酵液 pH值到 9.1时,发酵液开始产生沉淀,上清液有活性;继续加氢氧化钠,pH值为 11.2时,沉淀最多,上清液有活性,pH值超过 12.0以后活性快速下降,直至消失。图 11所示为不同 pH值时,上清液抑菌直径的变化。
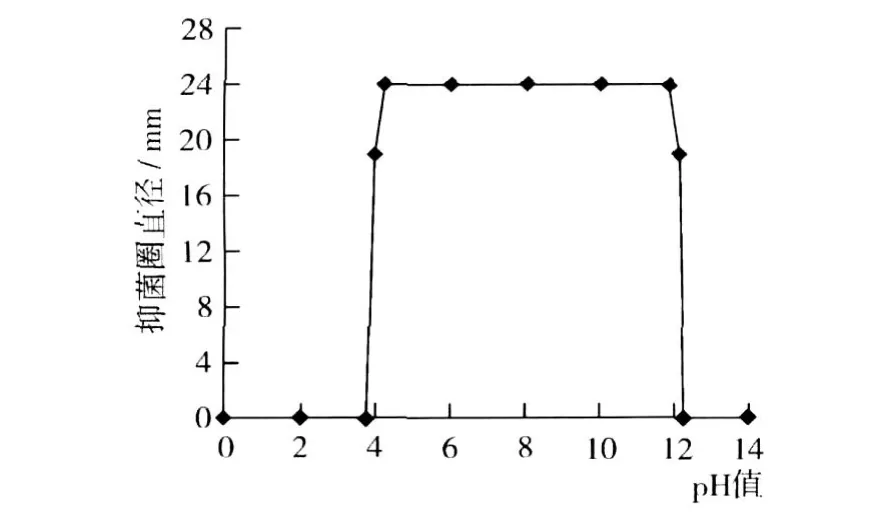
图11 pH值对抑菌物质活性的影响
发酵液中抑菌活性物质受温度影响非常小,在100℃以内长时间加热对活性几乎没有影响,120℃时对活性有较小的影响,这说明该菌产生的活性物质具有很好的高温稳定性。
常用有机溶剂对发酵液抑菌活性无影响。
2.9 活性物质粗提
根据发酵液在不同 pH值时表现出来的性质,调整 pH值,去除无活性沉淀和上清液,回收有活性沉淀,最后得到浓缩粗提液。由于最后定容使用纯水溶解沉淀,所以,原来培养基中的盐和杂质也基本上除去。定容为原体积的 1/100,得到 100倍的浓缩粗提液。采用此种方法得到的粗提液 100倍稀释后做抑菌试验,抑菌圈直径为 20 mm,与原液相比较活性损失不明显,这说明活性物质在整个处理过程中没有大量损失和发生性质、结构改变。
3 讨论与结论
在本研究中,一株从储粮中分离得到的解淀粉芽孢杆菌ASAG1,经初步验证对储粮中的主要产毒真菌,黄曲霉菌、赭曲霉菌、三线镰刀菌都有很好的拮抗作用,这说明其生长过程或者代谢产物对以上三种真菌有抑制作用。之后的安全性试验中, ASAG1菌株不产生对人体、动物有害的细菌外毒素,初步鉴定了其使用安全性。在以上两个试验结果的基础之上,进一步对 ASAG1菌株的培养条件、抑菌活性以及活性物质的粗提展开了细致的研究。
通过优化 ASAG1菌株培养条件的研究发现, ASAG1菌株在较宽的温度、pH值范围内都可以产生大量的抑菌活性物质,这说明该菌株适应自然环境能力强。另外,ASAG1菌株对储粮有害真菌的强烈抑制作用,保证了该菌株在储粮及粮食制品防霉方面将有很好的应用效果。
在ASAG1菌株的抑菌活性研究中,采用对峙试验证明,ASAG1菌株在生长过程中对黑曲霉菌、黄曲霉菌等多种可以产生真菌毒素的储粮真菌均具有很好的抑制作用。这说明ASAG1菌株具有宽广的抗菌谱。本研究结果还表明,ASAG1菌株能产生的抑菌活性物质,并且活性物质可分泌到菌体外部,并溶解在培养基中,有利于提取纯化。
研究表明,酸碱作用可以使ASAG1菌株发酵液中活性物质沉淀或溶解,调整 pH值到 7.0左右时活性仍可恢复。利用这一特性调整 pH值,可得到去除大部分杂质和盐的浓缩活性物质组份。在试验中,活性物质还表现出耐高温、与常用有机溶剂混合后性质不发生变化等特点。在下一步对活性组份分离纯化的试验中,我们就可以利用活性物质耐有机溶剂的性质,使用有机溶剂萃取、树脂吸附、液相色谱等方法纯化、制备活性组分;再利用活性物质耐高温的性质,使用旋转蒸发、真空浓缩等方法进一步提纯活性组分。
随着传统农药、杀虫剂对环境破坏问题日益被人们关注[16]和植物病原菌耐药性增强,导致药效相对降低等原因凸显[17],利用生物技术防治作物病害、杀虫,成为研究热点。自 1945年 Johnson等人发现枯草芽孢杆菌能够产生抗菌物质以来[18],芽孢杆菌因其内生芽孢、繁殖能力强、有利于工业化生产、又是自然界广泛纯在的非致病菌等诸多优点,被科研工作者热切关注[19]。近些年,解淀粉芽孢杆菌的抗菌作用逐渐被人们发现和认识。从已发表的文献中看,研究人员在解淀粉芽孢杆菌的代谢产物中发现至少两种以上抗菌活性物质[20],并且其抗菌活性非常强,性质稳定,不易失活,表现出很好的研究前景。
志谢:本课题研究过程中受到中国农业大学梁志宏老师、中国农业科学院植物保护研究所等大力的支持和指导,并提出了宝贵的建议,在此表示衷心感谢!
参考文献
[1]代璇.健康饮食指数与中国膳食平衡指数的比较研究[J].卫生研究,2009,38(2):244-247
[2]陈宪明,张国梁.霉菌毒素对粮食食品污染 [J].粮食储藏,1996,25(4):40-41
[3]Markus Schmidt-Heydt,Rolf Geisen.A microarray formoni2 toring the production ofmycotoxins in food[J].International Journal of FoodMicrobiology,2007,117:131-140
[4]程忠刚,林映才,郑黎.饲料霉变的原因、危害及其预防[J].饲料工业,2001,22(03):1-7
[5]冯定远.花生饼中黄曲霉毒素物理去毒的试验[J].广东饲料,1995,6:14-15
[6]Mckenzie K S,Kubena L F,DenvirA J,et al.Aflatoxicosis in Turkey Poults is Prevented by Treat mentofNaturally Contam2 inated Corn with Ozone Generated by Electrolysis[J].Envir2 oment and Health,1998,77:1094-1102
[7]别小妹,陆兆新,房耀维,等.利用 16S rDNA序列分析鉴定一株产抗菌物质的微生物菌株[J].食品科学,2006,27 (11):466-470
[8]刘旭光,张杰.分子生物学软件应用[S].北京:北京大学医学出版社,2007:197-208
[9]Agata N,OhtaM,MoriM,et al.A novel dodecadepsipeptide, cereulide,is an emetic toxin ofBacillus cereus[J].FEMSMi2 crobiolLett,1995,129(1):17-20
[10]丁翠珍,裘季燕,刘伟成,等.枯草芽孢杆菌 B02产生拮抗物质培养基及发酵条件优化 [J].中国生物防治, 2008,24(2):159-163
[11]Emad Abd El-moniem Abada.Isolation and Characteriztion of a Antimicrobial Compound from Bacillus coagulans[J]. Animal Cells and Systems,2008,12:41-46
[12]陈凯,薛东红.短短芽孢杆菌 (B revibacillus brevis)XDH菌株发酵培养基配方的研究[J].山东农业大学学报(自然科学版),2006,37(2):190-195
[13]王智文,刘训理,何亮,等.Cp-S316菌株发酵培养基的优化及其对烟草赤星病菌的抑制作用[J].农业环境科学学报,2007,26(2):723-728
[14]权春善,郑维,曹治明等.洋葱伯克霍尔德菌 CFO66抗菌物质的分离纯化及性质的研究[J].微生物学报,2005, 45(5):707-709
[15]贾爱元,鲁昊.饲料防霉剂杀菌效力的判定及其综合评价[J].饲料工业,1999,20(7):19-20
[16]Yoshida S,Hiradate S,Tsukamoto T,et al.Antimicrobial ac2 tivityof culture filtrate ofB acillus am yloliquefaciens RC O2 isolatedfrom mulberry leaves[J].Biological Control,2001, 91:181-182
[17]陈士云,杨宝玉,高梅影,等.一株抑制油菜核盘菌菌核形成的解淀粉芽孢杆菌 [J].应用与环境生物学报, 2005,11(3):373-374
[18]谢栋,彭憬,王津红,等.枯草芽孢杆菌抗菌蛋白 X98III的纯化与性质[J].微生物学报,1998,38(1):13-19
[19]权春善,王军华,徐洪涛,等.一株抗真菌解淀粉芽孢杆菌的分离鉴定及其发酵条件的初步研究 [J].微生物学报,2006,46(1):7-12
[20]王英国,王军华,权春善,等.解淀粉芽孢杆菌抗菌活性物质的分离纯化及抑菌活性研究[J].中国生物工程杂志,2007,27(12):41-45.
Identification of a Bacterium Strain with Antagonistic Action to Toxigenic Fungi in Stored Grain
Dai Yanshi1,2Wu Zidan2Wu Songling2Wang Songxue2Song Hui1Sun Changpo2
(Jilin AgriculturalUniversity1,Jilin 130118)
(Academy of State Administration of Grain2,Beijing 100037)
A bacterium strain was isolated from stored corn,which has strong antagonistic action to principal toxigenic fungi such asA.flavus,A.ochraceus,F.tricinetum,etc in stored grain.This bacterial strain was identi2 fied asBacillus amyloliquefaciens by using conventional techniques of physiology and biochemistry combined with the 16SrRNA molecular identification method,nominated Academy of State Administration of Grain 1 and abbreviated ASAG1.The optimum medium and conditions for shaking fermentation ofASAG1 bacterial strain were further deter2 mined,and the nature of the bioactive antagonistic substance in the fer mented liquid were preliminary studied and purified.This study provides a clear reference for further studying the antagonistic components,and provides a new consideration for biological control of toxigenic fungi in stored grain.
stored grain,toxigenic fungi,antagonistic,Bacillus amyloliquefaciens,active substance
Q939.92 文献标识码:A 文章编号:1003-0174(2010)10-0088-07
国家“十一五”科技支撑计划(2009BADA0B05)
2009-10-10
代岩石,男,1979年出生,硕士,生物化学与分子生物学
孙长坡,男,1975年出生,博士,副研究员,生物工程

