紫马铃薯花色苷提取工艺的研究
崔 倩蒋益虹王颖滢熊义勤
(浙江大学生物系统工程与食品科学学院1,杭州 310029)
(杭州大一科技有限公司2,杭州 310020)
紫马铃薯花色苷提取工艺的研究
崔 倩1蒋益虹1王颖滢1熊义勤2
(浙江大学生物系统工程与食品科学学院1,杭州 310029)
(杭州大一科技有限公司2,杭州 310020)
为开发紫马铃薯花色苷资源,在单因素试验基础上,采用正交试验对紫马铃薯花色苷的提取工艺进行了研究。采用pH示差法测定花色苷含量,研究了提取功率、温度、时间和料液比对提取率的影响。研究表明,料液比、提取时间、温度对紫马铃薯花色苷提取得率均有显著影响,影响最小的是超声功率。最佳提取工艺条件为:料液比1∶40、提取时间5 min、提取温度35℃、提取功率350 W。本试验以柠檬酸水溶液为提取剂,减少了花色苷的降解,同时大大降低了成本。
紫马铃薯 花色苷 提取 正交试验
紫马铃薯(Solanum tuberosum L.),薯型长椭圆型,表皮光滑,薯肉呈紫黑色,因富含花色苷、VC、胡萝卜素等,而兼具药食用功能。花色苷是存在于植物中的水溶性色素,属类黄酮化合物,研究证实,花色苷是目前科学界发现的防治疾病,维护人类健康最直接、最有效、最安全的自由基清除剂之一[1-2]。花色苷除对致癌物质有抑制作用外[3],还具有增强人体免疫力,延缓衰老,增强体质,抑制肥胖,增强视力等多种功效[4-7]。花色苷作为一种天然食用色素,安全、无毒、资源丰富,而且具有一定营养和药理作用,但是却没有在食品和饮料中得到广泛的应用。在人们日益重视健康,回归自然的今天,作为食品添加剂中的一种天然食用色素,花色苷因其独特抗氧化特性和有益健康特性日益受到人们青睐。紫色马铃薯属于所谓的低成本作物,可以作为天然花色苷的良好来源[8]。目前,对于紫马铃薯的研究主要集中在栽培技术研究上,而对于紫马铃薯花色苷的提取则罕见报道。本试验采用超声波辅助提取,并用正交试验对紫马铃薯中花色苷的提取工艺参数进行优化,以确定最佳提取工艺,为紫马铃薯花色苷的利用提供科学的理论依据。
1 材料与方法
1.1 试验材料
紫马铃薯由宁波市农科院提供,采后经清洗去皮,50℃下烘干。粉碎后过80目筛,常温下避光贮存备用。
1.2 主要仪器
722型可见分光光度计:上海光谱仪器有限公司;7530G型分光光度计:惠普上海分析仪器有限公司;RE-52AAA旋转蒸发仪:上海嘉鹏科技有限公司;250 g手提式高速万能粉碎机:温岭市林大机械有限公司;SK8210LHC超声波清洗器:上海科导超声仪器有限公司。
1.3 试验方法
1.3.1 紫马铃薯中花色苷含量的测定
1.3.1.1 紫马铃薯花色苷最大吸收波长的测定
去皮紫马铃薯粉1.00 g,用0.1%HCl甲醇溶液在室温下避光提取20 h,过滤,30℃下经旋转蒸发仪蒸干,用0.01%HCl甲醇溶液溶解。在波长250~800 nm下扫描,得到紫马铃薯花色苷在可见光区的最大吸收波长,在此最大波长下测定样品的吸光度。

图1 紫马铃薯花色苷的可见光谱图
由图1得出,紫马铃薯花色苷的最大吸收波长为535 nm。
1.3.1.2 花色苷含量的测定
花色苷含量采用pH示差法[9-10]进行测定。先确定合适的稀释因子,使样品在535 nm下的吸光度在分光光度计的线性范围内;然后制备两个样品稀释液,其中一个用氯化钾缓冲液(0.025 mol/L,pH 1.0)稀释,另一个用醋酸钠缓冲液(0.4 mol/L,pH 4.5)稀释,待稀释液平衡90 min后,用蒸馏水做空白,分别测定两种样品稀释液在535 nm和700 nm处的吸光度A。
花色苷含量(mg/g)=(A/εL)×Mr×DF×V/Wt
式中:A为吸光度,A=(A535nm,pH1.0-A700nm,pH1.0)-(A535nm,pH4.5-A700nm,pH4.5);ε为矢车菊素-3-葡萄糖苷的消光系数,26 900;DF为稀释因子;Mr为矢车菊素-3-葡萄糖苷的相对分子质量449.2;V为最终体积/mL;Wt为产品质量/g;L为光程,1 cm。
1.3.2 紫马铃薯花色苷的提取及测定
准确称取5.000 g紫马铃薯粉末,加入一定体积的2%的柠檬酸溶液,按相应的提取条件在超声波辅助下进行提取。取上清液在10 000 r/min速度下离心10 min,取上清液用 pH示差法测定花色苷的含量。
2 结果与分析
2.1 单因素试验
2.1.1 超声功率对紫马铃薯花色苷提取率的影响
准确称取5.000 g紫马铃薯粉末,以料液比(质量∶体积)为1∶30的比例加入2%的柠檬酸溶液,在超声功率分别为500、400、300、200 W时,温度40℃下提取15 min,每个条件做3次重复,研究超声功率对花色苷提取率的影响。

图2 超声功率对紫马铃薯花色苷提取得率的影响
从图2可以看出,当超声功率小于300 W时,随着超声功率的增加花色苷的提取率逐渐增大,当超声功率大于300 W时,花色苷的提取率又逐渐下降。这可能是由于随着超声功率的增强,细胞内物质不断被释放,同时一些能使花色苷分解的酶也被充分释放出来,从而导致其含量下降[11]。因此提取紫马铃薯花色苷的超声功率设定在300 W。
2.1.2 提取温度对紫马铃薯花色苷提取率的影响
准确称取5.000 g紫马铃薯粉末,以料液比为1∶30的比例加入2%的柠檬酸溶液,在超声功率为300 W,温度28、38、48、58℃下分别提取10 min,每个条件做3次重复,研究提取温度对花色苷提取率的影响。
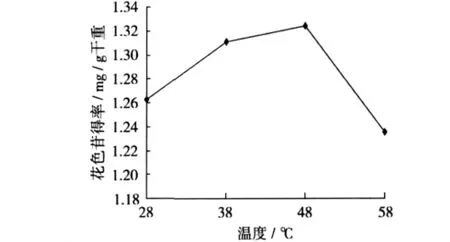
图3 提取温度对紫马铃薯花色苷提取得率的影响
升温有利于色素的溶出,提取温度为48℃时提取效果最好,继续升高温度,提取效果反而降低(图3)。可能是由于紫薯粉中含有一定量的淀粉,加热使其糊化,而阻止提取剂对色素的溶解[12],同时长时间处在较高温度下会影响花色苷的稳定性。
2.1.3 提取时间对紫马铃薯花色苷提取率的影响
准确称取5.000 g紫马铃薯粉末,以料液比为1∶30的比例加入2%的柠檬酸溶液,在超声功率为300 W,温度48℃下分别提取2、5、10、15、20、30、40 min,每个条件做3次重复,研究提取时间对花色苷提取率的影响。
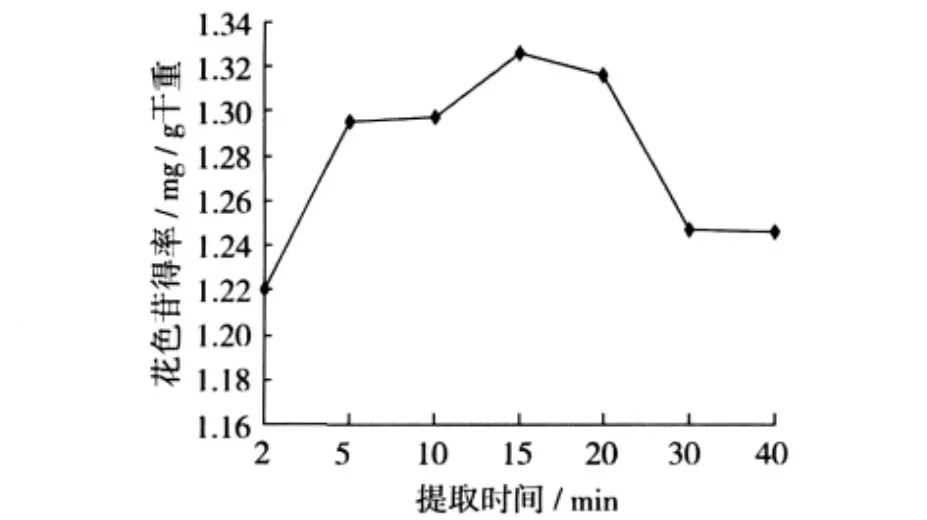
图4 提取时间对紫马铃薯花色苷提取得率的影响
超声处理时间的影响和原料的特性等有关[13]。超声提取时间因原料不同而不同,但提取得率不是随提取时间的无限延长而继续增加,是依据原料的不同、粉碎度等具体条件而定。从图4可以看出,随着提取时间的延长,花色苷的提取得率先上升,超过15 min后,提取得率开始下降,可能是高温长时对花色苷有一定的破坏作用。
2.1.4 料液比对紫马铃薯花色苷提取率的影响
准确称取5.000 g紫马铃薯粉末,分别以料液比为1∶10,1∶20,1∶30,1∶40,1∶50,1∶60的比例加入2%的柠檬酸溶液,在超声功率为300 W,温度48℃下提取15 min,每个条件做3次重复,研究料液比对花色苷提取率的影响。
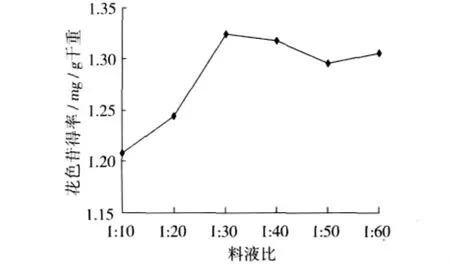
图5 料液比对紫马铃薯花色苷提取得率的影响
由图5可以看出,适当增加提取剂的用量有利于色素的溶出,可以提高花色苷的浸提率,物料比为1∶30时浸提效果最好。继续增加提取剂的用量时,提取效果没有明显的增加。
2.2 正交试验
根据单因素试验的结果,拟定4因素3水平试验,按正交试验设计表(表1)做紫马铃薯中花色苷提取的正交试验,结果列于表2。

表1 因素水平表
由表2可知,按照极差R的大小,影响花色苷提取率的因素主次顺序为D>C>B>A,即料液比>提取时间>温度>功率。根据K值可知4因素最优组合条件为A2B1C1D3,即料液比1∶40、提取时间5 min、提取温度35℃、提取功率350 W。

表2 正交试验结果和分析

表3 方差分析结果
由表3可知,料液比对花色苷提取率的影响最显著(P<0.01),其次是提取时间和温度(P<0.01),最不显著的是提取功率。这与正交试验结果获得的主次顺序D>C>B>A相符,即料液比>提取时间>温度>功率。综合上述结果,试验最终确定的提取条件为:A2B1C1D3,即料液比1∶40、提取时间5 min、提取温度35℃、提取功率350 W。
2.3 正交试验验证试验
在正交试验得到的花色苷提取理论最佳组合条件下进行花色苷提取,三次试验得到的花色苷得率为1.250 4 mg/g,1.255 8 mg/g,1.255 8 mg/g。该结果与正交试验最佳组合得到的得率1.254 0 mg/g基本相同,但正交试验中的最佳组合A2B1C2D3所用的时间较长,能耗较高,因此仍选择理论组合A2B1C1D3为最佳组合。
3 结论
以柠檬酸水溶液为提取剂,以紫马铃薯中花色苷的绝对含量作为提取得率的评价标准,提高了单纯采用吸光度值测定法作为评定指标的精确性与可靠性。通过正交试验确定的紫马铃薯花色苷色素的最佳提取工艺为:料液比1∶40、提取时间5 min、提取温度35℃、提取功率350 W,且柠檬酸浓度为2%。此工艺操作简便易行,省时,提取率较高。
[1]Kahkonen M P,Heinonen M.Antioxidant activity of anthocyanins and their aglycons[J].Journal of Agricultural and Food Chemistry,2003,51:628-633
[2]Bellido G G,Beta T.Anthocyanin composition and oxygen radical scavenging capacity(ORAC)of milled and pearled purple,black,and common barley[J].Journal of Agricultural and Food Chemistry,2009,57(3):1022-1028
[3]Wang L S,Stoner G D.Anthocyanins and their role in cancer prevention[J].Cancer Letters,2008,269(2):281-290
[4]高爱红,童华荣.天然食用色素——花色苷研究进展[J].保鲜与加工.2001(3):25-27
[5]Tsuda T.Regulation of adipocyte function by anthocyanins; possibility of preventing the metabolic syndrome[J].Journal of Agricultural and Food Chemistry,2008,56:642-646
[6]王华,丁刚,崔福君.葡萄酒中花色素苷研究现状[J].中外葡萄与葡萄酒,2002(2):25-28
[7]Ghosh D,Konishi T.Anthocyanins and anthocyanin-rich extracts:role in diabetes and eye function[J].Asia Pacific Journal of Clinical Nutrition,2007,16(2):200-208
[8]Jansen G,Flamme W.Coloured potatoes(Solanum tuberosum L.)-anthocyanin content and tuber quality[J].Genetic Resources and Crop Evolution,2006,53(7):1321-1331
[9]Ronald E W,Terry E A,Eric A D,et al.Handbook of food analytical chemistry.Pigments,colorants,flavors,texture and bioactive food components[M].USA:Wiley,2005:19-24
[10]Rapisarda F,Fanella F,Maccarone E.Reliability of analytical methods for determining anthocyanins in blood orange juices[J].Journal of Agricultural and Food Chemistry,2000,48(6):2249-2252
[11]任国艳,李八方,赵雪,等.海蜇头糖蛋白超声辅助提取工艺研究[J].农业工程学报,2008,24(2):255-258
[12]顾红梅,张新申,蒋小萍.紫薯中花色苷的超声波提取工艺[J].化学研究与应用,2004,16(3):404-408
[13]郭孝武,冯岳松.超声提取分离[M].北京:化学工业出版社,2008:38.
Extraction of Anthocyanins from Purple Potato
Cui Qian1Jiang Yihong1Wang Yingying1Xiong Yiqin2
(Bioengineering&Food Science College of Zhejiang University1,Hangzhou 310029)
(Hangzhou DaYi Technology Co.,Ltd.2,Hangzhou 310020)
In order to develop the resource of anthocyanins in purple potato,anthocyanin extraction technology was studied by conducting an orthogonal experiment on the basis of single factor tests.The anthocyanin yield was determined by the spectrophotometric pH differential method.The alternate action of ultrasonic power,extraction temperature,time and the ratio of sample weight to solvent volume were investigated.Citric acid solution was taken as extractant.Results:The sample/solvent ratio,extraction time and temperature have notable effects on anthocyanin yield while ultrasonic power has little effect.The optimum extraction conditions are sample to solvent ratio(m/V) 1∶40,extraction time 5 min,extraction temperature 35℃,and ultrasonic power 350 W.Additionally,taking citric acid solution as extractant reduces anthocyanins hydrolysis and production cost greatly.
purple potato,anthocyanins,extraction,orthogonal experiment
TS201.1 文献标识码:A 文章编号:1003-0174(2010)11-0106-04
宁波市重点科技攻关计划(H20090431)
2009-11-18
崔倩,女,1985年出生,硕士,食品科学
蒋益虹,女,1972年出生,副教授,硕士生导师,食品科学

