桑叶多酚氧化酶的固定化及酶学性质研究
杨 洋,黄 涛,关红艳,吴小玉
(1.广西大学生命科学与技术学院,广西南宁 530004; 2.广西大学轻工与食品工程学院,广西南宁 530004)
桑叶多酚氧化酶的固定化及酶学性质研究
杨 洋1,黄 涛2,关红艳2,吴小玉1
(1.广西大学生命科学与技术学院,广西南宁 530004; 2.广西大学轻工与食品工程学院,广西南宁 530004)
研究了桑叶多酚氧化酶(PPO)的动力学特性,结果表明,其最适温度为 40℃,最适 pH为 7.0,酶动力学参数Km=0.093mol/L。用浓度质量分数为 4%海藻酸钠、体积分数为 0.2%戊二醛、0.2mol/L的 CaCl2固定多酚氧化酶,固定时间 2h,交联时间 4h,能使固定化多酚氧化酶的活力达到最大。固定化酶的最适 pH为 6.0,固定化酶的最佳反应温度为 50℃,固定化酶对温度的敏感度降低,温度变化对固定化酶酶活力的影响不大。
桑叶,多酚氧化酶,动力学,固定化
1 材料与方法
1.1 材料与仪器
桑叶 PPO 实验室自制;考马斯亮蓝 G-250、邻苯二酚、焦性没食子酸、间苯二酚、对苯二酚、二苯胺、对氨基苯磺酸、聚乙二醇 20000、十二烷基磺酸钠(SDS)、丙烯酰胺 (Acr)、N,N’-甲叉双丙烯酰胺(Bis)、三羟甲基氨基甲烷 (Tris)、四甲基乙二胺(TEMED)、壳聚糖、醋酸、石蜡、硅藻土、海藻酸钠、戊二醛、Tween 80、KH2PO4、Na2HPO4等化学试剂 均为分析纯。
扫描电子显微镜 S-3400N 购自日本日立公司;PL2002电子天平 购自特勒-托利多仪器有限公司;UV1240型紫外分光光度计 购自日本岛津公司;BECK MAN J2-MC高速冷冻离心机 购自美国贝克曼库尔特有限公司。
1.2 扫描电子显微镜观测 PPO结构
将桑叶 PPO冷冻干燥样品固定在观测台上,然后喷金,以扫描电子显微镜 S-3400N观测 PPO分子形态,同时观测其均一性程度。
1.3 PPO的 SDS-PAGE电泳纯度鉴定、分子量测定
采用聚丙烯酰胺凝胶电泳鉴定酶的纯度和测定分子量。
1.4 酶活性和蛋白质含量测定方法
1.4.1 桑叶 PPO活性测定 参照杨昌鹏等人报道的分光光度计比色法[7],取磷酸盐缓冲液 3.9mL,加入0.02mol/L焦性没食子酸溶液 1mL,PPO粗酶液0.1mL混匀后在 30℃下反应 5min,在 420nm波长下测定其吸光度的变化,每 60s记录一次OD值随时间的变化,以最初直线段的斜率计算酶活力。一个酶活力单位定义为:在测定条件下,每分钟引起吸光度改变 0.001所需的酶量。
1.4.2 蛋白质含量测定 采用考马斯亮蓝法(Bradford法)[8],以牛血清蛋白为标准,在 595nm波长下测定酶液的蛋白质含量;但在层析过程中以收集液的吸光光度值 (OD280)来表示蛋白质含量的变化。
1.5 酶学性质研究
1.5.1 底物专一性 测定底物专一性时,分别以0.02mol/L的邻苯二酚、焦性没食子酸、间苯二酚、对苯二酚、二苯胺、对氨基苯磺酸为底物,测定 PPO活性。
1.5.2 动力学参数米氏常数 Km测定 取 5组试管,每组 4支试管,1支空白,3支平行管。每支试管分别加入 3.9mL的磷酸盐缓冲溶液,每组分别加入 30、20、10、5、1mmol/L焦性没食子酸为底物,0.1mL酶液,在 30℃条件下反应 5min后,测定 420nm处的吸光度,以反应物 420nm处吸光度直接表示活力大小。测定 PPO活性,根据 Lineweawer-Burk[9]双倒数作图法计算其Km值。
1.6 桑叶 PPO的固定化
1.6.1 固定化方法
1.6.1.1 树脂法 取 0.5g树脂AB-8,加入多酚氧化酶 4mg,和磷酸缓冲液 (0.1mol/L,pH6.0)1mL,室温下,于摇床中振荡吸附 6h,加入戊二醛至终浓度0.1%,30℃下交联 8h,用蒸馏水洗去游离酶和残余的戊二醛,于 4℃下储存,备用。
1.6.1.2 硅藻土吸附海藻酸钠包埋法 分别往适量的硅藻土中加入多酚氧化酶 4mg,和磷酸缓冲液(0.1mol/L,pH6.0)1mL,混合均匀,室温下,于摇床中振荡吸附 6h,加入戊二醛至终浓度 0.1%,30℃下交联 8h,过滤洗涤,洗去游离酶和残余的戊二醛,加入4%海藻酸钠,混合均匀,用注射器滴入 2%的氯化钙溶液中,立即可以见到小球形成,且由透明变成白色并沉淀,用滤纸滤出小球体,并用相同的 CaCl2溶液浸泡 2h左右固定化,滤出小球体,操作完毕后,移入4℃的冰箱中硬化 2h,然后用蒸馏水洗涤,加入戊二醛溶液交联 4h,再用蒸馏水洗涤,得到固定化酶。于4℃下储存,备用。
1.6.1.3 壳聚糖微球固定法 称取适量的壳聚糖微球载体,加入适量的多酚氧化酶液中,30℃下恒温振荡 1h,于4℃下放置过夜,弃去上层溶液,用大量蒸馏水反复洗涤,洗去游离酶,于 4℃下储存,备用。
1.6.2 固定化酶的酶学性质
1.6.2.1 固定化酶的最适反应 pH 固定化酶活力测定体系用 pH分别为 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0的一系列缓冲溶液,测定不同 pH下固定化酶的活力,比较不同 pH下固定化酶和游离酶的最佳反应pH。
1.6.2.2 固定化酶的最适反应温度 分别在 20、30、40、50、60、70℃温度下测定固定化酶的活力,比较不同温度下固定化酶和游离酶的最适反应温度。
2 结果与分析
2.1 观测桑叶 PPO结构
桑叶 PPO的扫描电子显微镜观测如图 1所示,从图中可以看到,PPO酶液经过 Sephadex G-75凝胶柱层析分离以后,得到比较均一的结构。同时也可以看到桑叶 PPO为纤维状蛋白,根据观测结果计算可知,桑叶 PPO分子长度在 4~12μm之间,宽度在0.5~1.5μm之间。具有酶活性的蛋白质通常由几百个氨基酸组成,其作用的底物大多数为小分子,因此酶分子与底物直接发生作用的仅仅只有一小部分氨基酸侧链,这些与酶催化活性有关的氨基酸侧链称为酶的活性中心。即酶活性中心是指酶与底物结合并使之反应的区域,一般位于酶分子表面的裂缝或凹槽,往往是疏水区,可容纳一个或多个小分子底物或大分子底物的一部分,这就是酶的活性中心。从图 1可以看到,在桑叶 PPO的晶体两端都有凹槽,应为此酶的活性中心。
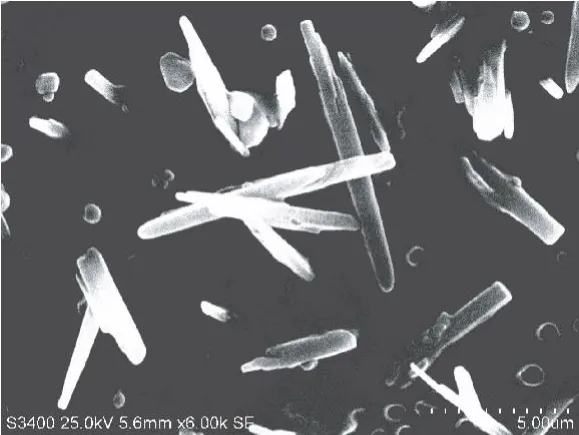
图1 扫描电子显微镜观测桑叶 PPO结构图
天然状态的酶具有完整的三维空间结构,其中活性部位跟其他结构部位相比,具有较大的柔性,也就是说酶活性部位基因的运动性较大。当低浓度变性剂作用时,酶分子整体刚性部分构象保持完整,而较柔性的活性部位的局部结构已发生明显变化,如活性基团的相互靠近和立体取向受到破坏,导致酶活性的丧失。
2.2 桑叶 PPO的纯度鉴定及分子量测定
桑叶 PPO经过 Sephadex G-75凝胶层析后,透析,浓缩,采用聚丙烯酰胺凝胶电泳鉴定纯度,见图 2。发现只有一条谱带,说明此酶已经达到电泳纯。有关桑叶多酚氧化酶同工酶的鉴定尚待进一步研究。

图2 蛋白质的SDS-PAGE电泳图谱
电泳结果如图 2所示,可以看出桑叶 PPO的条带堆滞在 47kDa附近,因此分子量测定约为 47kDa。
2.3 PPO酶学性质研究
2.3.1 PPO的底物专一性 从表 1可以看出,桑叶PPO迅速地催化焦性没食子酸的酶促氧化反应,催化邻苯二酚的氧化反应速率为焦性没食子酸的 2.5倍,而对对苯二酚、没食子酸、间苯二酚、对氨基苯磺酸的活性较小,对二苯胺则完全无催化活性。这表明焦性没食子酸为桑叶 PPO的主要氧化底物。

表1 不同底物对酶活性的影响
2.3.2 动力学参数米氏常数 以焦性没食子酸为底物,缓冲液为磷酸盐缓冲液(pH6.0,0.02mol/L),底物浓度分别为 30、20、10、5、1mmol/L。总反应体积都为3.9mL。在 30℃下反应 5min,以反应物 420nm处吸光度测定酶活。以 1/[S]和 1/V为横纵坐标作Lineweaver-Burk图 (图 3)。求得该 PPO催化焦性没食子酸水解的 Km为 0.093mol/L。因此,米氏常数Km值实际上也是酶与底物亲合力大小的反映,即Km值越小,酶与底物的亲合力越大。

图 3 Lineweaver-Burk图
2.4 PPO的固定化研究
2.4.1 固定化载体的优化 从表2看出,树脂法吸附性差,不能将 PPO很好地吸附,因此不能将 PPO固定化;采用壳聚糖微球固定法将 PPO固定化,吸附能力过强,通透性也差,固定化酶活性也随之下降;以硅藻土吸附海藻酸钠包埋法比壳聚糖微球固定法的效果好,能将 PPO很好地固定。

表 2 不同载体的固定化多酚氧化酶活力
分别往适量的硅藻土中加入 PPO 4mg和磷酸缓冲液(0.1mol/L,pH6.0)1mL,混合均匀,室温下,于摇床中振荡吸附 6h,加入戊二醛至终浓度 0.1%(体积分数),30℃下交联 8h,过滤洗涤,洗去游离酶和残余的戊二醛,加入质量分数 4%海藻酸钠,混合均匀,用注射器滴入质量分数 2%的氯化钙溶液中,立即可以见到小球形成,且由透明变成白色并沉淀,用滤纸滤出小球体,并用相同的 CaCl2溶液浸泡 2h左右固定化,滤出小球体,操作完毕后,移入 4℃的冰箱中硬化 2h,然后用蒸馏水洗涤,加入戊二醛溶液交联 4h,再用蒸馏水洗涤,得到固定化酶。
2.4.2 硅藻土吸附海藻酸钠包埋法固定 PPO条件的优化
2.4.2.1 海藻酸钠浓度对固定化酶活性的影响 从图 4可以看出,海藻酸钠浓度低时,酶泄漏严重,清洗固定化酶小球时,酶的损失较多,酶活力下降,酶活力随海藻酸钠浓度的增大而提高,当海藻酸钠浓度达到质量分数 0.4%时,酶活力达到最大值,之后酶活力略有下降,可能是固定化酶负载量过大,使得载体强度不够,酶反而容易泄露。加上海藻酸钠浓度高时,微环境效应和扩散阻力对反应影响更大,且不易操作,很难将酶液从注射器中挤出。故选用质量分数 0.4%海藻酸钠对酶进行固定化较为适宜。
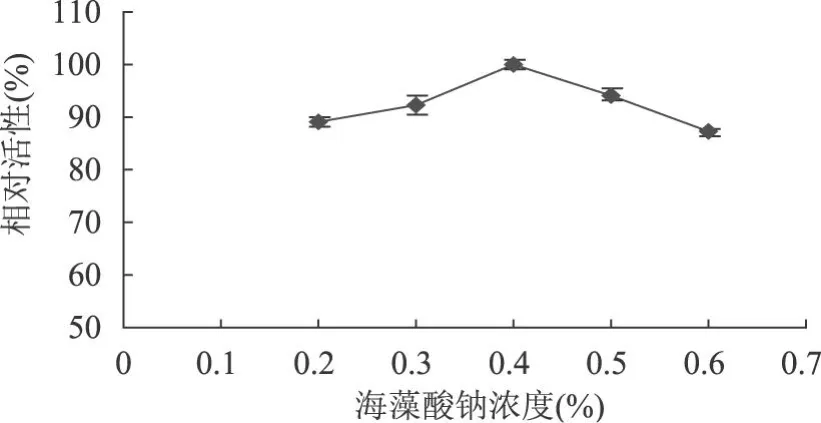
图 4 海藻酸钠浓度对固定化酶活性的影响
2.4.2.2 固定化时间对固定化酶活性的影响 固定化时间对固定化酶活力的影响如图 5所示,可以看出,当固定化时间为 2h时,固定化酶活力最高,固定化时间过短或过长,固定化酶活力均有不同程度的下降。究其原因,固定化酶的活性受到两个方面的综合影响,一方面随着固定化时间的延长,多酚氧化酶固化越来越充分,酶在海藻酸钙凝胶中包埋得更牢固,有利于固定化酶活力的提高;另一方面,随着固定化时间的延长,Ca2+对固定化酶的抑制作用加剧,使酶活力下降。
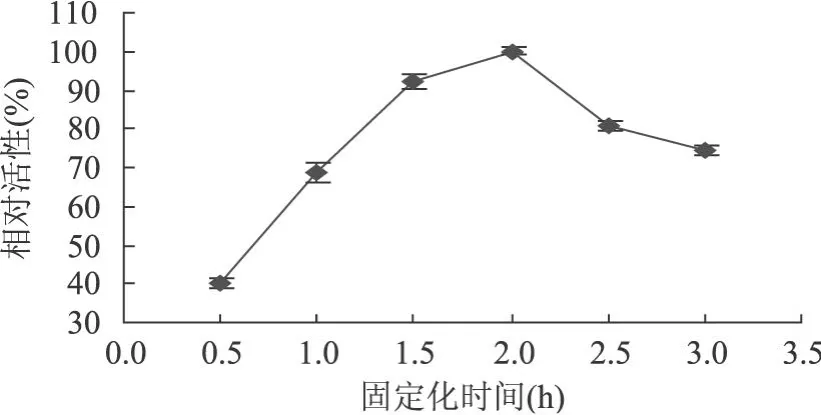
图 5 固定化时间对固定化酶活性的影响
2.4.2.3 交联时间对固定化酶活性的影响 实验结果如图 6所示,在实验范围内,交联时间对固定化酶活力的影响较小,固定化酶交联不同时间后,其相对酶活力均在 75%以上,交联时间为 4h时,固定化乳酸氧化酶相对酶活力最高,交联时间过长或过短,酶活力均有所下降。这可能是因为分子间交联反应达饱和后,随着时间的延长,开始发生酶分子内交联,增加了酶分子间的空间位阻,直接影响到酶活性中心对底物的定位作用。且内扩散阻力也增大,从而使固定化后有部分酶蛋白失活。
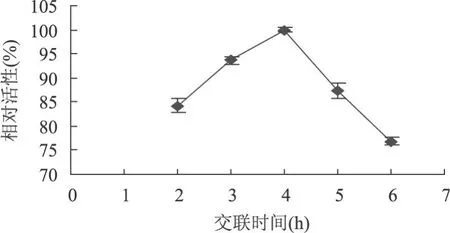
图 6 交联时间对固定化酶活性的影响
2.4.3 固定化酶的酶学性质
2.4.3.1 pH对固定化酶活性的影响 酶存在于生物体中,具有很高的催化活性。但是它对于所处的微环境也有很高的要求。例如溶液的酸碱性对于酶的活力具有很大的影响。我们实验了在不同的 pH条件下,液相以及固定化多酚氧化酶的活力,所得结果如图7所示。
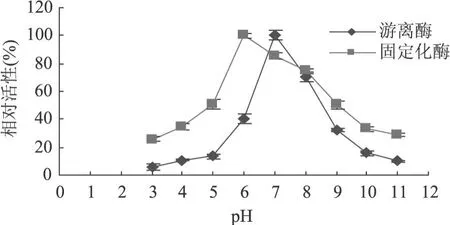
图7 pH对固定化和游离 PPO活性的影响
由图 7可以看出,固定化酶的最适 pH为 6.0,与游离酶相比,其最适 pH发生了变化,由 7.0变为了6.0。固定化酶的最适 pH较游离酶的最适 pH发生了偏移,可能由于两种因素造成:一是载体含有大量带电基团,其多电解质的微环境影响着酶的活力;二是由于酶的作用产物导致在固定化酶颗粒内建立一种带电的微环境。
2.4.3.2 温度对固定化酶活性的影响 不同酶的热稳定性不同。在温度低于最适反应温度时,酶反应速度随着温度的升高而增加,这时酶蛋白的热变性不是主要的;在温度超过最适温度时,反应速度反而会随着温度的升高而下降,这时酶热变性造成的影响比升温引起反应加速的影响更大。固定化多酚氧化酶最适反应温度曲线和热稳定性曲线分别如图 8和 9所示。
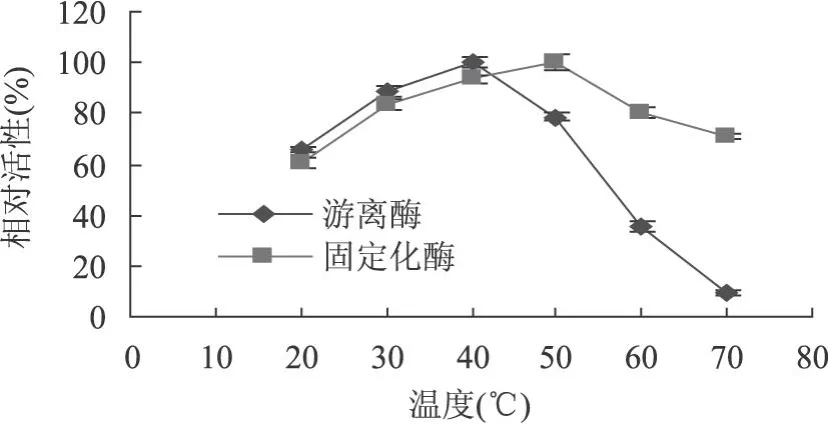
图8 温度对固定化和游离 PPO活性的影响
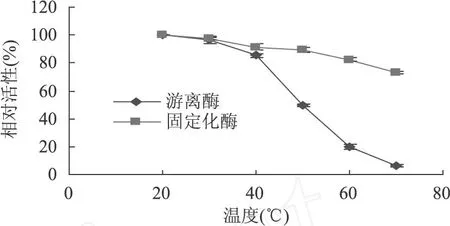
图9 固定化和游离 PPO的热稳定性
图 8中相对酶活指不同温度条件下,加入等量酶液或固定化酶反应的表观酶占其中最大值的百分比。游离酶的活力随着温度的上升迅速增大,到达40℃左右达到最大,说明游离酶的最佳反应温度在40℃。固定化酶的最佳反应温度为 50℃。游离和固定化酶在 40℃之前保持着良好的热稳定性,但是温度到达 60℃时,游离酶的活力损失严重,而固定化酶仍然保持着较高的酶活力。由此可见,固定化酶对温度的敏感度降低,温度变化对固定化酶酶活力的影响不大。
3 结论
通过对多酚氧化酶性质的研究,结果表明:用扫描电镜观察经过分离纯化的桑叶多酚氧化酶,其为纤维状蛋白,分子长度在 4~12μm之间,宽度在0.5~1.5μm之间。桑叶多酚氧化酶的分子量约为47kDa;最适底物为焦性没食子酸;最适 pH为 7.0;最适温度为 40℃。PPO的 Km值为 0.093mol/L。
研究了桑叶多酚氧化酶的固定化:用浓度质量分数为4%海藻酸钠、体积分数0.2%戊二醛、0.2mol/L的CaCl2固定多酚氧化酶,固定时间 2h,交联时间 4h,能使固定化多酚氧化酶的活力达到最大。固定化酶的最适 pH为 6.0,固定化酶的最佳反应温度为 50℃,固定化酶对温度的敏感度降低,温度变化对固定化酶酶活力的影响不大。
[1]Baik B-K,Czuchjowska Z,Pomeranz Y.Comparison of Polyphenol Oxidase Activities in Wheatsand Floursfrom Australian and US Cultivars[J].Journal of Cereal Science,1994 (19):291-296.
[2]Tomas-Barberran F A,Espin J C.Phenolic Compounds and Relateed Enzyme as Determinants of Quality in Fruits and Vegetables[J].J Sci Food Agric,2001,81:853-876.
[3]高丽锋,李彩霞,毛雪,等 .棉花不同抗、感蚜虫品种的多酚氧化酶同工酶分析[J].山西农业大学学报,1997,17(3):229-231.
[4]曾晓雄,罗泽民 .酶在茶叶加工中的应用研究现状与展望[J].食品工业科技,1993(5):24-27.
[5]何雪梅,廖森泰,刘吉平 .桑树的营养功能性成分及药理作用研究进展[J].蚕业科学,2004,30(4):390-394.
[6]Hosseinzadeh H,Sadeghi A.Anfihyperglycemic effects of Morus nigra and Morus alba in mice[J].Pharm Pharmacol Lett, 1999,9(2):63-65.
[7]Chang-Peng Yang,Shuji Fujita,MD Ashrafuzzaman,et al.Purification and characterization of polyphenol oxidase from banana(M usa sapientum L.)pulp[J].Journal of Agricultural and Food Chemistry,2000,48(7):2732-2735.
[8]FangerB O.Adaptation of the Bradford Protein BindingAssay toMembrane-Bound Proteins by Solubilizing in Glucopyranoside Detergents[J].AnalBiochem,1987,162:11-17.
[9]Lineweaver H.,Burk B.The deter minationofenzyme dissociation constants[J].J Am Chem Sci,1934,56:658-666.
Study on the immobilization of polyphenol oxidase of mulberry leaf
YANG Yang1,HUANG Tao2,GUAN Hong-yan2,W U X iao-yu1
(1.College ofLife Science and Technology,Nanning 530004,China; 2.College ofLight Industry and Food Engineering.,GuangxiUniversity,Nanning 530004,China)
Kine tic cha rac te ris tics of p olyp henol oxidase(PPO)in m ulbe rry leaf we re s tud ied.The result showed tha t the op t im um pH and temp e ra ture was7.0and40℃,resp ec tive ly,and the M ichae liscons tant was0.093m ol/L.The imm ob iliza tion of PPO from m ulbe rry leaf was resea rched.The ac tivity of imm ob ilized PPO reached its m ax im um when4% sod ium a lg ina te,0.2% g luta ra ldehyde,0.2m ol/Lwe re used to imm ob ilize the PPO,in an mim ob iliza tion t im e of2h and c ross linking t im e of4h.The op t im um pH and temp e ra ture was6.0,and 50℃resp ec tive ly,and the enzym e becam e less suscep tib le to the temp e ra ture,the temp e ra ture d id little affec t to the enzym a tic ac tivity.
m ulbe rry leaf;p olyp henol oxidase;kine tics; imm ob iliza tion
TS201.2+5
A
1002-0306(2010)02-0245-05
多酚氧化酶是遍布动植物体内的一种胞内酶,在植物体内主要与抗病等有关[1-2];在食品保鲜方面,多酚氧化酶(PPO)与果蔬的褐变、黑色素合成有关,它可以氧化多酚成醌,使产品颜色变深,并使风味产生一定变化;PPO与昆虫的发育有密切关系,可以通过研究它开发杀虫农药[3]。PPO能促使儿茶素类物质氧化形成茶黄素、茶红素和其它的氧化聚合物,同时伴随儿茶素的氧化,氨基酸、胡萝卜类等香气前体发生偶联氧化,产生各种各样的香气化合物,并形成红茶的基本风味[4]。由于 PPO潜在的应用背景及对人体健康的影响和环境保护方面的因素,故对它的研究具有广泛的理论意义和实际应用价值。人们做了很多的关于多酚氧化酶的研究工作,其中最受关注的问题集中在不同介质及不同温度、不同条件下的多酚氧化酶的活性研究。但对于桑叶多酚氧化酶的固定化研究尚未见报道。桑树是我国重要的经济作物,桑叶不仅是家蚕的最好饲料,而且桑叶和桑根等又自古入药[5-6]。为此,本文以桑叶 PPO为研究对象,研究桑叶 PPO酶学性质和固定化,为桑叶PPO的亚细胞定位及进一步开发利用桑树资源和桑叶多酚氧化酶的开发应用提供依据。
2009-03-23
杨洋(1956-),女,教授,研究方向:天然植物生物活性研究。

