酰化对大豆蛋白分子结构影响的研究
姚玉静,杨晓泉,苏新国,许彩虹
(1.广东食品药品职业学院,广东广州 510520; 2.华南理工大学轻工与食品学院,广东广州 510640)
酰化对大豆蛋白分子结构影响的研究
姚玉静1,2,杨晓泉2,*,苏新国1,许彩虹2
(1.广东食品药品职业学院,广东广州 510520; 2.华南理工大学轻工与食品学院,广东广州 510640)
目的:研究化学改性对大豆分离蛋白(SPI)分子结构的影响;方法:采用 SDS-PAGE电泳、DSC热分析手段探讨酰化对蛋白分子结构特征的影响;结果:DSC图谱显示,SPI经过琥珀酰化处理后热稳定性得到显著改善,乙酰化处理对大豆蛋白的热稳定性影响不大。SDS-PAGE电泳结果显示,改性后蛋白的 11S酸性亚基和 7S含量大大减少,说明 SPI经酰化处理后亚基发生了降解。随着酸酐添加量的增大,11S球蛋白分子逐步分解为亚基。琥珀酰化的电泳图谱预示着可能存在一个琥珀酰化的临界点,在这一点上,解离的蛋白亚基突然展开。结论:实验结果有助于阐明 SPI酰化后功能性质发生变化的内在结构因素。
乙酸酐,琥珀酸酐,大豆分离蛋白,电泳,差示扫描量热法
1 材料与方法
1.1 实验材料
大豆分离蛋白(SPI) 哈尔滨黎明A,其组成成分为水分 5.97%,灰分 2.83%,脂肪 0.90%,蛋白质含量90.8%。
1.2 实验方法
1.2.1 乙酰化或琥珀酰化[4]6%(w/v)大豆分离蛋白溶液在搅拌条件下分多次加入 0.1、0.3、0.6、0.9g/g蛋白的乙酸酐或琥珀酸酐。反应过程中以 1mol/L NaOH调节溶液 pH在 7.5~8.5范围。反应结束后用去离子水透析(4℃,24h),然后冷冻干燥备用。
1.2.2 酰基化程度的测定[5]采用 Paik等的茚三酮比色法测定蛋白质的酰化程度,吸取浓度为 1% (w/v)的蛋白液 1mL,加入 2%(w/v)茚三酮溶液1mL,混合液于 100℃水浴上加热 5min,迅速冷至25℃,加入 5mL蒸馏水,在 580nm波长下,测定溶液的吸光度,以 2%(w/v)茚三酮溶液为参比液。
2%(w/v)茚三酮溶液的配制[5]:30mL柠檬酸缓冲液 (0.2mol/L,pH5)与 30mL的茚三酮溶液 (浓度为 4%,溶剂为 2-乙氧基乙醇)混合,加入 50mg氯化亚锡(SnCl2·H2O),搅拌过滤备用。
1.2.3 蛋白质含量测定 凯氏定氮法 (GB/T 5009.5 -2003)。
1.2.4 热变性温度的测定 采用差示扫描量热仪(DSC)对固体粉末状样品进行热分析。DSC为杜邦公司的 1090B-910DSC。氮气的速率为 40mL/min,使用铟 (Tf=156.4℃)作为温度校正标准。样品重量约为 8mg。参照池为空铝盒,扫描速率为 5℃/min,扫描温度范围为 25~160℃。
1.2.5 SDS-PAGE(测定亚基降解程度) 采用LaemmLi[6]的方法,分离胶浓度 12%,浓缩胶浓度3%。样品溶液与样品缓冲液 1∶1(v/v)混合,电泳前沸水沸腾 5min。上样量为 15μL,浓缩胶中为 15mA,进入分离胶后增至 25mA。电泳完毕后以考马斯亮蓝 R-250染色。
说明:各测定过程除特别说明外,均在室温下进行,重复三次,以平均值作为实验结果。
2 结果与讨论
2.1 DSC热分析
本实验采用差示扫描量热仪 (DSC)对市售 SPI及其酰化蛋白的热性质进行了分析研究。图 1~图 4即为市售 SPI及其琥珀酰化蛋白的 DSC曲线 (第一次扫描)。
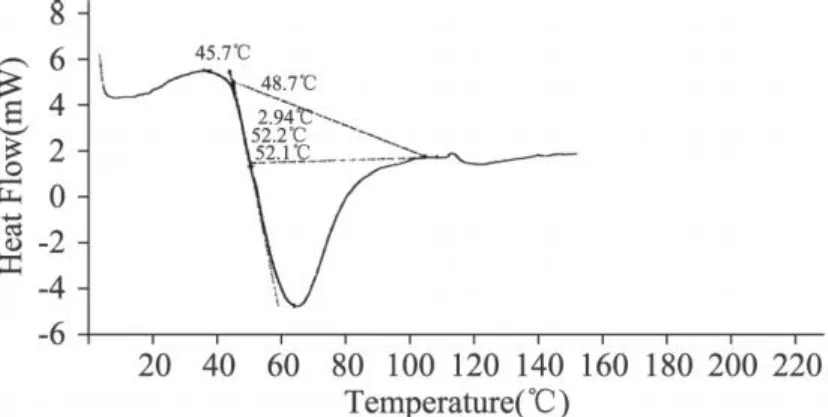
图1 未改性大豆分离蛋白的DSC图谱
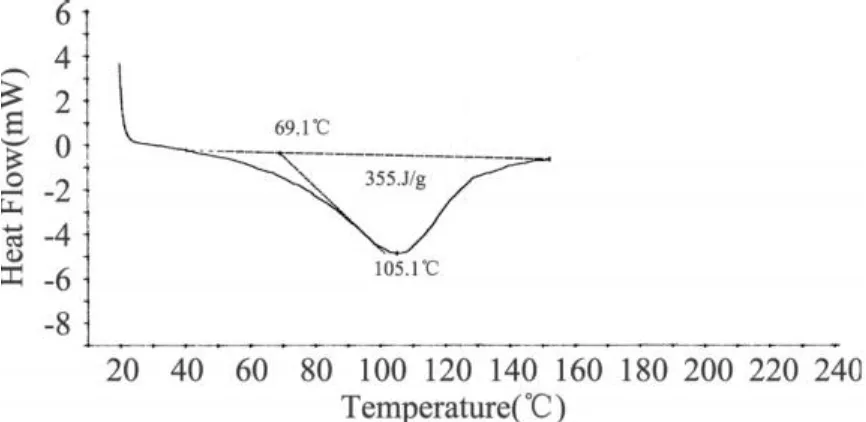
图 2 琥珀酰化程度为 0.1g/g蛋白的 SPI的DSC图谱
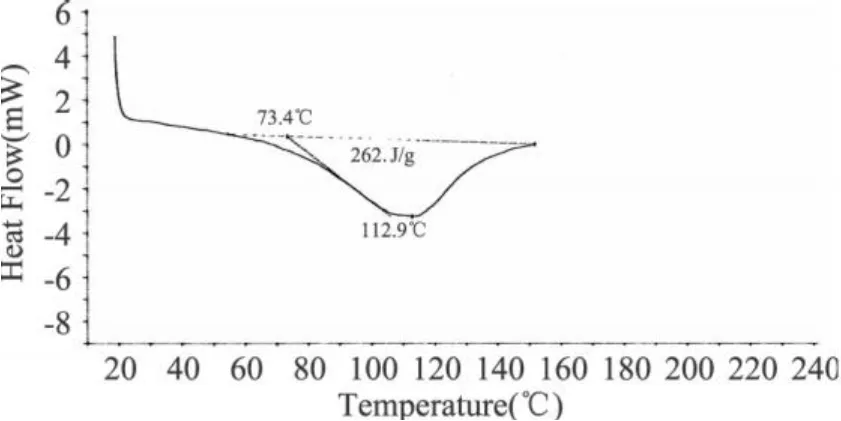
图 3 琥珀酰化程度为 0.3g/g蛋白的 SPI的DSC图谱
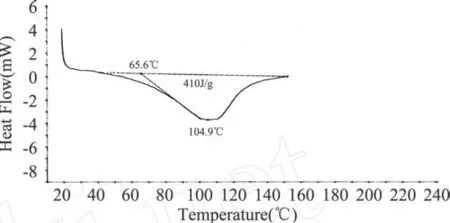
图 4 琥珀酰化程度为 0.6g/g蛋白的 SPI的DSC图谱
市售大豆蛋白的峰温为 65.8℃(见表 1),说明原大豆蛋白经过一系列加工处理,已经发生了很大的变性,可以推测蛋白质变性对吸热峰的贡献不大,水峰的贡献占主导。从表 1可见,琥珀酰化蛋白的吸热峰温度范围都高于未改性大豆蛋白的,琥珀酰化三个改性程度的吸热峰都大于 100℃,主要是蛋白质峰的贡献;而乙酰化蛋白随着酸酐添加量的增大,吸热峰温度与未改性 SPI差别不明显,乙酰化三个改性程度的吸热峰主要是水峰 (50~70℃)的贡献。说明大豆蛋白经过琥珀酰化处理后热稳定性得到明显改善,乙酰化处理对大豆蛋白的热稳定性影响不大。

表 1 酰化改性对大豆分离蛋白DSC峰温(Td)的影响
2.2 SDS-PAGE电泳分析
图 5为酰化 SPI的聚丙烯酰胺电泳图谱。从图中可见,改性后蛋白的 11S酸性亚基和 7S含量大大减少,说明 SPI经酰化处理后亚基发生了降解,随着酰化程度的增大,11S球蛋白分子逐步分解为小分子量的亚基。乙酰化 0.1g/g蛋白时,亚基降解程度已经很大,琥珀酰化则是从 0.3g/g蛋白增加到 0.6g/g蛋白时,7S和 11S蛋白带大量消失,这些变化反映了乙酰化对蛋白质分子结构的破坏剧烈,琥珀酰化则温和许多;此外可能存在一个琥珀酰化的临界点,在这一点上,解离的蛋白亚基突然展开。这种现象也可见于花生球蛋白[7]、向日葵蛋白[8]、油菜籽蛋白[9]和豌豆球蛋白[10]的琥珀酰化研究中。研究发现豌豆球蛋白轻微的琥珀酰化不足以使蛋白质解离,豌豆球蛋白 45%的赖氨酸残基琥珀酰化时,仅有 20%的蛋白质解离。对向日葵蛋白的琥珀酰化研究发现, 11S和 7S蛋白随酰化程度的增加而消失,取而代之的是 2.5S蛋白的增加。

图5 酰化蛋白的SDS-PAGE图谱
3 结论
DSC图谱显示,琥珀酰化三个程度的吸热峰都大于 100℃,说明大豆蛋白经琥珀酰化处理后热稳定性得到显著改善。乙酰化三个改性程度的吸热峰主要是水峰(50~70℃)的贡献,与未改性 SPI相比没有明显变化,说明乙酰化处理对 SPI的热稳定性影响不大。SDS-PAGE电泳结果显示,改性后蛋白的 11S酸性亚基和 7S含量大大减少,说明 SPI经酰化处理后亚基发生了降解。随着酸酐添加量的增大,11S球蛋白分子逐步分解为小分子量的亚基。其中乙酰化对蛋白质分子结构的破坏剧烈,琥珀酰化则温和许多。此外可能存在一个琥珀酰化的临界点,在这一点上,解离的蛋白亚基突然展开。
[1]姚玉静,杨晓泉 .乙酰化大豆分离蛋白的功能特性研究[J].中国调味品,2001(9):16-19.
[2]姚玉静,杨晓泉,等 .酰化对大豆分离蛋白水合性质的影响[J].食品与机械,2005,22(4):19-21.
[3]姚玉静,杨晓泉,等 .酰化对大豆分离蛋白乳化性能的影响[J].食品与机械,2008,24(2):12-14.
[4]Tarek A El-Adawy.Functional properties and nutritional quality of acetylated and succinylated mung bean protein isolate [J].Food Chem,2000,70(1):83-91.
[5]WK Paik,K im S.Effect of methylation on susceptibility of protein to proteolytic enzymes[J].Biochemistry,1972,11(14):2589-2593.
[6]LaemmLi U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680-685.
[7]KJ Shetty,MSN Rao.Effect of Succinylation on the oligomeric structure of arachin[J].International Journal of Peptide and Protein Research,1978,11(4):305-313.
[8]KD Schwenke,E Rauschal,D Zir wer,et al.Structural changes of the 11 S globulin from sunflower seed(Helianthus annuus L.) after succinylation[J].International Journal of Peptide and Protein Research,1985,25(4):347-354.
[9]KD Schwenke,KJ Linow,D Zir wer.Modification of the oligomeric structure of 11 S globulin from sunflower(Helianthus annuus L.)and rape(B rassica napus L.)seeds by succinylation [J].Food/Nahrung,1986,30(3):263-270.
[10]KD Schwenke,D Zirwer,et al.Changes of the oligomeric structure of legumin from pea(Pisum sativum L.) after succinylation[J].European Journal of Biochemistry,1990,194 (2):621-627.
Effect of succinic anhydride and acetic anhydride on the structure of soybean protein
YAO Yu-jing1,2,YANG Xiao-quan2,*,SU Xin-guo1,XU Ca i-hong2
(1.Food Science Depar tment,Guangdong Food and DrugVocational College,Guangzhou 510520,China; 2.College ofLight Industry&Food,South China University of Technology,Guangzhou 510640,China)
O b jec tive:The effec t of chem ica l m od ifica tion on the s truc ture of soybean p rote in isola te(SPI)was s tud ied.M e thods:SDS-PAGE and DSC we re used to obse rve the d issoc ia tion of subunit p rote ins and the hea t s tab ility of acyla ted SPI resp ec tive ly.Results:DSC p rofile showed tha t succ inyla tion s ignificantly imp roved the hea t s tab ility of SPI,while the ace tyla tion had no s ignificant change.SDS-PAGE p rofile showed tha t7S g lobulin and m os t of the ac id subunits of11S g lobulin d isapp ea red due to acyla tion.Itwas a lso ind ica ted a coop e ra tive p rocess lead ing to a sudden unfold ing of the d issoc ia ted subunits a t a ce rta in c ritica l leve l of succ inyla tion.Conc lus ion:The exp e r im ent results show ing the changes in the s truc ture p rop e rties of acyla ted SPI could he lp to e luc ida te the changes in its func tiona lp rop e rties due to acyla tion.
ace tyla tion;succ inyla tion;soybean p rote in isola te;e lec trop hores is;d iffe rentia l scanning ca lor im e try
TS201.2+1
A
1002-0306(2010)03-0122-03
随着自动化生产和产品配方的日趋精确化,食品工业对食品成分和蛋白质组分的功能规范也提出更高的要求,需要有标准方法来定量描述蛋白质功能特性,阐明蛋白质结构功能间的关系。所以,有必要深入了解不同条件下,蛋白质结构特性与其功能性的关系,阐明蛋白质功能与结构在应用中的一一对应关系,以便在具体的应用中,我们可以自主选择适合的蛋白质,或是为了改善某种功能,知道应采取怎样的改性措施。本文作者采用酰化试剂对市售大豆分离蛋白进行化学改性,以便改善大豆蛋白质的功能特性,以及探索其内在结构和物化性质对功能性质的影响。酰化反应所造成的蛋白质功能特性的变化都与蛋白质的分子结构变化有关,从前述的一些实验结果[1-3]中已经证实了其中的一些变化,譬如酰化后的大豆蛋白黏度增高意味着蛋白质分子展开或膨胀,分子体积增加。为了能进一步认识蛋白质有关性能变化的机理,本实验通过电泳、DSC热分析来探讨酰化对蛋白分子结构特征的影响,以期阐明SPI酰化后功能性质发生变化的内在结构因素。
2009-09-22 *通讯联系人
姚玉静(1979-),女,在读博士研究生,研究方向:食品科学。
国家科技支撑计划(2006BAD27B04)。

