转谷氨酰胺酶诱导复合蛋白冷致凝胶性能及对茶碱的控释研究
王晓园,杨晓泉
(华南理工大学轻工与食品学院,广东广州 510641)
转谷氨酰胺酶诱导复合蛋白冷致凝胶性能及对茶碱的控释研究
王晓园,杨晓泉*
(华南理工大学轻工与食品学院,广东广州 510641)
利用转谷氨酰胺酶(MTG酶)诱导大豆分离蛋白-明胶形成复合蛋白冷致凝胶并将其用作茶碱的控释载体,同时对其在模拟胃液和肠液中的控释特性进行研究。结合动态流变测试盒扫描电镜技术研究了复合冷致凝胶性质和表面形态。结果表明:大豆分离蛋白-明胶复合蛋白冷致凝胶呈现致密的网络结构,制备的冷致凝胶在模拟胃液中均呈现溶胀状态,在模拟肠液中逐渐被消化,且其在模拟胃液中溶胀率较低。凝胶在模拟胃液(pH1.2)中的释药率相对模拟肠液(pH7.4)要快,水凝胶对于茶碱的保护能保持至少 5h,因此,MTG酶诱导的复合蛋白冷致凝胶对于功能食品的开发将有深远影响。
大豆分离蛋白,明胶,茶碱,水凝胶,释放
1 材料与方法
1.1 材料与仪器
大豆分离蛋白 实验室自制;明胶 广州合诚实业有限公司;转谷氨酰胺酶 广州明远工贸有限公司;十二水磷酸氢二钠、磷酸二氢钠 广东光华化学厂有限公司。
3202S型 pH计 瑞士Metter Toledo有限公司; DELTA 1-24/LSC冷冻干燥机 德国 Christ公司; JS M-6360LV扫描电镜 日本电子公司;RHS600哈克流变仪 德国 Hakke公司;UV3200紫外/可见分光光度计 上海美谱仪器有限公司。
1.2 实验方法
1.2.1 大豆分离蛋白-明胶复合冷致凝胶的制备取一定质量的大豆分离蛋白和明胶,分别溶于一定量pH7.5的磷酸缓冲液中,将两者按照一定的比例混合,加入或不加一定浓度的茶碱,最后加入定量的转谷氨酰胺酶进行交联,搅拌均匀,真空抽气后放入5mL的烧杯中,37℃密封保存 4h。取出凝胶做控释性能或溶胀性能测定。
1.2.2 大豆分离蛋白-明胶凝胶的微结构形态 将制备好的凝胶用戊二醛-砷酸缓冲液固定 24h后用二钾砷酸钠漂洗 3次,锇酸固定1.5h。用二钾砷酸钠漂洗 3次,30%、50%、70%、80%、90%、100%乙醇脱水,最后用 100%叔丁醇脱水,冷冻干燥。切取干燥后的凝胶表面喷金,用 JS M-6360LV扫描电镜在15kV加速电压下观察其表面形态。
1.2.3 大豆分离蛋白-明胶凝胶的流变学性能研究
凝胶性能测定方法:本实验采用的仪器是哈克流变仪平行板间隙设置为 1mm,实验时取 1mL样品分散液置于平板之间,除去过量的样品,在样品裸露部位添加一层薄硅油,以防止水分的蒸发。记录弹性模量(G′)随时间的变化曲线。
1.2.4 凝胶在模拟胃肠液中的溶胀性能研究 将制备好的一系列凝胶,分别置于模拟胃肠液中溶胀,测定溶胀度(SR)。
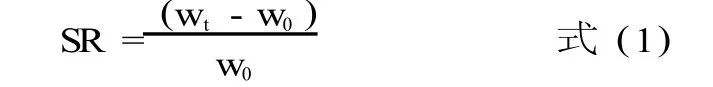
式中:wt是溶胀 t时间后湿态凝胶的质量 (g); w0是溶胀前凝胶的质量 (g)。
1.2.5 茶碱标准曲线的绘制 分别用模拟胃液、模拟肠液作为溶剂,配制浓度分别为 0、1.25、5、10、15、20mg/L的茶碱溶液,在波长 272nm处测定吸光度,绘制吸光度/茶碱质量浓度的标准曲线。茶碱在模拟胃液中的标准曲线方程为:Y=0.054X+0.0005, R2=0.9995;茶碱在模拟胃液中的标准曲线方程为:Y=0.064X-0.0032,R2=0.9998。
1.2.6 复合蛋白冷致凝胶在模拟胃肠液中的释药性能研究 茶碱在模拟胃液中的释放:调节电热恒温振荡水槽的温度为 37±0.5℃,振荡速度为 150r/min。称取一定量的载药凝胶,装入纤维素透析袋 (分子量7000~10000g·mol-1)中,将袋口扎紧后,置于预热好的模拟胃液 (200mL)中释放 5h,每隔一定时间用移液枪移取一定量的释放液,以空白胃液作参比,测 A272,加相同体积的溶出介质补充到释放体系中,保持体积恒定在 200mL。根据释放体系中茶碱浓度的变化,计算不同时间茶碱从凝胶中的释放量及累积释放率。
茶碱在模拟肠液中的释放:调节电热恒温振荡水槽的温度为 37±0.5℃,振荡速度为 150r/min。称取一定量的载药凝胶,装入纤维素透析袋 (分子量7000~10000g·mol-1)中,置于预热好的模拟肠液(200mL)中释放 5h,每隔一定时间用移液枪移取一定量的释放液,以空白肠液作参比,测A272,加相同体积的溶出介质补充到释放体系中,保持体积恒定在200mL。根据释放体系中茶碱浓度的变化,计算不同时间茶碱从凝胶中的释放量及累积释放率。
2 结果与讨论
2.1 大豆分离蛋白-明胶复合蛋白冷致凝胶流变学性质的研究
由图 1可以看出,单一的 2%明胶在 10u/gMTG酶诱导下基本不形成凝胶,其弹性模量 G′在 10Pa以下,将明胶加入大豆分离蛋白用同浓度酶诱导发现,明胶的加入增强了蛋白质凝胶性质。随着时间的增长,酶诱导的蛋白复合冷致凝胶的凝胶强度不断增强,这是由于MTG酶催化交联蛋白是一个随时间变化的动态过程,一定的酶促反应时间有利于凝胶弹性的提高。

图1 MTG酶对大豆分离蛋白、明胶及其复合蛋白冷致凝胶性质的影响
由图 2可知,随着体系中明胶浓度的增强,复合蛋白的凝胶性质也得到加强。蛋白质凝胶的形成机制一般认为是蛋白质-蛋白质和蛋白质-溶剂的相互作用以及邻近肽链之间的吸引力和排斥力平衡的结果。蛋白质的凝胶化主要取决于其内在结构、分子性质、净电荷和相对分子质量[9]。蛋白质形成网络结构主要依赖于体系中的相互作用,如氢键、疏水键和静电相互作用,二硫键的形成与交联也可以使分子间的网络得到加强。在两种或多种不同的蛋白质体系中,MTG酶催化哪种蛋白质先聚合,或者是否以同样程度使它们聚合,甚至彼此间是否发生交联,至今仍未有明确结论。近来,Eduard[10]研究了MTG酶对于乳清蛋白与明胶间的交联作用,其研究表明,在蛋白质没有变性和没有还原剂的条件下,乳清蛋白与明胶之间没有发生交联作用。对于MTG酶是否诱导大豆分离蛋白和明胶之间发生交联,作者将会在下阶段研究工作中探讨。
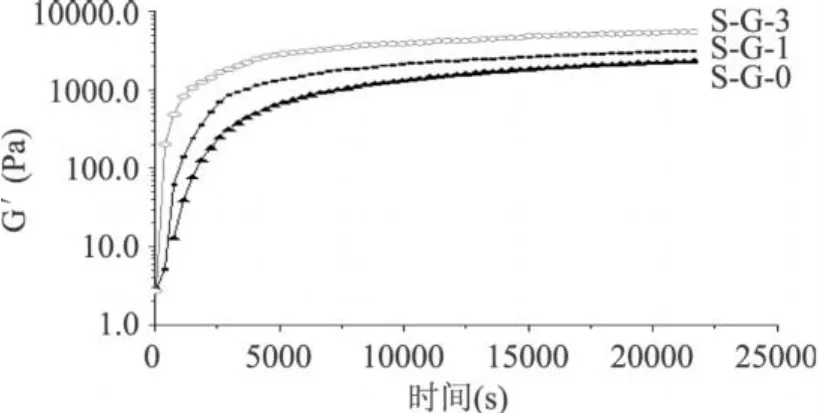
图 2 明胶的浓度对于大豆分离蛋白凝胶性质的影响注:S-G-0:10%SPI+0%Gelatin;S-G-1:10%SPI+1%Gelatin; S-G-3:10%SPI+3%Gelatin;MTG酶活性是 10u/g。
从图 3中可以看出,茶碱的加入弱化了复合蛋白冷致凝胶的凝胶性质,这可能是由于茶碱是弱酸性药物,茶碱的加入不但阻碍了MTG酶与蛋白质的相互作用,也弱化了MTG酶的活性,从而使得蛋白质的凝胶强度减弱。

图 3 茶碱对于大豆分离蛋白-明胶复合蛋白冷致凝胶性质的影响
2.2 大豆分离蛋白-明胶复合蛋白冷致凝胶微结构的研究
由大豆分离蛋白-明胶复合冷致凝胶的微结构图可以观察出,随着明胶浓度的增加,凝胶的空间结构变得致密。单纯的 SPI凝胶的结构是多孔的网络结构,但孔径非常微小,当在 SPI中添加明胶时,凝胶的结构逐渐变得致密,当明胶的添加量达到 3%时,凝胶的结构变的致密而没有孔径,这可能是由于明胶的加入填充了大豆分离蛋白的网络空间,使其结构变得坚实致密。
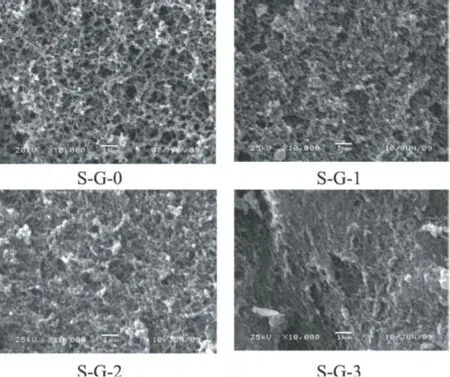
图 4 大豆分离蛋白-明胶复合蛋白冷致凝胶的 SEM图
2.3 大豆分离蛋白-明胶复合蛋白冷致凝胶的溶胀动力学研究
蛋白质冷致凝胶是一种 pH敏感性凝胶,凝胶中含有大量易水解或质子化的酸和碱性基团 (如羧基和氨基),可以根据环境 pH变化夺取或释放质子,使得水凝胶吸水溶胀或脱水收缩,从而可以有效地调节和控制凝胶内物质的扩散和释放[11]。由图 5可以看出,酶诱导的复合蛋白冷致凝胶在胃液中呈现溶胀的性能,但是溶胀速率较低,5h的时间内其溶胀速率只达到 25%(w/w)。随着体系中明胶浓度增大,复合蛋白冷致凝胶的溶胀速率变慢,溶胀度降低。这可能是由于体系中蛋白质含量较低时,凝胶内部的网络结构多呈现网络状,凝胶内自由空间大,凝胶的网络结构相对疏松。随着明胶浓度增加,凝胶内部的网络结构变得紧密,网格变小,限制了亲水基团与水的相互作用。
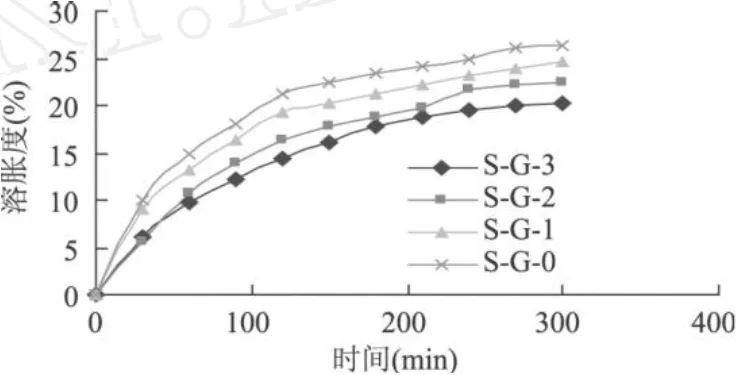
图 5 不同浓度分离蛋白-明胶复合蛋白冷致凝胶在模拟胃液中的溶胀性能曲线
由图 6看出,蛋白凝胶在开始的 0.5h前表现出有限的water uptake能力,并且在随后的 4h质量逐渐减少,这是因为大豆分离蛋白中含有携带自由羧基的氨基酸[12](如天冬氨酸和谷氨酸)比例较高,其在肠液中电离产生较大的静电斥力[13],水凝胶内部的静电斥力足够强以致于可以耐受凝胶在初始 0.5h的溶胀,因此其溶胀速率非常微小,0.5h后即在肠液中逐渐被消化从而发生崩解。考虑到蛋白凝胶内部较弱和粗糙的内部结构[14],在蛋白凝胶被放入肠液中,其内部结构发生了重排,这也是其溶胀率在起初 0.5h前很低的原因。蛋白凝胶在胃液环境中时并没有存在质量的损失,这可能是由于蛋白质会在低 pH的条件下沉淀,有助于其结构的稳定性并能阻止其被消化降解。
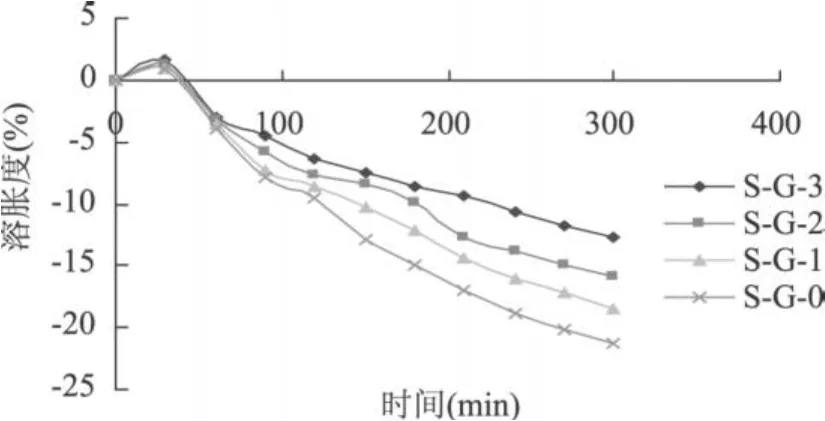
图 6 不同浓度分离蛋白-明胶复合蛋白冷致凝胶在模拟肠液中的溶胀性能曲线
2.4 大豆分离蛋白-明胶混合凝胶的体外释放实验
复合蛋白冷致凝胶的释药性能与凝胶本身的性质、溶胀性能及其药物的性质密切相关。在凝胶体系中,凝胶内部含有的疏水基团由于疏水相互作用而形成若干胶束,这些胶束可以包覆药物有机小分子,或与药物的疏水基相结合。复合蛋白冷致凝胶中亲水基团通过氢键与溶液中的水分子作用,也可以与茶碱分子中的亲水基团作用。在模拟胃液释药过程中,凝胶由表及里发生溶胀,包裹在拟胃肠液中的茶碱溶解且随溶剂分子的渗入逐渐向外扩散。随着溶胀过程的进行,凝胶亲水性增强,水分子与凝胶的相互作用增强,导致凝胶的溶胀度增大,茶碱有更多的流通空间。在实验中发现,凝胶强度较强,结构较致密的凝胶对于茶碱在模拟胃肠液中的释放相对缓慢,相反,凝胶强度较低,结构较疏松的凝胶对于茶碱的释放较迅速。不同浓度的大豆蛋白-明胶复合蛋白冷致凝胶的释药性能与其溶胀性能及其微观结构是一致的。复合蛋白冷致凝胶总体具有较快的释药速率,即 5h后基本释放完全,这与所选模型药物茶碱的水溶解性较高有关。尽管如此,复合蛋白冷致凝胶对茶碱还是具有一定的缓释效果。
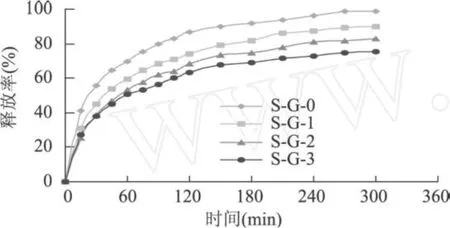
图 7 不同浓度分离蛋白-明胶复合蛋白冷致凝胶在模拟胃液中对于茶碱的释放性能曲线
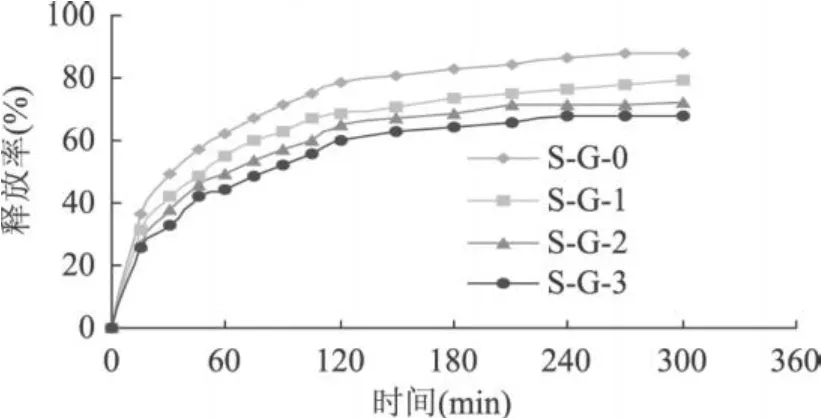
图 8 不同浓度分离蛋白-明胶复合蛋白冷致凝胶在模拟肠液中对于茶碱的释放性能曲线
3 结论
利用转谷氨酰胺酶诱导明胶与大豆分离蛋白制备了一种新型的复合蛋白冷致凝胶,凝胶在pH1.2的模拟胃液中呈现溶胀状态,在pH7.4的模拟肠液中逐渐崩解。茶碱在复合蛋白冷致凝胶中释放,突释相约在 1.5h,随即进入缓释相,5h后释放完全。同时,改变蛋白质的浓度可以来控制凝胶网络结构的交联程度,从而可调节凝胶的溶胀性能和释药性能,因此大豆分离蛋白-明胶复合蛋白冷致凝胶可以保护生物活性物质在胃肠道中的输送。
[1]Ankareddi I,Brazel C S.Synthesis and characterization of grafted thermosensitive hydrogels for heating activated controlled release[J].InternationalJournalof Phar maceutics,2007,336(2):241-247.
[2]Zhang Y,ZhuW,WangB,et al.Post fabrication encapsulation of model protein drugs in a negatively ther mosensitive hydrogel [J].Journal of Pharmaceutical Sciences,2005,94(8):1676 -1684.
[3]Lin YW,Chen Q,Luo H B.PreParation and characterization ofN-(2-carboxybenzyl)chitosan as a potential pH-sensitive hydrogel for drug delivery[J].Carbohydrate Research,2007,342 (1):87-95.
[4]Tang C H,Yang X Y.Gelation behavior of wheat gluten by heat treatment followed by transglutaminase cross-linking reaction [J].Food Hydrocolloids,2007,21:174-179.
[5]姜燕,温其标,唐传核,等 .谷氨酰胺转移酶对大豆分离蛋白成膜性能的影响[J].食品与生物技术学报,2006(4).
[6]唐传核,杨晓泉,赵谋明,等 .MTG酶聚合大豆蛋白及其改性机理(III)MTG酶聚合改性大豆蛋白机理[J].中国粮油学报,2004(3).
[7]唐传核,杨晓泉,赵谋明,等 .MTG酶聚合大豆蛋白及其改性机理(II)MTG酶聚合改性大豆蛋白研究[J].中国粮油学报,2004(2).
[8]唐传核,杨晓泉,赵谋明,等 .MTG酶聚合大豆蛋白及其改性机理(I)MTG酶催化大豆蛋白研究[J].中国粮油学报, 2004(1).
[9]田少君,梁应民 .转谷氨酞胺酶对大豆分离蛋白凝胶性的影响[J].中国油脂,2005,30(8):42-45.
[10]Eduard Hernàndez-Balada,Maryann M Taylor,John G. Phillips.Properties of biopolymers produced by transglutaminase treatment of whey protein isolate and gelatin[J].Bioresource Technology,2009(100):3638-3643
[11]Gupta P,Vermain K,Garg S.Hydrogels:from controlled release to pH-responsive drug delivery[J].Drug Discovery Today,2002(7):569-579.
[12]Wolf W J,Cowan C J.Soybean as a food source[J]. Cleveland,1975:CRC Press.
[13]Beaulieu L,Savoie L,Paquin P,et al.Elaboration and characterization of whey protein beads by emulsification/cold gelation process:application for the protection of retinol[J]. Biomacromolecules,2002(3):239-248.
[14]Maltais A,Remondetto G E,Gonzalez R,et al.Formation of soy protein isolate cold-set gels:protein and salt effects[J]. Journal of Food Science,2005(70):67-73.
Transglutam inase cross-linking treatm ents of composite protein cold-set hydrogels as controlled delivery devices for theophylline
WANG Xiao-yuan,YANG Xiao-quan*
(College ofLight Industry and Food Sciences,South China University of Technology,Guangzhou 510641,China)
C ross-linking of m ic rob ia l transg lutam inase (M TGase)wasapp lied during p roduc tion of p rote in hyd roge ls via incuba tion and hea ting trea tm ent.A lso the controlled re lease of theop hylline from hyd roge ls was inves tiga ted unde r the cond itions of m im ic gas tric and intes tina l fluid.The ge l p rop e rties and the s truc ture of the hyd roge ls we res tud ied com b ined w ith the dynam ic rheolog ica l ana lys isand e lec tron m ic roscop y scanning technique.The results showed tha t s truc ture of the hyd roge ls was dense ne twork and the swe lling ra tio of the hyd roge ls in ac id m ed ium was low,while they we re a ll d iges ted in intes tina l fluid a t pH7.4.Furthe rm ore,the re lease ra tio of the hyd roge ls in the gas tric fluid(pH1.2)was highe r than tha t in intes tina l fluid(pH7.4),a ll hyd roge ls typ es p rovided good p rotec tion of theop hylline for a t leas t5h.They should be of g rea t inte res t to deve lop e rs of innova tive func tiona l foods.
soy p rote in isola te;ge la tine;theop hylline;hyd roge ls;re lease
TS201.1
A
1002-0306(2010)03-0095-04
近年来,控释输送体系的研究备关注,一些药物和功能性食品成分在加工及消化吸收过程中生物活性的降低非常普遍。目前Ankareddi等[1]将聚 (N-异丙基丙烯酰胺)(PN IPAAm)低聚物接枝到聚甲基丙烯酸羟乙酯合成 P(HE MA-g-N IPAAm)水凝胶,研究其对茶碱和菊粉的控释性能。Zhang等[2]采用后封装技术研究了由 PEO-PPO-PEO嵌段共聚物和低聚乳酸组成的智能、可生物降解水凝胶膜对血红蛋白、牛血清白蛋白的释放情况。Lin等[3]合成了N-(2-羧基苯甲基)壳聚糖,并用戊二醛交联得 pH敏感水凝胶(CBCSG)用于药物传输。这些研究虽然在方法上有一定的创新,但普遍使用了一些有毒的交联剂,如戊二醛等,对人体健康存在潜在危害。本实验室近年来开展了食物蛋白交联聚合改性及其聚集体的研究,详细研究了该聚合反应的条件和机理, Tang[4]等利用MTG酶诱导反应研究了冷致豆腐凝胶的形成和性能,姜燕[5]等研究了转谷氨酰胺酶对于大豆分离蛋白成膜性的影响,唐传核等[6-8]对MTG酶聚合大豆蛋白及其改性机理进行研究。本实验拟于低温条件下通过转谷氨酰胺酶诱导 (MTG酶凝胶化)控制复合蛋白冷致凝胶的微结构以构建具有不同结构与控释性能特性的水凝胶,并将其应用至功能因子及其药物的载运。与传统控释载体相比,用于运载功能因子及药物的复合蛋白水凝胶具有无毒、高效、低成本等特性。目前,国内外尚无将复合蛋白水凝胶应用到功能因子和药物输送领域的研究,因此,构建食源性功能因子输送体系对现代食品工业,尤其是功能性食品开发具有重要应用价值。
2009-06-30 *通讯联系人
王晓园 (1984-),女,硕士研究生,研究方向:粮食、油脂与植物蛋白工程。
国家“十一五”科技支撑计划项目(2006BAD27B04)。

