Listeria monocytogenes在经高氧化还原电位酸性水处理的鲜食莴苣上预测模型的建立
丁 甜,董庆利,相启森,吴德涣
(1.上海理工大学食品科学与工程研究所,上海 200093; 2.国立江原大学食品科学与生物技术学科,韩国春川 200701; 3.西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
Listeria monocytogenes在经高氧化还原电位酸性水处理的鲜食莴苣上预测模型的建立
丁 甜1,2,董庆利1,相启森3,吴德涣2,*
(1.上海理工大学食品科学与工程研究所,上海 200093; 2.国立江原大学食品科学与生物技术学科,韩国春川 200701; 3.西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
采用高氧化还原电位酸性水(EOW)对接种过单核细胞增生李斯特菌的鲜食莴苣进行处理,研究残留菌在不同温度下的保存期限。建立 Gompertz,Logistic和Baranyi初级模型,描述单增李斯特菌在不同温度下的生长情况,对比结果表明,Gompertz模型的判定系数 R2=0.9913,能够更好地拟合李斯特菌在各个温度下的生长状况,并得到李斯特菌生长的 Gompertz模型生长参数(SGR,LT,MPD)。利用平方根模型对其的最大比生长速率的平方根-温度进行拟合,得到莴苣上单核细胞增生李斯特菌生长的二级模型: SGR=0.015T+0.069。使用判定系数 (R2)、均方误差(MSE)、偏差因子(BF)和准确因子(AF)对模型进行验证,结果表明,本研究得出的二级模型能够很好地预测单核细胞增生李斯特菌在相应环境下的生长状况。
单核细胞增生李斯特菌,高氧化还原电位酸性水,莴苣,预测模型,验证
1 材料与方法
1.1 实验材料
高氧化还原电位酸性水 由电解水生成装置A2-1000(220V,30A,Korean E&S Fist Inc,Seoul, Korea)电解 0.1%氯化钠溶液得到。当电流设置到12A时,电位酸性水和电位碱性水同时分别从阳极和阴极管中流出,当观察到有稳定的水流从管中持续流出时,15min后,从阳极管收集实验所需的高氧化还原电位酸性水 (氯浓度 50μg/mL;pH<2.7; ORP:1150~1180mV);莴苣 购于当地的超市(GS.Market,Chunchon,Korea),然后立即保存在 4℃的保鲜冰箱中;实验菌株 L.m onocytogenesScott A、L.m onocytogenesATCC 19116和L.m onocytogenesATCC 19118;中和剂 含 0.5%硫代硫酸钠的胰蛋白胨生理盐水溶液。
1.2 实验方法
1.2.1 菌液准备 分别取 10μL原种菌液接种到10mL TSBYE(TSB,Difco,Sparks,MD,U.S.A.)培养基中,置于 35℃的恒温培养箱里培养 24h,使菌体细胞浓度大约为 109cfu/mL。然后在 10min,5000×g, 4℃的离心条件下重复离心 2次,得到的菌体用浓度为 0.1%的蛋白胨缓冲溶液 (Buffered peptone water, Difco,USA)冲洗,得到浓度为 109cfu/mL的李斯特菌混合溶液。将上述菌体细胞悬液稀释到107cfu/mL,保存在 4℃的恒温箱中备用。
1.2.2 培养基制备 称取 57.5g牛津培养基 (Oxford medium base),溶于 1000mL纯净水中,连续缓慢加热至沸腾,使其充分混合均匀,1min后,在 121℃下灭菌 10min。当冷却至 45~50℃时,加入 10mL rehydrated oxford ant imicrobic supplement,混合均匀后,制备平板。
1.2.3 样品的制备 把莴苣外层脱色、萎蔫的部分去掉,只取新鲜的叶子并用消毒的手术刀切成 3cm× 3cm的小片,每次称取 10g置于无菌的均质袋 (Nasco Whirl-Pak,Janesville,W I)中,做好标记后保存在 4℃保鲜冰箱中备用(24h以内)。将浓度为 107cfu/mL的菌悬浮液接种到莴苣样品上,使样品的初始菌数大致为 105cfu/g。
1.2.4 实验操作 将接种后的莴苣样品在常温下用高氧化还原电位酸性水(EOW)浸泡 3min,转移到新的均质袋中,然后加入 90mL经高压灭菌的蛋白胨溶液,进行 2min的破碎处理,使莴苣叶破碎完全,形成悬浮溶液。对处理过的莴苣叶进行菌数测定,同时判定高氧化还原电位酸性水的杀菌能力。本实验选定 4、10、15、20、25、30、35℃不同的培养温度,根据不同的温度选定不同的测试时间段,每隔一定时间分别取出一定量样品进行菌数测定,取合适稀释度,用平板计数法得出活菌数。
1.2.5 初级模型的建立 利用 GraphPad Pris m (version 4,GraphPad Sof tware,Inc.,San Diego,CA, U.S.A.)和 DMFit(Version2.1.,InstituteofFood Research,Nor wich Research Park Nor wich NR4 7UA, United Kingdom.)统计软件进行初级模型的拟合,并利用实验得到的原始数据建立 Gompertz[16], Logistic[17]和 Barayi[18]三种初级模型。对三种模型得出的 R2进行比较,选取最能符合实验数据的模型,得出其不同温度下的生长曲线,得到相应的初级模型参数。
Gompertz模型:
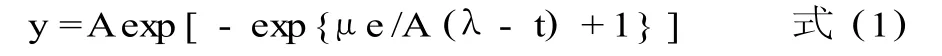
Logistic模型:
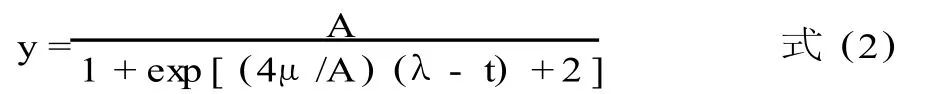
Baranyi模型:
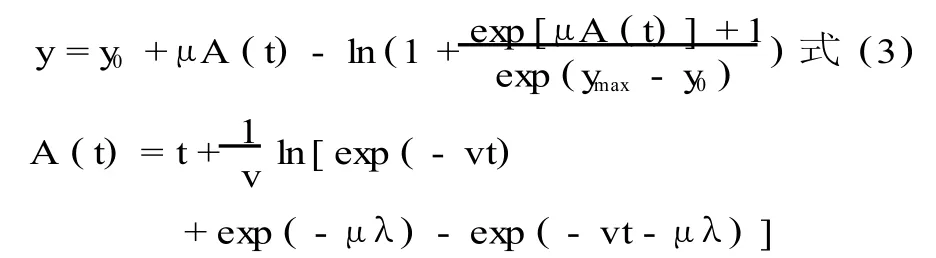
式中:y表示最终菌落数(log CFU/g);ymax表示生长过程中的最大菌落数 (log CFU/g);y0表示最初菌落数 (log CFU /g);μ表示最大比生长速率(log CFU/h);λ表示延滞期 (h);v是底物的增长速率;A,a,b是模型的参数。
1.2.6 二级模型的建立 二级模型的拟合使用 SPSS 16.0 package program(Statistical package for the social science,Chicago, IL,USA)统计软件,研究温度 (T)对最大比生长速率(SGR)的影响,得到平方根模型。
1.2.7 模型的验证 在模型的验证阶段,判定系数(R2)、均方误差 (Mean Square Error,MSE)、偏差因子 (Bias factor,BF)和准确因子 (Accuracy factor,AF)将被用来作为衡量模型的标准。BF是偏差因子,表示实测值是大于预测值 (bias factor>1)或者小于预测值(bias factor<1);AF是精确因子,表示预测值和实测值的偏离度。公式如下:
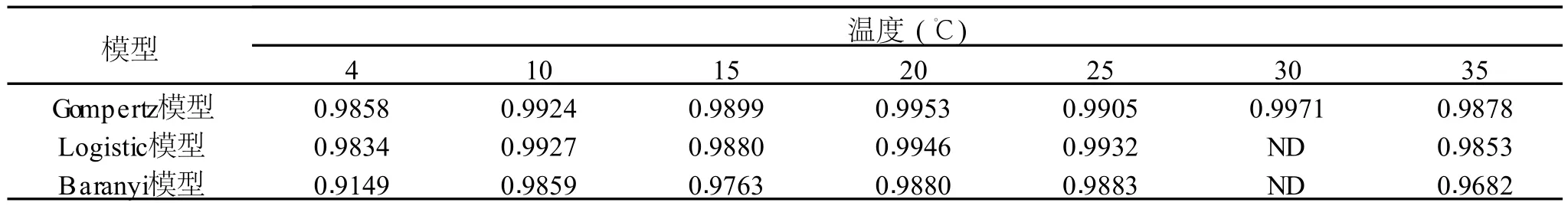
表 1 Gompertz,Logistic和Baranyi模型在不同温度下的判定系数值(R2)

表 2 由 Gompertz模型所得出的李斯特菌在不同温度下的生长参数

2 结果与讨论
2.1 初级模型的建立
接种后的莴苣叶李斯特菌浓度大约为 5.0 log cfu/g,经过 EOW处理后,其浓度大致为 2.9 log cfu/g,说明EOW对李斯特菌的灭活数为 2.1 log cfu/g,具有很强的杀菌能力。该结果与 Guentzel[18]在 2008年发表的研究成果相似,他们发现相同浓度的 EOW在相似条件下对李斯特菌的灭活数为 2.3 log cfu/g。
将建立的 Gompertz,Logistic和 Baranyi三种模型进行比较,如表 1所示。通过不同模型在各个温度下的判定系数 R2进行纵向比较,可以看出 Gompertz模型所得 R2值较另外两个模型更接近 1,并且Logistic模型和Baranyi模型在 30℃时并不能表达李斯特菌的生长曲线,所以选择 Gompertz模型为本研究的初级模型。
实验结果表明,不同温度下李斯特菌的生长曲线和 Gompertz模型的吻合情况良好,Gompertz模型的平均判定系数 R2高达 0.9913,使用 Pris m软件对原始数据进行统计分析,结果如图 1所示。在 4℃和10℃的培养条件下,李斯特菌生长非常缓慢,在培养的前 50h,李斯特菌数目基本维持在初始水平,几乎没有出现生长态势。随着温度的升高,李斯特菌的生长速度也加快,尤其是在 30℃和 35℃,只需要15h,李斯特菌就能生长到稳定的水平。初级模型的拟合得到的模型参数如表 2所示,我们也可以清楚地看到随着温度的升高,最大比生长速率 (SGR)和最大菌体密度(MPD)随之增加,相反,李斯特菌的生长延迟期(LT)缩短。
2.2 二级模型的建立
根据表 2中得到的不同温度下的最大比生长速率 (SGR),利用 SPSS统计软件进行线性回归分析,从而得到关于温度和 SGR平方根的二级模型 (如图2所示)。由图 2所示,图中的点分布在 linear周围很近的地方,说明温度和李斯特菌的最大比生长速率的平方根有很好的线性关系;R2=0.981,表明二级模型的预测准确度高达 98.1%,校正决定系数=0.977,说明仅有 2.3%的总变差不能解释当前的模型[19]。

图 1 Gompertz模型所描述的李斯特菌在不同温度下的生长曲线

图2 二级模型的拟合
平方根模型[20-21]是用来描述环境因子影响的主要模型,其描述温度影响的简单表达式为:

其中,k是生长速率 (The rate of growth),b是回归系数 (Regression constant),T是温度 (℃),T0是微生物生长理论最低温度。由上述实验数据得到李斯特菌在莴苣上生长模型的二级模型为:0.015T+0.069。
2.3 二级模型的验证
对模型的验证是一个非常重要的步骤,只有通过了验证,所建立的模型才会有价值。在本研究中, R2、MSE、BF和 AF用来作为衡量模型的工具,其中BF和 AF被认为是验证模型的非常有价值的工具[21-24]。用所得的二级模型计算出相应温度下的预测值,与实验值进行比较。如图 3所示,R2值达到0.9769,预测值与实验值相关性很高。
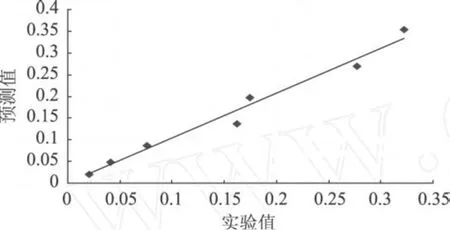
图 3 单增李斯特菌预测值和实验值的相关性分析
Adair[23]等报道,MSE的值越小,说明模型表达实验数据表达得越充分。如表 3所示,MSE的值为0.0003,说明预测值和实验观察值非常相似,均方误差很小,说明该模型能够很好地拟合实验数据。

表3 二级模型的MSE、AF和BF值
偏差因子(BF)是衡量模型的一个非常重要的参数,Ross[25]认为,对于微生物生长模型的验证,如果BF值在 0.9~1.05的范围之内,认为该模型能够很好地预测微生物生长速度和生长状况;如果 BF值在0.7~0.9或者 1.06~1.15范围之内,则该模型是可以被接受的;如果BF值大于 1.15或者小于 0.7,则说明该模型是失败的。由表 3可知,本实验所得 BF值为1.0398,在 0.9~1.05的范围之内,说明建立的模型能够很好的预测微生物生长速度和生长状况。当 AF =1的时候,说明模型有很高的精确性,数值越大或越小,说明该模型的准确性越低。如表 3所示,AF= 1.1068,意味着平均起来将有 10.68%的预测值与实验值不符,这是一个比较理想,可以接受的结果。Dalgaard和 Jørgensen[26]所建立的关于李斯特菌在各种各样的海产品中的生长模型,计算得出的AF值在1.4~4.0之间;Ross[25]所建立的葡萄球菌的生长模型,在验证当中得出了 1.53的 AF值;而 Neumeyer[27]关于假单胞菌的模型验证中的AF值为 1.3。相比较之下,由于平方根模型本身能够很好地描述环境因子对微生物生长的影响,准确因子的值为 1.1068,表明本实验所建立的模型具有相当高的准确性。
3 结论
3.1 利用高氧化还原电位酸性水 (EOW)处理接种单增李斯特菌的莴苣样品,得到 EOW对李斯特菌的灭活数为 2.1log cfu/g,说明高氧化还原电位酸性水(EOW)具有很强的杀菌能力。
3.2 建立了 Gompertz,Logistic和 Baranyi三种初级模型描述单增李斯特菌在不同温度下的生长情况。对比结果表明,Gompertz模型的判定系数 R2= 0.9913,能够更好地拟合李斯特菌在各个温度下的生长状况。得到得到李斯特菌在莴苣上存生长模型的二级模型为:对模型进行验证,结果表明,该二级模型能够很好地预测单核细胞增生李斯特菌在相应环境下的生长状况。预测食品微生物学的优点在于利用存在的数据去预测未来发展趋势,对实际生产和流通过程进行监控,具有重要的意义,也是未来的安全和质量控制的发展方向之一。综上所述,通过该研究所得出的关于李斯特菌的生长预测模型具有一定的价值,能够为将来生活和实验中李斯特菌的生长情况提供科学的预测。
[1]Scheu P,Gasch A,Berghof K.Rapid detection of Listeria monocytogenes by PCR-EL ISA[J].Lett ApplMicrobiol,1999, 29(6):416-420.
[2]Ding T,Dong QL,Rahman S ME,et al.Response surface modeling ofListeria monocytogenes inactivation on lettuce treated with electrolyzed oxidizing water[J].J Food Process Eng,2009, In Press.
[3]Vazquez Boland JA,Kuhn M,Berche P,et al.Listeria pathogenesis and molecular virulence determinants[J].Clin Microbiol Rev,2001,14(548):584-640.
[4]沈红,蒋兴祥,赵霞贇,等 .食品中单核细胞增生性李斯特氏菌检测及污染现状分析[J].中国人兽共患病学报,2007, 23(4):417.
[5]龚云伟,郭宏 .食品中单增李氏菌污染的调查[J].现代预防医学,2007,34(10):1092-1093.
[6]Mc Meekin T A,Olley J,Ross T,et al,Predictive microbiology:theory and application [M].Taunton,UK:Research Studies Press,1993.
[7]Ding T,Rahman S M E,Purev U,et al.Modelling of Escherichia coliO157:H7 growth at various storage temperatures on beef treated with electrolyzed oxidizing water[J].J Food Eng, 2010,97(4):497-503.
[8]Walls I,ScottVN.Use of predictive microbiology in microbial food safety risk assessment[J].International Journal of Food Microbiology,1997,36:97-102.
[9]Ding T,Jin YG,Rahman S ME,et al.Prediction of growth of Escherichia coli O157:H7 in lettuce treated with alkaline electrolyzed water at different temperatures[J].J Food Hyg Saf, 2009,24:232-237.
[10]孙薇,任清明,李东力 .酸性氧化电位水杀菌机理及应用研究进展[J].中国消毒学杂志,2004,21(4):371-373.
[11]张竞立,石笛,杨础华 .酸性氧化电位水对生鲜食品消毒的试验观察[J].中国卫生检验杂志,2008,18(3):524-525.
[12]李盛,徐庆华,谢慧娟,等 .高氧化还原电位酸性水杀灭微生物效果的试验观察[J].中国消毒学杂志,2000,17(1):9-11.
[13]易建云,陈柏铭,麦景璇,等 .高氧化还原电位酸性水杀灭微生物效果及其稳定性的试验观察[J].中国消毒学杂志, 1998,15(2):102-104.
[14]鄂志强,王旻,王洪,等 .酸性氧化电位水应用于乳品消毒工艺的探讨[J].中国乳品工业,2005,33(8):48-51.
[15]Gibson A M,Bratchell N,Roberts T A,et al.Predicting microbial growth:Growth responses of Salmonellae in a laboratory medium as affected by pH, sodium chloride, and storage temperature[J].Int J FoodMicrobiol,1988(6):155-178.
[16]Pal A,Labuza T P,Gonzalez F D,et al.Comparison of pr imary predictive models to study the growth ofListeria m onocytogenesat low temperatures in liquid cultures and selection of fastest growing ribotypes in meat and turkey product slurries [J].FoodMicrobiology,2008(25):460-470.
[17]Baranyi J,Roberts T A,et al.A dynamic approach to predicting bacterial growth in food[J].International Journal of FoodMicrobiology,1994(23):277-294.
[18]Guentzel J L,Lam K L,Callan M,et al.Reduction of bacteria on spinach,lettuce,and surfaces in food service areas using neutral electrolyzed oxidizingwater[J].FoodMicrobiology, 2008(25):36-41.
[19]Gao YL,Ju X R,Jiang H H,et al.Use of response surface methodology to investigate the effect of food constituents on Staphylococcus aureus inactivation by high pressure and mild heat [J].ProcessBiochemistry,2006(41):362-369.
[20]Ratkowsky DA,Olley J,McMeekinTA,Ball A. Relationship between temperature and growth rate of baterial cultures[J].J Bacteriol,1982,149:1-5.
[21]Ratkowsky DA,Lowry RK,McMeekin TA,Stokes AN Chandler RE.Model for bacterial culture growth rate throughout the entire biokinetic temperature range[J].J Bacteriol,1983, 154:1222-1226.
[22]Te-Giffel MC,Zwietering MH.Validation of predictive models describing the growth ofListeria monocytogenes[J].Int J FoodMicrobiol,1999,46:135-149.
[23]Adair C,Kilsby DC,Whittall PT.Comparison of the Schoolfield(non-linear Arrhenius)model and the square root model for predicting bacterial growth in foods[J].Food Microbial,1989,6:7-18.
[24]Ross T.Indices for performance evaluation of predictive models in food microbiology[J].J ApplBacteriol,1996,81:501 -508.
[25]Dalgaard P,Jorgensen LV.Predicted and observed growth of listeria m onocytogenesin seafood challenge tests and in naturally contaminated cold-s moked salmon[J].Int J Food Microbiol, 1998,40:105-115.
[26]Neumeyer K,Ross T,Thomson G,et al.Validation of a model describing the effects of temperature and water activity on the growth of psychrotrophic pseudomonads[J].Int J Food Microbiol,1997,38:55-63.
Study on predictive modelof the grow th of Listeria monocytogenes in ready-to-eat lettuce treated w ith electrolyzed oxidizing water
D ING Tian1,2,DONG Qing-li1,XI ANG Qi-sen3,W U De-huan2,*
(1.Institute of Food Science and Engineering,University of Shanghai for Science and Technology,Shanghai 200093,China; 2.Department of Food Science and Biotechnology,Kangwon NationalUniversity,Chuncheon,Gangwon 200701,Korea; 3.College of Food Science and Engineering,NorthwestA&F University,Yangling 712100,China)
The ob jec tive of this s tudy was to obse rve the ant im ic rob ia l effec t of e lec trolyzed oxid izing wa te r(EOW) aga ins tLis te ria m onocytogenes in ready-to-ea t le ttuce,and deve lop p red ic tive m ode ls of the g row th kine tic of L.m onocytogenes le ttuce trea ted w ith EOW.She lf life tes ts we re done a t seven d iffe rent s torage temp e ra tures,and p r im a ry m ode ls(Gomp e rtz,Log is tic and Ba ranyi)we re deve lop ed in orde r to find the bes t-fit m ode l to desc ribe the g row th kine tic of L.m onocytogenes.The comp a rison result ind ica ted tha t Gomp e rtz m ode l could fit the g row th kine tics of L.m onocytogenes bes t a t d iffe rent temp e ra tures w ith a high corre la tion coeffic ient va lue(R2=0.9913). The g row th p a ram e te rs(SGR,LT,M PD)we re ob ta ined us ing Gomp e rtz m ode l.Then SPSS was emp loyed to deve lop the seconda ry m ode l exp ress ing the re la tions be tween squa re root of SGR and temp e ra ture: SGR= 0.015T+0.069.Us ing the ind ices such as M ean Squa re Error(MSE),B ias fac tor(BF),Accuracy fac tor(AF)to va lida te the currentm ode l,the results dem ons tra ted tha t the m ode l deve lop ed was qua lified enough to p red ic t the g row th of L.m onocytogenes in p rac tice in the future.
L.m onocytogenes;e lec trolyzed oxid izing wa te r;le ttuce;p red ic tive m ode l;va lida tion
TS201.3
A
1002-0306(2010)03-0087-05
单核细胞增生李斯特菌 (单增李斯特菌,L isteria m onocytogenes,Lm)是一种分布广泛的食源性病原菌,人感染后能引发脑膜炎、发热性败血性胃肠炎等临床症状,感染后发病死亡率约为 25%[1-2]。单增李斯特菌广泛存在于自然界土壤、水、植物和反刍动物、人的粪便中,主要是通过污染乳制品、畜禽产品、生熟肉、蔬菜引起人类致病,由于该菌在 4℃的环境中仍可生长繁殖[3],所以它是冷藏食品威胁人类健康的主要病原菌之一。近几年来,因食品污染单增李斯特菌而引起的食物中毒暴发事件日见增多,已引起国际社会的广泛关注[4-5]。因此,2000年 WHO食品安全工作计划将单增李斯特菌列为必检的食源性致病菌之一。预测食品微生物学 (Predictive Food Microbiology)是运用微生物学、数学、统计学和应用计算机学建立起来的新兴学科[6-7]。它的主要研究内容是利用数学模型定量描述和预测微生物在特定食品特性 (pH、水分活度等)和加工流通环境因子(温度、包装气体等)条件下生长和存活的模型[7]。预测食品微生物学在食品安全的预测和管理中有很大的应用价值,可以用来预测食品的货架寿命和微生物学安全,同时是管理食品安全的重要工具,它为微生物风险评估 (Quantitative M icrobial Risk Assess ment,QMRA)和 HACCP(HazardAnalysis Critical Control Point)提供了科学依据[9-10]。高氧化还原电位酸性水 (Electrolyzed Oxidizing Water, EOW),是用强电解水生成装置电解食盐水而成的具有高电位强氧化性和 pH在 2.0~3.5的酸性水[11]。高氧化还原电位酸性水具有无毒、不污染环境、杀菌效果好等特点,在医疗卫生、农作物、家畜和食品等诸多领域具有很好的应用前景[12-15]。本文研究高氧化还原电位酸性水(EOW)处理对莴苣样品中单增李斯特菌的杀菌效果,并建立了单核细胞增生李斯特菌在莴苣上的生长预测模型,经验证,所得模型能够很好地表达单核细胞增生李斯特菌的生长状况,具有一定的应用价值,并能对将来生活和实验中李斯特菌的生长做出可靠的科学预测。
2009-04-08 *通讯联系人
丁甜(1985-),男,博士研究生,研究方向:食品微生物风险评估。
国家自然科学基金 (30800864)。

