体外膜肺氧合支持治疗中的凝血与抗凝
崔勇丽(综述),刘晋萍,龙 村(审校)
体外膜肺氧合(extracorporealmembrane oxygenation,ECMO)支持治疗技术的不断发展挽救了大量经常规治疗无效的心肺功能衰竭患者的生命。随着生物工程技术以及医疗水平的提高,ECMO的并发症显著降低,生存率明显提高,但在 ECMO治疗期间,出血或栓塞等凝血系统相关性并发症仍然是影响着致病率及死亡率的主要因素之一[1-3]。因此,本文就 ECMO支持过程中凝血系统的变化及抗凝治疗的进展综述如下。
1 ECMO支持过程中凝血系统的特点
1.1 生物材料与凝血系统活化 ECMO从静脉系统引流血液进入人工膜肺氧合、排除二氧化碳,并将保温后的氧合血回输至患者体内。在 ECMO辅助期间,整个血液系统与管路的异物表面持续接触。在生理条件下血液与完整的内皮接触,完整的血管内皮可分泌产生许多抗凝及促凝成份,而两种成份之间的平衡维持着血管的完整性及血液的流动性[4]。ECMO使用的管路是人工生物材料表面,无法同内皮细胞一样具有分泌功能,因此,整个凝血系统向促凝方向倾斜。
当肝素化的血液与人工材料接触的瞬间,血浆中的蛋白就会吸附到生物材料表面[5-7]。吸附蛋白的种类及分布情况与蛋白在血浆中的浓度以及生物材料的内源表面活性相关。该内源表面活性又与生物材料的物理特性及化学特性相关。也就是说,某种生物材料对某种血浆蛋白有特异性。虽然如此,但被吸附的血浆蛋白在同一种生物材料表面的分布情况是不一致的,且吸附的蛋白浓度随时间而改变,因此我们很难对某种生物材料凝血激活能力进行预测或评估。
通常,大部分生物材料会选择性吸附纤维蛋白原[7],纤维蛋白原将牢固且不可逆的附着于生物材料表面,随即发生构象改变,这种构象改变会暴露出特定的氨基酸集团与血小板 GPⅡb/Ⅲa受体结合,粘连的血小板被活化、脱颗粒。另外,被吸附的因子Ⅻ会活化内源性凝血途径。虽然内源性凝血通路在生理性情况下几乎不产生凝血酶,但在类似于 ECMO这种非内皮环境里,内源性凝血途径确实是产生凝血酶的途径之一。
1.2 外源性凝血途径与凝血系统活化 大部分ECMO患者在行机械支持前曾接受过手术治疗,因此,外源性凝血途径除了在生理情况下是凝血酶产生的主要途径,在 ECMO过程中仍然是凝血酶产生的关键。当血管内皮受到损伤,成纤维细胞、平滑肌细胞以及血浆中的单核细胞等多种细胞受到刺激后释放组织因子,组织因子与血液中的因子Ⅶ结合形成复合物,一方面直接激活因子Ⅹ和因子Ⅸ,另一方面使因子Ⅶ活化,令凝血过程加速,放大凝血瀑布。
1.3 炎性反应与凝血系统活化 血液与非生物表面接触时会激活一系列的细胞成分及蛋白成分,这些成分中的很大部分都是炎性反应中的重要组分[8]。其中的细胞成分包括:中性粒细胞,单核细胞,淋巴细胞,内皮细胞,血小板等;蛋白成分包括:细胞因子,补体系统,凝血因子,纤溶系统蛋白等。而全身炎症反应将通过组织因子途径、接触途径、体内抗凝途径,以及纤溶途径进一步影响凝血系统。也就是说,炎症反应与凝血系统相互激活、相互促进,使整个凝血-抗凝平衡愈来愈倾向于促凝优势。
1.3.1 中性粒细胞 肝素化的血液、管路表面蛋白层、受损的内皮细胞均可激活中性粒细胞,中性粒细胞可通过整合素巨噬细胞分化抗原-1(Mac-1)与纤维蛋白原、纤维蛋白、因子Ⅹ以及血小板相连接,并且中性粒细胞可分泌弹性蛋白酶。因此,中性粒细胞的活化一方面可以促进凝血酶的产生,另一方面可以降解抗凝血酶。
1.3.2 单核细胞 活化的中性粒细胞释放促炎细胞因子,该类细胞因子激活单核细胞。单核细胞与血浆中的组织因子联合加速因子Ⅶ向活化结构转变,这种作用是单核细胞所特有的,中性粒细胞及淋巴细胞都没有这样的作用。并且单核细胞可分泌组织因子,但峰值通常出现在细胞活化后的 3~4 h,因此,其对凝血所产生的影响主要作用于长时间的体外循环及体外生命支持过程中[9-11]。
1.3.3 细胞因子 ECMO过程中,主要的几种炎性细胞因子分别为:白介素(IL)-1β,IL-6,IL-8,肿瘤坏死因子-α(TNF-α)和单核细胞趋化蛋白-1(MCP-1)。这些炎症反应中的细胞因子对凝血的影响有:增加组织因子、增加纤溶酶原活化因子抑制剂 1(PAI-1)水平和抑制 C、S蛋白抗凝系统的作用。IL-1β,IL-6和 TNF-α可促进血管内皮细胞产生组织因子,激活主要凝血途径。并且,Schroeder S等人的研究中显示,TNF及 IL-1可从基因水平上降解内皮细胞表面凝血酶调节蛋白(TM)的表达[12],而 TM是加速蛋白 C活化的重要辅助因子,在凝血酶-TM复合物的作用下,蛋白 C的活性可增加 20倍[13],没有 TM的作用,蛋白 C系统抗凝的活性将大大降低。另外,这些炎性因子可阻止内皮细胞合成组织型纤溶酶原激活物(r-PA),增加凝血酶激活纤溶抑制物(TAFI)和 PAI-1的活性及数量[14]。由此可见,整个促凝系统被激活,而抗凝系统受到抑制,促凝作用是主导。
1.3.4 补体 当肝素化的血液进入人工材料管路时,凝血系统被活化,因子Ⅹa、Ⅺa和纤溶酶剪切 C5和 C3,产生 C5a和 C3a。凝血酶不仅仅剪切 C5,还可以产生 C3a[15]。因此,凝血系统被激活时,补体系统也被活化。有研究认为 C5a可以增加组织因子的活性,活化外源性凝血途径,另有研究发现,C5a有增加PAI-1活性、减少纤溶的作用[16]。
2 ECMO支持过程中抗凝
根据上文所述,在 ECMO辅助期间,凝血系统的精妙平衡被打破,整个平衡向促凝方向倾斜。因此,为了减少促凝活性、预防血栓及消耗性出血,必须给予外源性抗凝治疗。并且积极地从根本上寻求解决方式。
2.1 管路系统改良 由于凝血系统最主要的激活原因是血液与异物表面的接触,因此,改良管路系统着眼点便是改善材料的生物相容性。这些技术包括各种涂层技术及表面修饰添加物的使用。近年来,各种各样的管道材料改良方法层出不穷,见表1[17]。虽然有众多研究认为,这项技术可以降低凝血激活及炎症反应,减少肝素用量;但也有很大一部分学者却认为使用涂层管路而降低肝素用量会增加血栓的风险。近期关于体外循环中应用涂层管道的一项荟萃分析显示,仅仅这一项改变所带来临床益处非常有限[18],通过修饰和生物材料表面涂层来抑制血栓形成及炎症反应的措施目前是无效的。但是,关于 ECMO辅助期间使用涂层管路能否减少肝素用量并改善预后,目前尚无相关报道。
目前另一项技术是将可以释放 NO的高分子材料整合到管路表面,使管路表面更加接近内皮细胞。这项技术在动物模型上不仅可以减少血小板消耗,还可以减少系统肝素用量[19-20]。但具体效果如何尚无临床评价。
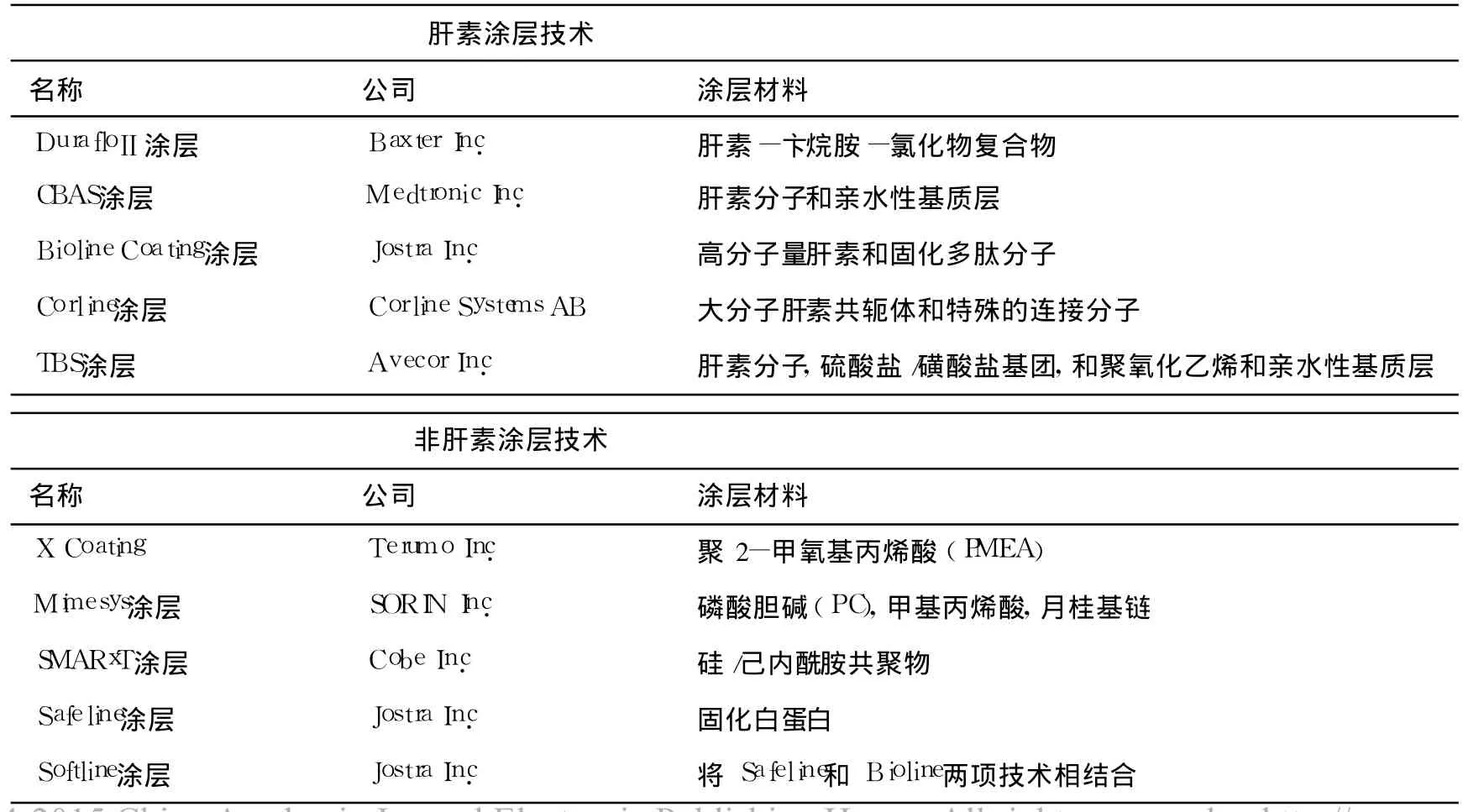
表1 管路涂层技术
2.2 肝素抗凝 理想的抗凝药物应该可以抑制凝血酶活性及血小板活化,而凝血系统的活性又应足以防止出血事件的发生。但是这种药物所需达到的精准程度在目前医学技术上尚无法实现。因此,应用肝素仍然是现有 ECMO抗凝措施中最广为接受的“金标准”。肝素通过与抗凝血酶-Ⅲ(AT-Ⅲ)结合发挥抗凝作用,低剂量时抑制Ⅹ因子,从而抑制凝血酶原向凝血酶转变;高剂量时可抑制Ⅸ、Ⅹ、Ⅺ、Ⅻ因子和凝血酶,阻止纤维蛋白原向纤维蛋白转化;它还抑制 XIII因子,防止纤维蛋白形成稳定的纤维蛋白凝块。
肝素的抗凝效果通常是用 ACT来监测的,维持ACT在 180~250 s之间,当患者出血风险较大时适当降低标准,而具有血栓倾向时相应提高抗凝标准。但是这些都是经验性的做法。通过临床观察及试验发现,ACT值与血浆肝素水平以及抗因子Ⅹa活性之间的相关性并不令人满意[21-22]。这主要是由于肝素发挥作用的机制和 ACT监测原理所造成的。当 AT-Ⅲ、Ⅻ因子活性降低,血小板及纤维蛋白原浓度下降到一定程度时,ACT值就不能维持与肝素浓度的线性相关了,而这种情况在小儿又尤为多见[23]。近期有一项关于 ECMO的活检序列性研究显示,随着 ECMO辅助时间的延长,血栓栓塞事件的发生几乎呈线性增加,并且发生率高达 50%[24]。Baird CW等人的另一项研究也进一步验证,婴幼儿ECMO管理过程中 ACT维持在180~220 s可能会导致抗凝不足,增加肝素剂量可改善生存率,但与 ACT不相关[25]。
这说明对于长时间抗凝的 ECMO患者来说,ACT不能敏感地反应抗凝是否充足,因此可以考虑增加其他监测方法,比如说测量因子Ⅹa活性、肝素浓度、凝血酶水平等。当发现由于 AT-Ⅲ水平下降影响肝素抗凝效果时,可考虑给予补充血浆来纠正。
2.3 非肝素抗凝 肝素可引起肝素诱导性血小板减少,虽然发生率非常低,一旦发生常常致命。并且由于肝素抗凝本身存在的缺陷,新的抗凝策略则应运而生。这种新的抗凝策略主要是以直接凝血酶抑制剂来达到更直接的抗凝效果,与肝素相比,能够更好的抑制凝血酶的产生,但对其他凝血因子的作用较小[26]。这种不依赖 AT-Ⅲ发挥作用的抗凝药物适用于婴幼儿以及肝素诱导性血小板减少症的患者。根据半衰期以及监测的难易程度等,在众多直接凝血酶抑制剂中,目前临床 ECMO抗凝管理中较为常用且较为安全的为阿加曲班、来匹卢定和比伐卢定[27-29]。这三种药物的代谢途径、半衰期等各有所不同,见表2。因此,需要根据具体患者情况给予选择,如表中所示,由于阿加曲班是由肝脏代谢,因此可以用于肾功能不全的患者,而其他两种药会在这类患者体内蓄积。

表2 用于ECMO抗凝的直接凝血酶抑制剂
总之,在 ECMO辅助过程中,凝血激活的情况复杂多样并与其他各系统之间交叉反应、互相影响,在此过程中,仍有众多机制不明,并且一些治疗进展的效果也不十分确定,因此,进一步深入了解 ECMO过程中凝血激活的基础,改善抗凝管理的措施将对患者的血液保护及预后的改善起到至关重要的作用。
[1]Dalton HJ.Outcome following pediatric ECMO[A].In:Zwischenberger JB,Steinhorn RH,Bartlett RH,editors.ECMO:extracorporeal cardiopulmonary support in critical care[M].2nd ed.Ann Arbor,Mich'ELSO,2000.481-493.
[2]Watson JW,Brown DN,Lally KP,et al.Complications of extracorporealmembrane oxygenation in neonates[J].South Med J,1990,83(11):1262-1265.
[3]Havdart GE,Fackler CJ.Predictors of intracranial hemorrhage during neonatal extracorporealmembrane oxygenation[J].JPediatr,1999 134(2):156-159.
[4]Colman RW,Clowes AW.George JN.Overview of thrombosis[A].In:Colman RW,Marder VJ,Clowes AW,et a l.eds.Hemostasis and thrombosis[M].5th ed.Philadelphia:LippinincottWilliams&Wilkins,2006.3-16
[5]Uniyal S,Brash JL.Patterns ofadsorption ofproteins from human plasma onto foreign surfaces[J].Thromb Haemost,1982,47(3):285-290.
[6]Ziats NP,Pankowsky DA,Tierney BP,et al.Adsorption of Hageman factor(factor XII)and other plasma proteins to biomedical polymers[J].J Lab Clin Med,1990,116(5):687-696.
[7]Horbett TA.Principles underlying the role of adsorbed plasma proteins in blood interactionswith foreign materials[J].Cardiovasc Pathol,1993,2(3S):137S-148S.
[8]Bowen FW,Edmunds Jr HL.Coagulation,anticoagulation and the interaction of blood and artificial surfaces[A].In:Zwischenberger JB,Steinhorn RH,Bartlett RH,editors.ECMO:extracorporeal cardiopulmonary support in critical care[M].2nd ed.Ann Arbor,Mich'ELSO,2000.67-96.
[9]Aird WC.Vascular bed-specific hemostasis:role of endothelium in sepsis pathogenesis[J].Crit Care Med,2001,29(7 Suppl):S28-34.
[10]Levi M,ten Cate H,van der Poll T.Endothelium:interface between coagulation and inflammation[J].Crit Care Med,2002,30(5 Suppl):S220-224.
[11]LeviM,Keller TT,van Gorp E,et al.Infection and inflammation and the coagulation system[J].Cardiovasc,Res,2003,60(1):26-39.
[12]Schroeder S,Borger N,W rigge H,et al.A tumor necrosis factor gene polymorphism influences the inflammatory response after cardiac operation[J].Ann Thorac Surg,2003,75(2):534-537.
[13]Slungard A,Fernandez JA,Griffin JH,et al.Platelet factor 4 enhances generation of activated protein C in vitro and in vivo[J].Blood,2003,102(1):146-151.
[14]Mackman N.The roleof the tissue factor-thrombin pathway in cardiac ischem ia-reperfusion injury[J].Semin Vasc Med,2003,3(2):193-198.
[15]Huber-Lang M,Sarma JV,Zetoune FS,et al.Generation of C 5a in the absence of C3:anew complement activation pathway[J].Nat Med,2006,12(6):682-687.
[16]Wojta J,Huber K,Valent P.New aspects in thrombotic research:complement induced switch in mast cells from a profibrinolytic to a prothrombotic phenotype[J].Pathophysiol Haemost Thromb,2004,33(5):438-441.
[17]柏淑颖,朱德明,王 伟.涂层技术在体外循环装置中的应用及意义[J].中国体外循环杂志,2009,7(2):124-128.
[18]RanucciM,BalduiniA,Ditta A,et al.A systematic review of biocompatible cardiopulmonary bypass circuits and c linical outcome[J].Ann Thorac Surg,2009,87(4):1311-1319.
[19]Jacobson J.Nitric oxide:platelet protectant properties during cardiopulmonary bypass/ECMO[J].J Extra Corpor Technol,2002,34(2):144-147.
[20]Annich GM,Meinhardt JP,Mowery KA,et al.Reduced platelet activation and thrombosis in extracorporeal circuits coated with nitric oxide release polymers[J].Crit Care Med,2000,28(4):915-920.
[21]DeWaele JJ,Van Cauwenberghe S,Hoste E,et al.The use of activated clotting time formonitoring heparin therapy in critically ill patients[J].Intensive Care Med,2003,29(2):325-328.
[22]Raymond PD,Ray MJ,Callen SN,et al.Heparin monitoring during cardiac surgery:Part 2.Calculating the overestimation of heparin by the activated clotting time[J].Perfusion,2003,18(5):277-281.
[23]Owings JT,Pollock ME,Gosselin RC,et al.Anticoagulation of children undergoing cardiopulmonary bypass is overestimated by current monitoring techniques[J].Arch Surg,2000,135(9):1042-1047.
[24]Rastan AJ,Lachmann N,Walther T,et al.Autopsy findings in patients on postcardiotomy extracorporealmembrane oxygenation(ECMO)[J].Int JArtif Organs,2006,29(12):1121-1131.
[25]Baird CW,Zurakowski D,Robinson B,et al.Anticoagulation and pediatric extracorporeal membrane oxygenation:impact of activated clotting time and heparin dose on survival[J].Ann Thorac Surg,2007,83(3):912-919.
[26]Young G,Yonekawa KE,Nakagawa P,et a l.Argatroban as an alternative to heparin in extracorporealmembrane oxygenation circuits[J].Perfusion,2004,19(5):283-288.
[27]Mejak B,Giacomuzzi C,Heller E,et al.A rgatroban usage for anticoagulation for ECMO on a post-cardiac patientwith heparin-induced thrombocytopenia[J].JExtra Corpor Technol,2004,36(2):178-181.
[28]Dager WE,Gosselin RC,Yoshikawa R,et al.Lepirudin in heparin-induced thrombocytopenia and extracorporeal membranousoxygenation[J].Ann Pharmacother,2004,38(4):598-601.
[29]Gosselin RC,King JH,Janatpour DA,et al.Comparing direct thrombin inhibitors using aPTT,ecarin c lotting times,and thrombin inhibitormanagement testing[J].Ann Pharmacother,2004,38(9):1383-1388.

