高碘酸钠-氧化低分子肝素-抗凝血酶复合物涂层聚氯乙烯管道的生物相容性研究
罗 鹏,杨 剑,杨 春,周 华,曹瑞军,刘维永
体外循环术后全身炎症反应是影响患者术后恢复的重要因素之一,这主要与体外循环系统人工材料的生物相容性欠佳有关。以往的研究表明,用肝素涂层技术对体外循环管道进行表面改性,可以有效改善其生物相容性,减轻术后全身炎症反应[1]。但肝素涂层同时也存在对血浆蛋白吸附不具选择性、抗凝效果不确切等问题。1997年,Chan等[2]利用蛋白非酶糖基化反应合成出了一种新型抗凝血酶-肝素共价复合物(antithrombin-heparin covalent complex,ATH),其具有强大的抑制凝血酶活性和血液相容性优异等特性[3]。本研究小组借鉴 ATH的合成方法,前期合成出了高碘酸钠(NaIO4)-氧化低分子量肝素-抗凝血酶共价复合物(sodium periodate-dxidated low molecular weight heparin-antithrombin covalent complex,SPLMWATH),并研究发现 SPLMWATH涂层体外循环医用聚氯乙烯(polyvinyl chloride,PVC)管道的涂层稳定性和抗凝血性能明显优于肝素涂层和低分子肝素涂层 PVC管道。本文采用 Chandlar loop模型进行体外循环,并检测有关指标,进一步评价了 SPLMWATH涂层 PVC管道的生物相容性。
1 材料和方法
1.1 主要材料、试剂与仪器 医用 PVC管道(西安路嘉生物医学有限公司),人血浆抗凝血酶 III(human plasma antithrombin III,AT,Biodesign公司 ,美国),低分子量肝素钠注射液(low molecular weight heparin sodium injection,LMWH,0.4ml:5 000 IU,齐鲁制药有限公司),40%聚乙烯亚胺溶液(polyethyleneimine,PEI,平均相对分子量 20 000 Da,武汉强龙化工有限责任公司),50%戊二醛溶液(glutaraldehyde,G,分析纯,天津市科密欧化学试剂开发中心),NaIO4(分析纯,上海顺强生物科技有限公司),氰基硼氢化钠(NaBH3CN,优级纯,Sigma-Aldrich公司,美国),人单核细胞趋化蛋白-1(MCP-1)ELISA检测试剂盒(北京晶美生物工程有限公司),人白介素(IL)-8 ELISA检测试剂盒(深圳炬英生物科技有限公司),DEAE-Sepharose Fast Flow凝胶(GE公司,美国)。新鲜全血,来源于西京医院临床志愿者。S-520型扫描电子显微镜(HITACHI公司,日本),BIO-RAD 550型酶联免疫检测仪(BIOMED公司,美国),Sysmex K-4500全自动血液分析仪(Sysmex公司,日本),Am icon Ultra-4 Centrifugal Filter Devices(3K、10K,Millipore公司,美国),AKTA purifier 100蛋白快速纯化系统(GE公司,美国)。
1.2 聚乙烯亚胺-戊二醛(PEI-G)结合 PVC管道的制备 分别称取质量分数为 40%的 PEI和质量分数为 50%的 G 5 g和 10 g,用去离子水稀释至5%,然后将 PEI逐滴加入到 G中,滤纸过滤,获得棕黄色的重量百分率(wt)5%的 PEI-G溶液。将直径 3mm,长 50 cm的医用 PVC管道一端封闭,另一端注入 PEI-G溶液,37℃中水浴 30 min后倒出剩余溶液,反复 3次,真空常温下干燥备用[4]。
1.3 SPLMWATH涂层 PVC管道的制备
1.3.1 SPLMWATH的合成 将 10mg NaIO4溶于5ml低分子肝素钠溶液,室温避光反应30 min,然后用 Amicon Ultra-4Centrifugal Filter Devices(离心过滤装置)(3K)在室温下 4 000 r/min离心 20 min,丢弃超滤液,向保留液中补充去离子水,重复离心 2次,得到氧化低分子肝素钠溶液。将 1mg抗凝血酶(AT)溶于氧化低分子肝素钠溶液,然后将其配制成20ml 0.02 mol/L、pH 7.3的磷酸盐缓冲生理盐水(Phosphate Buffered Saline,PBS),40℃反应 14 d,再加入 2 ml 0.5 mol/L NaBH3CN溶液,37℃继续反应 5 h[2,5]。
1.3.2 SPLMWATH的分离与纯化 将上述反应后的溶液用 Amicon Ultra-4 Centrifugal Filter Devices(10 K)在室温下 4 000 r/min离心 20 min,丢弃超滤液,收集保留液。将保留液用 0.01mol/L pH 8.0的Tris-HCl缓冲液透析,然后上预先用 0.01 mol/L pH 8.0的 Tris-HCl缓冲液平衡好的 DEAE-Sepharose Fast Flow阴离子交换层析柱,流速 0.5 ml/min,再用含 0.2 mol/L和 2 mol/L NaCl的 0.01 mol/L pH 8.0的 Tris-HCl缓冲液分步洗脱,流速0.5ml/min,收集第二个蛋白质峰,最后将收集的洗脱液用 0.02 mol/L pH 7.3的 PBS透析,即获得纯化的 SPLMWATH溶液,4℃中保存备用[2]。
1.3.3 SPLMWATH涂覆 PEI-G结合 PVC管道将 SPLMWATH溶液注入 PEI-G结合 PVC管道,37℃中水浴 30 min后倒出剩余溶液,真空常温下干燥备用[4]。
1.4 肝素涂层 PVC管道的制备 配制 500 U/Ml的肝素钠水溶液 100m l,硫酸滴定 pH=1;再将其注入 PEI-G结合 PVC管道,37℃中水浴 30 min后倒出剩余溶液,真空常温下干燥备用[4]。
1.5 低分子肝素涂层 PVC管道的制备 配制 500 IU/ml的低分子肝素钠水溶液 100 Ml,硫酸滴定 pH=1;再将其注入 PEI-G结合 PVC管道,37℃中水浴 30 min后倒出剩余溶液,真空常温下干燥备用[4]。
1.6 Chand lar loop模型体外评价各组管道的生物相容性
1.6.1 Chandlar loop模型的建立 将 PVC管道分为无涂层组(A组),肝素涂层组(B组),低分子肝素涂层组(C组),SPLMWATH涂层组(D组)。向各组管道内分别注入 3 ml同一来源肝素抗凝新鲜全血,然后用连接头使首尾相连而形成 Chandlar loop,放入 37℃恒温振荡培养箱中水平旋转 4 h,转速为100 r/min,再将血液收集备用[6]。
1.6.2 血小板计数的测定 取 0.75 ml收集的血液,用全自动血液分析仪测定血小板计数。
1.6.3 纤维蛋白原含量、IL-8和 MCP-1浓度的测定 将 2ml收集的血液在 4℃下 12 000 r/Min离心 10 min,取血浆分别用全自动血液分析仪和ELISA试剂盒测定纤维蛋白原含量和 IL-8、MCP-1的浓度。
1.6.4 扫描电镜观察 用去离子水反复清洗 PVC管道,常温下自然晾干,切取管道内表面制作电镜标本。
1.7 统计学处理 应用 SPSS 13.0.统计软件进行统计分析,所有数据以均数±标准差(±s)表示。采用 t检验进行统计学分析,P<0.05为有显著差异。
2 结 果
2.1 IL-8和 MCP-1的浓度测定 体外模拟转流 4 h后,各组血浆 IL-8和 MCP-1的浓度均较基线值有所升高,其中 D组升高程度最小,与 B组和C组两组间有显著性差异(P<0.05),而 B组和 C组之间无显著性差异(P>0.05)。见图1和图2。
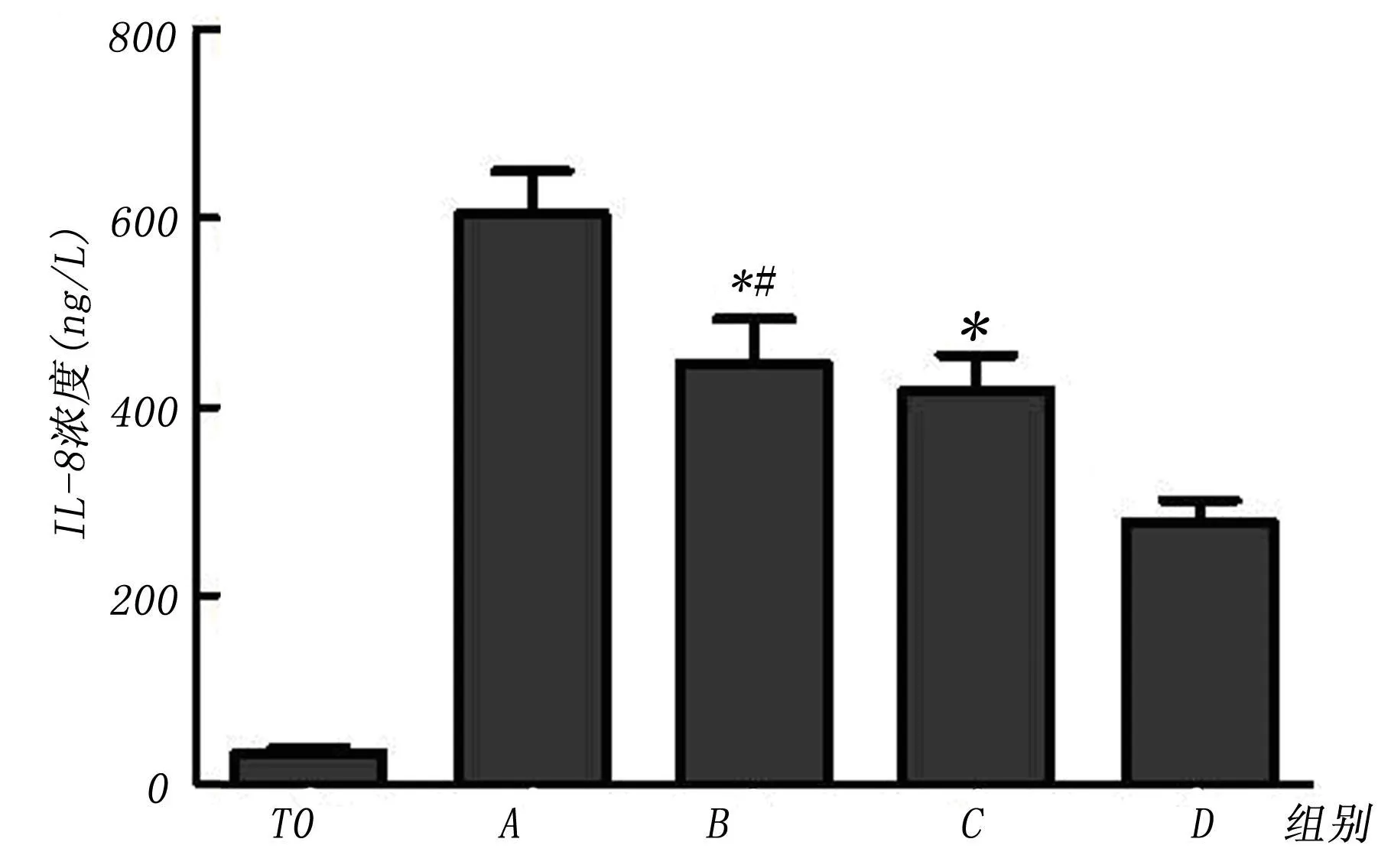
图1 各组管道引起血浆 IL-8浓度变化的比较

图2 各组管道引起血浆 MCP-1浓度变化的比较
2.2 血小板计数和纤维蛋白原含量测定 体外模拟转流 4 h后,各组血小板计数和纤维蛋白原含量均较基线值有所下降,其中 D组下降程度最小,与 B组和 C组两组间有显著性差异(P<0.05),且 B组和 C组之间也有显著性差异(P<0.05)。见表1。
表1 各组血小板计数和纤维蛋白原含量比较(n=6,±s)

表1 各组血小板计数和纤维蛋白原含量比较(n=6,±s)
注:与 D组比较*P<0.05;与 C组比较#P<0.05
基线值 198±22 2.75±0.56 A组 84±14 0.99±0.25 B组 109±19*# 1.50±0.35*#C组 150±17* 1.95±0.33*D组 174±20 2.55±0.55
2.3 电镜结果 扫描电镜观察结果显示各组管道内表面均有不同程度的血小板和纤维蛋白粘附:A组管道表面可见大量血小板和纤维蛋白沉着,大小不均,相互粘连,呈团块状;而 B组、C组和 D组管道表面血小板和纤维蛋白沉着数目较少,且较为分散,其中 D组管道的表面情况明显优于 B组和 C组,C组略优于 B组。见图3。

图3 各组管道内表面的扫描电镜照片(×200)
3 讨 论
血液与 PVC材料表面接触可以引起多种促炎细胞因子的生成和释放,IL-8和 MCP-1就是其中两种重要的趋化因子。它们可以通过趋化和活化白细胞而参与机体的炎症反应和抗感染防御机制[7],且其生成和释放具有不同程度的补体依赖性[6]。本实验结果显示,体外模拟转流 4 h后,各组血浆 IL-8和MCP-1的浓度均较基线值有所升高,其中 D组升高程度最小,与 B组和 C组间有显著性差异(P<0.05),表明D组管道能够较 B组和C组管道更好的抑制血浆 IL-8和 MCP-1的生成和释放,其原因可能与 SPLMWATH的特性有关。研究表明肝素对血浆蛋白和内皮细胞的吸附性与其多糖链的长短呈正相关[8]。由于肝素链只占 SPLMWATH组分的很小一部分,所以 SPLMWATH涂层对血浆蛋白的非特异吸附性较肝素涂层和低分子肝素涂层弱,其引起的补体替代途径激活就少,进而减少 IL-8和 MCP-1的生成和释放。另外,B组和 C组两组间的 IL-8和 MCP-1浓度变化无显著性差异(P>0.05),主要考虑可能是由于肝素涂层和低分子肝素涂层的总肝素链长度相当所致。
血液与 PVC材料表面接触首先引起血浆蛋白的吸附,进而导致接触系统、凝血系统激活及血小板的粘附、聚集和活化[9]。本实验结果表明,体外模拟转流 4 h后,各组血小板计数和纤维蛋白原含量均较基线值有所下降,其中 D组下降程度最小,与 B组和 C组两组间有显著性差异(P<0.05),这可能仍然与 SPLMWATH的低血浆蛋白吸附性和强大的抗凝血活性有关。由于 SPLMWATH涂层 PVC管道表面吸附的纤维蛋白原和凝血酶活化的纤维蛋白较肝素涂层和低分子肝素涂层 PVC管道表面少,从而粘附、聚集于纤维蛋白的血小板也较少,所以扫描电镜观察结果可见 D组管道表面血小板和纤维蛋白沉着数目较少,且较为分散,明显优于 B组和 C组。另外,由于低分子肝素涂层的抗凝血活性优于肝素涂层,故 B组和 C组两组间的血小板计数和纤维蛋白原含量也有显著性差异(P<0.05),C组管道表面情况略优于 B组。
综上所述,各种涂层处理过的 PVC管道均减少了血液相关成分的激活和消耗,而 SPLMWATH涂层 PVC管道具有较肝素涂层和低分子肝素涂层管道更佳的生物相容性,减轻了血液与 PVC管道表面接触所引起的炎性介质生成、释放和凝血系统激活,提示 SPLMWATH可作为一种新型的、更佳的生物活性物质而应用于体外循环管道的表面改性。
[1]Belway D,Rubens FD.Currently available biomaterials for use in cardiopulmonary bypass[J].Expert Rev Med Devices,2006,3(3):345-355.
[2]Chan A,Berry L,O'Brodovich H,et al.Covalentantithrombin-heparin complexes with high anticoagulant activity.Intravenous,subcutaneous,and intratrachealadministration[J].JBiol Chem,1997,272(35):22111-22117.
[3]Klement P,Du Y j,Berry L,et al.Blood-compatible biomaterialsby surface coating with anovel antithrombin-heparin covalent complex[J].Biomaterials,2002,23(2):527-535.
[4]杨剑,易定华,刘金成,等.肝素涂层体外循环管道的制备及生物学性能评价[J].中国生物医学工程学报,2004,23(2):169-174..
[5]Chuang TW,Lin DT,Lin FH.Immobilization of NaIO4-treated heparin on PEG-modified 316L SSsurface for high antithrombin-III binding[J].JBiomed Mater Res A,2008,86(3):648-661.
[6]Lappegard KT,Fung M,Bergseth G,et al.Artificial surfaceinduced cytokine synthesis:effect of heparin coating and complement inhibition[J].Ann Thorac Surg,2004,78(1):38-44,44-45.
[7]Levy JH,Tanaka KA.Inflammatory response to cardiopulmonarybypass[J].Ann Thorac Surg,2003,75(2):S715-S720.
[8]Chan AK,Paredes N,Thong B,et al.Binding of heparin to plasma proteinsand endothelial surfaces is inhibited by covalent linkage to antithrombin[J].Thromb Haemost,2004,91(5):1009-1018.
[9]Li S,PriceR,Phiroz D,etal.System ic inflammatory response during cardiopulmonary bypassand strategies[J].JExtra Corpor Technol,2005,37(2):180-188.

