高效液相色谱法快速测定酱腌菜中的姜黄素
张书芬,芦江会,王全林,沈 坚
(宁波市产品质量监督检验研究院,浙江 宁波 315041)
高效液相色谱法快速测定酱腌菜中的姜黄素
张书芬,芦江会,王全林,沈 坚
(宁波市产品质量监督检验研究院,浙江 宁波 315041)
为探讨用高效液相色谱法快速测定酱腌菜中姜黄素的方法,对提取条件、提取方法、流动相等进行优化实验。结果表明:采用ZORBAX SB C18(150mm×4.6mm,5 μ m)分析柱,磷酸溶液(pH2.5)-乙腈(50:50,V/V)为流动相,420nm的检测波长可以达到理想的分离效果和满意的检出限;该法重复性好,定量检出限为1.5mg/kg、线性范围为1.5~2900.0mg/kg、加标回收率均在95%~108%之间、相对标准偏差均在0.9%~1.6%(n=5)之间。超声提取法和保温振荡浸提法是提取酱腌菜中姜黄素的简单高效的方法。
高效液相色谱法;快速测定;酱腌菜;姜黄素
姜黄素是一种优良的着色剂,是大自然中极为少见的二酮类有色物质,其染色能力大于其他天然色素和人工合成色素柠檬黄、日落黄等。国家标准(GB 2760—2007《食品添加剂使用卫生标准》[1])中规定姜黄及姜黄素允许在酱腌菜、调制乳粉、冷冻饮品、糕点、饮料、调味料等产品中使用,同时限制了相应的最大使用量,其最大允许使用限量根据食品种类的不同从0.01mg/kg到0.7mg/kg,其中姜黄的检出量以姜黄素计。
目前我国还没有检测姜黄素的国家标准方法,相关文献报道测试姜黄和姜黄素的方法有高效液相色谱法[2-3]、毛细管电泳法[4]、紫外-可见分光光度法[5]、荧光分光光度法[6]、薄层扫描法[7]、极谱催化法[8]等。其中以高效液相法最为普遍。绝大多数文献报道的均为检测中药和保健品中的姜黄素的方法,其前处理只对样品进行甲醇溶解就直接上机进行分析,没有相应的前处理过程。2008年施冰[9]发表了食品中姜黄素的测定方法,其前处理主要是参照GB 5009.35—2003《食品中合成着色剂的测定》[10]的前处理方法,前处理非常麻烦,更适合那些复杂基质产品中姜黄素的测定的前处理。对于酱腌菜这类样品基底不是非常复杂,色素比较容易提取的样品来说太过繁琐,在实际检测工作中实用性不强。本实验针对酱腌菜样品,建立一种快速测定姜黄素的方法。
1 材料与方法
1.1 材料、试剂与仪器
姜黄素标样 上海安谱公司;超纯水;甲醇、乙腈(均为色谱纯) 默克公司;其他试剂均为分析纯。
1.2 色谱分析条件
色谱柱为SB C18(250mm×4.6mm,5μm)不锈钢分析柱;流动相为磷酸溶液(pH2.5)-乙腈(50:50,V/V);流速:0.8mL/min;柱温:35℃;检测器波长:420nm;进样量20μL。
1.3 标准溶液的配制
准确称取姜黄素标准品,用甲醇溶解并定容至50mL,配制成姜黄素的含量为500mg/L标准贮备液,用乙醇-水(80:20,V/V)稀释标准储备液,配制成质量浓度为100mg/L标准使用液,4℃冰箱保存。
分别吸取1.0、2.0、5.0、10.0、20.0、50.0mL标准使用液,以乙醇-水(80:20,V/V)定容到100.0mL,配制成质量浓度1.0、2.0、5.0、10.0、20.0、50.0mg/L的标准系列溶液。
1.4 样品处理方法与测定
称取已经打碎均匀化处理的酱腌菜样品2.50g,置于50.0mL离心管中,加入乙醇-水(80:20,V/V)溶液定容至25mL,在70℃水浴振荡器上振荡提取30min,然后取出离心管, 10000r/min离心5min,取上清液过0.45μm的混合纤维素膜,上高效液相色谱分析,标样测试谱图如图1所示。
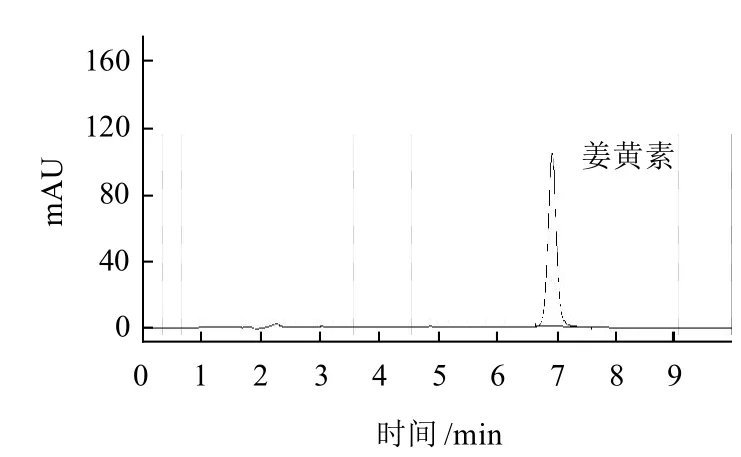
图1 姜黄素的高效液相色谱标准谱图Fig.1 HPLC chromatogram of curcumin standard solution
2 结果与分析
2.1 提取条件的选择
食品中提取姜黄素的文献报道很少,提取姜黄中姜黄素的方法有甲醇、乙醇有机溶剂提取法、碱水热提法、酶解提取法、外场辅助提取法等[11],陈雁虹[12]等对不同条件的提取方法进行比较,结果用80%乙醇溶液温浸提法得到的提取效率最高,这和刘硕谦[13]的研究成果基本一致,80%左右的乙醇溶液提取率最高,可能是一定量的水有助于样品的浸泡,使提取试剂渗入到食品中,从而加速姜黄素类化合物的溶出。
本研究采用80%乙醇溶液,针对实际酱腌菜样品,对回流法、超声提取法、保温振荡浸提法、聚酰胺粉吸附法分别进行实验。
将一定量的酱腌菜样品均质打碎后,取出一定量样品加标混匀,分别用不同的前处理方法进行处理,上机分析,检测回收率,回流法采用80%乙醇溶液浸泡回流,超声提取法采用辐射功率200W、辐射温度60℃,保温振荡提取法采用70℃、200r/min,参照GB/T 5009.35—2003《食品中合成着色剂的测定》方法进行聚酰胺粉的吸附脱附处理实验。
由于酱腌菜样品基体比较简单,不属于高脂肪髙蛋白样品,含水量一般在80%以上,比较容易提取,所以4种提取方法都能保证检测回收率在90%以上。对除聚酰胺粉法外的3种前处理方法还进行提取时间的优化试验(图2),结果表明3种前处理方法经过30min提取后处理回收率均能达到9 0%以上,再延长提取时间到35min时,提取效率没有明显增加,因此本研究提取时间选定为30min。聚酰胺粉吸附法处理步骤繁琐,有经验的操作人员才能达到90%以上的回收率,而且一般需要3h以上的前处理时间,而回流提取方法要用到回流装置,控制水电,操作也相对复杂,所以超声提取法和保温振荡浸提法是提取酱腌菜中姜黄色素的简单高效的提取方法,检测工作者可以根据本单位的设备情况,选择使用不同的前处理方法。本实验采用的是保温振荡浸提法。
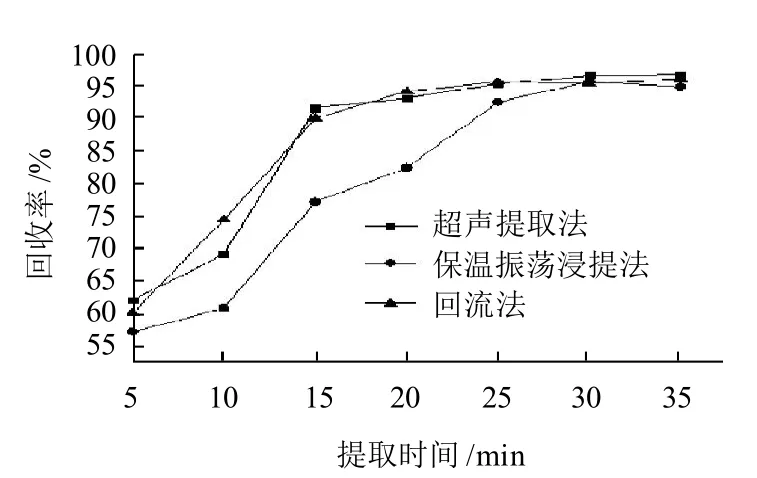
图2 不同前处理方法的提取效率Fig.2 Effects of different pretreatments on extraction efficiency
2.2 过滤膜的选择
由于浸泡液采用80:20乙醇-水,所以分别测试了0.45μm的纤维素膜、混合纤维素膜、聚四氟乙烯膜(PTFE)、聚偏氟乙烯膜(PVDF)和尼龙膜,其中一般的纤维素膜、尼龙膜对姜黄素有很大的吸附作用,严重的可以吸附50%左右。混合纤维素膜、聚四氟乙烯膜和聚偏氟乙烯膜都对处理后的样品有较好的过滤作用,并不对目标化合物有吸附,考虑到价格因素,实验采用混合纤维素膜作为过滤膜。
2.3 流动相的选择
常用的测定色素的流动相有甲醇-乙酸铵体系、甲醇-乙酸钠体系,对于姜黄素的测定,还有采用乙腈-酸性水溶液体系的报道[13],本实验在参照文献的基础上尝试用甲醇-0.02mol/L乙酸铵溶液、乙腈-磷酸溶液(pH2.5)、甲醇-磷酸溶液(pH2.5)3种体系做流动相时,姜黄的具体检测和分离情况如图3所示。
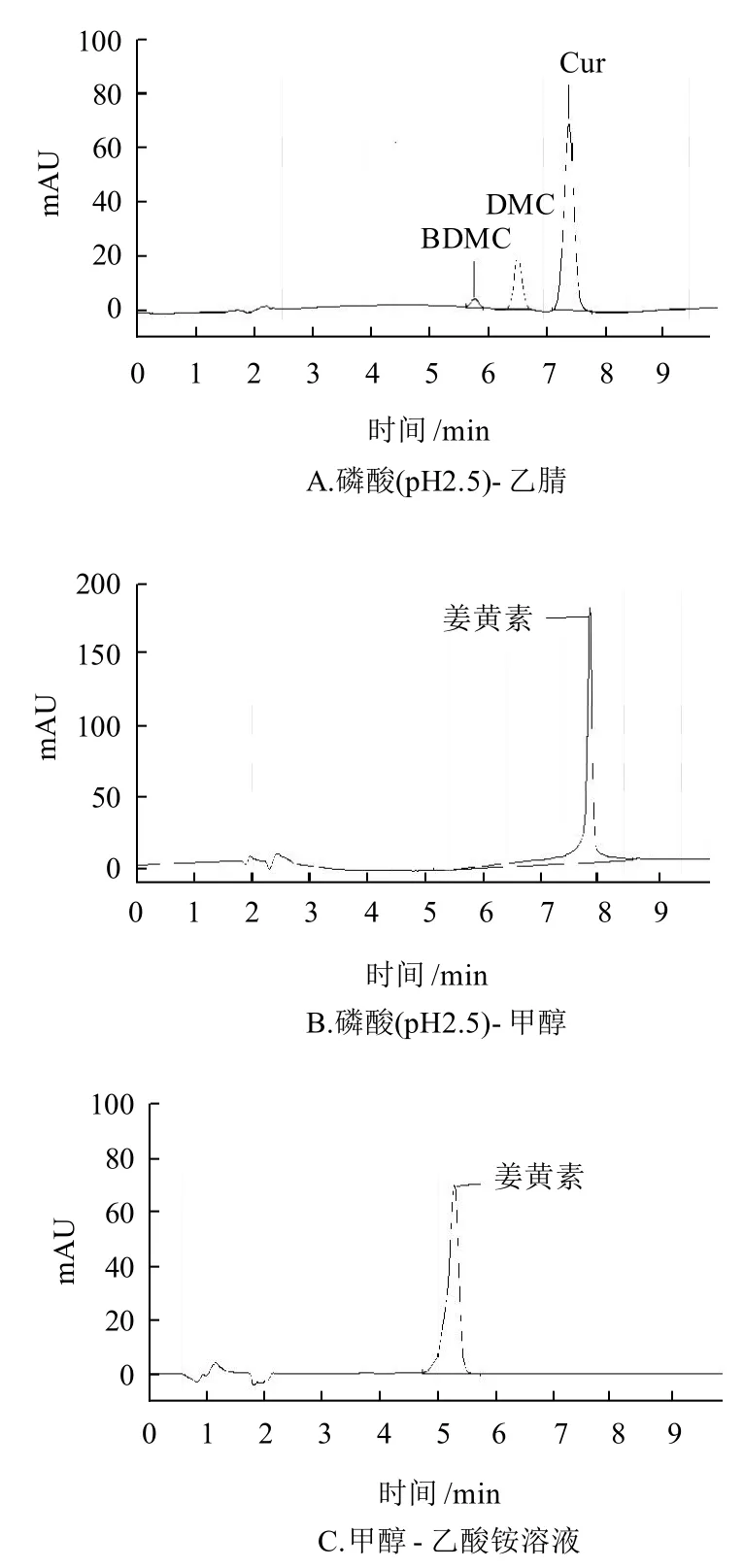
图3 姜黄在不同流动相体系中的分离谱图Fig.3 HPLC chromatogram of Curcuma longa L. under different mobile phase systems
姜黄的主要有效成分为姜黄素(Cur)、去甲氧基姜黄素(DMC)、去二甲氧基姜黄素(BDMC)[13],GB 2760—2007中规定,姜黄以姜黄素计。从图3A可以看出,姜黄素峰型良好,而且能够成功分离去甲氧基姜黄素、去二甲氧基姜黄素。对于实际样品检测时,一般都同时具有3个峰,可以增强定性功能;从图3B可以看出,峰型前伸,峰里面可能包含了去甲氧基姜黄素、去二甲氧基姜黄素的组分;图3C为甲醇-0.02mol/L乙酸铵体系下姜黄的响应谱图,从图3C可以看出,峰型不理想,有一个很大的前伸,峰型不对称,而且也不能将3种组分分开,所以本实验采用乙腈-磷酸溶液(pH2.5)体系作为检测的流动相。
2.4 检测波长的测定
对姜黄素标准溶液在200~600nm处进行扫描(图4),发现其在420~430nm处有最大吸收,这和文献报道基本一致。本实验采用波长420nm检测酱腌菜中的姜黄素,许多物质在该波长处均无响应,谱图干扰比较少,增强了高效液相色谱的定性功能。
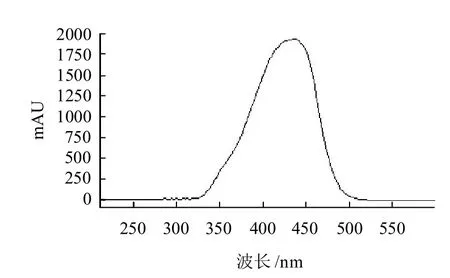
图4 姜黄素的吸收光谱图Fig.4 Absorption spectrum of curcumin
2.5 干扰性实验
由于姜黄色素分子结构中含有多个双键、酚羟基及羰基等,其化学反应能力较强,热稳定性较好,不受Zn、Cu等金属离子的影响,但有文献报道[11]苯甲酸钠、碳酸钠可使姜黄色素的吸收峰有一定程度地增加,对其稳定性具有保护作用。由于目前我国生产的酱腌菜中大多数均添加了山梨酸钾或苯甲酸钠作为防腐剂,同时一般还添加了甜味剂和色素,故本实验通过加标的方法考察了常见的防腐剂/甜味剂和色素对姜黄素测试造成的影响。
在酱腌菜样品处理的测试液中添加100mg/山梨酸、苯甲酸、安赛蜜、糖精钠、甜蜜素及10mg/L柠檬黄、日落黄、苋菜红、胭脂红、亮蓝、靛蓝6种色素,在本实验选定的色谱条件下进行测试,结果表明,该质量浓度范围内苯甲酸对姜黄素的测定无增强效应,其他的甜味剂和防腐剂在该条件下,在谱图上均无响应,对姜黄素的测定和响应无干扰。
2.6 方法的线性范围、检出限、精密度、回收率
将储备液配制成标准系列,在选定的条件下测定标准系列的峰面积(A)响应值,获得姜黄素(n=6)的校准曲线回归方程为A=110.78C-12.46,相关系数为0.99996。实验表明,姜黄素在1.5~2900.0mg/kg范围内与峰面积具有较好的线性关系。当信噪比(RSN)为3时,姜黄素的检出限为1.5mg/kg。
在上述前处理和色谱条件下,分别在榨菜中添加标样,进行不同水平的添加回收率和精密度实验,其测试回收率在95%~108%之间,按标准方法平行测定5次,其相对标准偏差0.9%~1.6%之间,测定结果如表1所示。结果表明本法测定准确,加标回收效率高,精密度好,能够很好地满足于实际样品的测定。
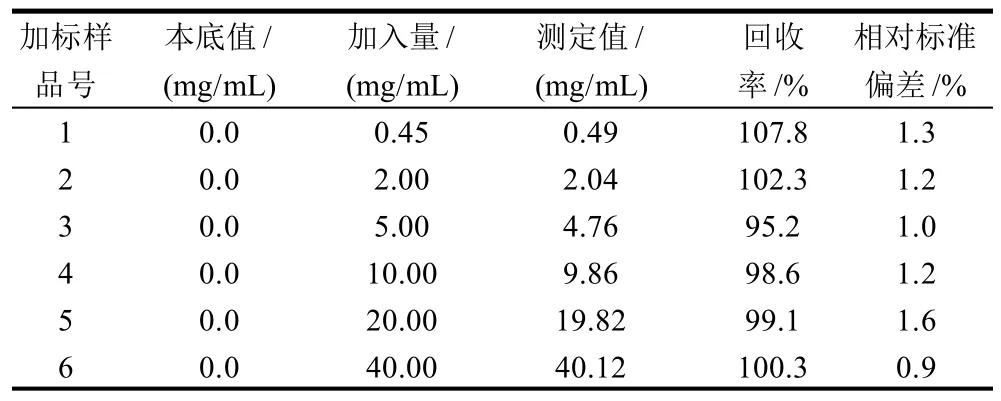
表1 快速测定酱腌菜中姜黄素方法的添加回收率和精密度(n=5)Table 1 Recovery rates and precision of rapid HPLC determination for curcumin in preserved vegetables (n=5)
3 结 论
本实验针对酱腌菜中的姜黄素的测定,优化确定了相对简单的前处理方法,不但前处理时间比传统的聚酰胺粉吸附法大大缩短,而且回收率也有所高,大大的提高了检测效率和准确度。同时本实验通过对分离条件的优化选择,确定了合适的分离条件,线性范围较宽,灵敏度较高,能够满足食品安全监督检测的需要。
[1] GB 2760—2007 食品添加剂使用卫生标准[S].
[2] 陈逸红, 张芬娥, 王慧洁. HPLC测定如意金黄散中姜黄素的含量[J].中成药, 2004, 26(12): 1075-1076.
[3] 李跃红. 高效液相色谱法测定保健食品中姜黄素的含量[J]. 中国卫生检验杂志, 2006, l6(2): 204-205.
[4] 刘保启, 胡孝忠, 王玉春, 等. 高效毛细管电泳法测定姜黄中姜黄素类化合物[J]. 分析测试学报, 2004, 23(1): 109-l11.
[5] 黄燕芬, 洪行球. 分光光度法酒定总姜黄素的含量及方法学考察[J].浙江中医学院学报, 1999, 23(6): 24-25.
[6] 严建伟, 鲍慰文, 集炳圻, 等. 荧光分光光度法涸定姜黄制荆中的姜黄素[J]. 中国现代应用药学, 1998, 15(2): 44-45.
[7] 吴桂碧. 薄层扫描法测定定姜黄中姜黄素的含量[J]. 华西药学杂志,1995, 10(3): l72-l74.
[8] 程司, 刘智广, 曹云新. 姜黄素的化学测定的新方法[J]. 第四军医大学学报, 2000, 21(2): 241-243.
[9] 施冰. 高效液相色谱法测定食品中的姜黄素[J]. 福建分析测试, 2008,17(3): 28-30.
[10] GB/T 5009.35—2003 食品中合成色素的测定[S].
[11] 张炎强, 李湘洲, 周雯雯. 姜黄色素的提取与研究进展[J]. 经济林研究, 2006, 24(2): 74-77.
[12] 陈雁虹, 秦波, 张媛媛, 等. 姜黄素不同提取方法比较研究[J]. 中国中医药信息杂志, 2008, 15(7): 55-56.
[13] 刘硕谦, 刘仲华, 黄建安, 等. 反相高效液相色谱法同时测定姜黄药材中三个组分的含量[J]. 分析化学, 2005, 33(3): 309-312.
Rapid Determination of Curcumin in Preserved Vegetables by High Performance Liquid Chromatography
ZHANG Shu-fen,LU Jiang-hui,WANG Quan-lin,SHEN Jian
(Ningbo Academy of Product Quality Supervision and Inspection, Ningbo 315041, China)
In this study, the rapid determination of curcumin in preserved vegetables by high performance liquid chromatogram(HPLC) was investigated. The extraction conditions, extraction methods and mobile phase selection were optimized. Results indicated that the optimal determination conditions were ZORBAX SB C18 (150 mm × 4.6 mm, 5 μm) as the chromatographic column, phosphorous acid solution (pH 2.5)-acetonitrile ratio of 50:50, and determination wavelength of 420 nm. Under the optimal determination conditions, ideal separation effect and satisfactory detection limit were achieved. This determination method is characteristics of good repeatability. Meanwhile, the detection limit and linear range of this method were 1.5 mg/kg and 1.5-2900.0 mg/kg, respectively. Recovery rate of this method was in the range of 95%-108% with relative standard deviation of 0.9%-1.6% (n=5).
high performance liquid chromatography (HPLC) method;rapid determination;preserved vegetables;curcumin
TS207.3
A
1002-6630(2010)24-0318-04
2009-09-15
张书芬(1977—),女,高级工程师,硕士研究生,研究方向为食品及相关产品的质量安全及检测。E-mail:shufenzhang@hotmail.com

